Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Therapie und Prophylaxe der<br />
akuten infektiösen Enteritis<br />
Zusammenfassung<br />
In den Industrieländern sind durch verbesserte hygienische Maßnahmen enteritische<br />
bakterielle Infektionen seltener geworden. In jüngster Zeit kommt es allerdings zu neuen<br />
Herausforderungen im Bereich gastrointestinaler Infektionen. Enteropathogenen Viren<br />
bei Kindern und älteren Menschen sind häufige Erkrankungen mit über 1.000.000<br />
geschätzten Erkrankungsepisoden pro Jahr in Deutschland. Sie können bei dieser<br />
Risikogruppe auch zu erheblichen klinischen Problemen führen. Insbesondere die<br />
Infektion mit Noroviren hat in den letzten Jahren sehr stark zugenommen und ist mit<br />
über 100.000 Meldungen im Jahr 2007 zur häufigsten meldepflichtigen Erkrankung<br />
überhaupt geworden. Darüber hinaus wird eine Zunahme der Clostridium-difficileassoziierten<br />
Diarrhö registriert. Ein neuer C. difficile-Stamm mit einer erhöhten Pathogenität<br />
und Kontagiosität wurde zunächst in Nordamerika, später auch in Europa und<br />
kürzlich auch in Deutschland nachgewiesen. Eine weitere Problemgruppe bildet die<br />
zunehmende Zahl immunsupprimierter Patienten, wie z. B. die HIV-Infizierten, die<br />
Chemotherapierten und die vielen Patienten, die wegen anderer Erkrankungen oder<br />
nach Organtransplantation immunsuppressiv behandelt werden müssen. In der Regel<br />
sind gastrointestinale Infektionen, die zu Durchfallerkrankungen führen, selbstlimitierend<br />
und dauern nicht länger als 5–10 Tage. Als Erreger für diese Erkrankungen kommen<br />
eine Reihe von Viren und Bakterien infrage, deren Behandlung hier besprochen wird.<br />
Die Therapie der infektiösen akuten Enteritis hat in erster Linie eine Flüssigkeits- und<br />
Elektrolytsubstitution zum Ziel.<br />
Schlüsselwörter<br />
Infektiöse Diarrhö | Clostridium difficile | pseudomembranöse Kolitis | Noroviren |<br />
Rotavirusimpfstoff | CMV-Kolitis | Campylobacterenteritis | Salmonellenenteritis<br />
Prof. <strong>Dr</strong>. <strong>Dr</strong>. T. Schneider<br />
Medizinische Klinik I<br />
Infektiologie<br />
Charité – Universitätsmedizin<br />
Campus Benjamin Franklin (CBF)<br />
Hindenburgdamm 30<br />
12203 Berlin<br />
Fragebeantwortung unter<br />
www.falkfoundation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
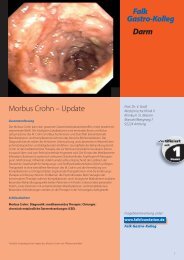
Titelbild: Endoskopisches Bild einer pseudomembranösen Kolitis<br />
16
Therapie und Prophylaxe der akuten infektiösen<br />
Enteritis<br />
Einleitung<br />
In den Industrieländern konnten durch verbesserte hygienische Maßnahmen und besonders<br />
durch die Trennung zwischen Abwasser und Trinkwasser enteritische bakterielle<br />
Infektionen weitgehend zurückgedrängt werden. In jüngster Zeit kommt es allerdings<br />
zu neuen Herausforderungen im Bereich gastrointestinaler Infektionen. So sind<br />
Infektionen mit enteropathogenen Viren bei Kindern und älteren Menschen sehr häufig<br />
und können bei dieser Risikogruppe auch zu erheblichen klinischen Problemen<br />
führen. Insbesondere die Infektion mit Noroviren hat in den letzten Jahren sehr stark<br />
zugenommen und ist mit über 100.000 Meldungen im Jahr 2007 zur häufigsten meldepflichtigen<br />
Erkrankung überhaupt geworden. Bei dieser hochkontagiösen Infektion<br />
ist das Management zur Verhinderung einer weiteren Ausbreitung der Infektion im<br />
Krankenhaus oder in Pflegeeinrichtungen von größter Bedeutung. Darüber hinaus<br />
wird eine Zunahme der Clostridium-difficile-assoziierten Diarrhö registriert. Ältere<br />
Menschen sind durch diese Infektion besonders gefährdet. Hierbei spielt ein neuer<br />
C. difficile-Stamm mit einer erhöhten Pathogenität und Kontagiosität eine zentrale<br />
Rolle. Dieser Stamm wurde zunächst in Nordamerika, später in Europa und kürzlich<br />
auch in Deutschland nachgewiesen. Eine weitere Problemgruppe bildet die zunehmende<br />
Zahl immunsupprimierter Patienten, wie z. B. die HIV-Infizierten, die Chemotherapierten<br />
und die vielen Patienten, die wegen anderer Erkrankungen oder nach<br />
Organtransplantation immunsuppressiv behandelt werden müssen. Aufgrund der<br />
Fülle an verschiedenen Erregern, der Zunahme an neu beschriebenen Pathogenen<br />
und der Entwicklung von Resistenzen, ist die Behandlung der gastrointestinalen Infektionen<br />
äußerst komplex. Enteritische Infektionen manifestieren sich klinisch gewöhnlich<br />
durch Diarrhö, manchmal in Kombination mit Erbrechen und Fieber. In der Regel<br />
sind gastrointestinale Infektionen, die zu Durchfallerkrankungen führen, selbstlimitierend<br />
und dauern nicht länger als 5–10 Tage. Als Erreger für diese Erkrankungen kommen<br />
eine Reihe von Viren und Bakterien infrage, deren Behandlung hier besprochen<br />
wird. Die Therapie der infektiösen akuten Enteritis hat in erster Linie eine Flüssigkeitsund<br />
Elektrolytsubstitution zum Ziel.<br />
P Die infektiöse Diarrhö ist ein komplexes<br />
medizinisches Problem, welches<br />
besonders durch die Norovirusepidemien<br />
und das zunehmende Problem mit<br />
Clostridium-difficile-assoziierten<br />
Durchfallerkrankungen (CDAD) aktuell<br />
an Bedeutung gewonnen hat.<br />
Bakterielle Lebensmittelvergiftungen<br />
Enterotoxin-induzierte Erkrankungen<br />
Einige Bakterien produzieren Toxine, die in Lebensmitteln auch noch nach dem Absterben<br />
der Bakterien wirksam sein können. Die durch Staphylococcus aureus, Clostridium<br />
perfringens und Bacillus cereus produzierten Toxine führen nur zu kurz anhaltenden<br />
Episoden von Erbrechen, Diarrhö und abdominellen Krämpfen, die in der Regel nur<br />
wenige Stunden anhalten und keiner spezifischen Therapie bedürfen. Die wichtigste<br />
therapeutische Maßnahme bei allen Durchfallerkrankungen ist die ausreichende Flüssigkeits-<br />
und Elektrolytsubstitution.<br />
P Eine „Lebensmittelvergiftung“<br />
durch Toxine von Staphylokokken<br />
hat eine sehr kurze Inkubationszeit<br />
und ist selbstlimitierend.<br />
Bakterielle Diarrhö<br />
Obwohl enteropathogene Bakterien in der Regel auf Antibiotika in vitro sensibel sind,<br />
profitieren die meisten dieser Patienten nicht von einer antibiotischen Therapie. In<br />
manchen Fällen kann diese sogar schädlich sein. Eine Zusammenfassung zur antibiotischen<br />
Therapie der bakteriellen Diarrhö ist in Tabelle 1 dargestellt. Nach Salmonellen-<br />
wie auch Campylobacterenteritis können gehäuft Reizdarmsyndrome auftreten.<br />
Der genaue pathogenetische Zusammenhang hierzu ist bisher nicht geklärt.<br />
P Die wichtigste Therapiemaßnahme<br />
bei jeder Diarrhö ist die Flüssigkeitssubstitution.<br />
Eine antibiotische<br />
Therapie ist nur bei schweren Verläufen<br />
oder bei Risikopatienten indiziert.<br />
Nach bakterieller Enteritis kann<br />
ein Reizdarmsyndrom auftreten.<br />
17
Behandlung bakterieller Enteritiden<br />
Tab. 1<br />
Erreger Antibiotische Therapie Medikament<br />
Salmonellen<br />
Shigellen und<br />
EIEC<br />
Campylobacter<br />
Yersinien<br />
nein<br />
Ausnahme: bei immungeschwächten<br />
Personen und<br />
septischen Verlaufsformen<br />
nur bei mittelschweren<br />
oder schweren Verlaufsformen<br />
oder Immunschwäche<br />
nur bei sehr schweren<br />
Verlaufsformen<br />
nein<br />
Ausnahme: Eisenüberladung<br />
und/oder Sepsis<br />
–<br />
2 x 500 mg Ciprofloxacin<br />
pro Tag oral über 7 Tage<br />
4 x 500 mg Ampicillin pro<br />
Tag oral oder 2 x Trimethoprim/Sulfamethoxazol<br />
(160/800 mg) pro Tag oral<br />
oder 2 x 500 mg Ciprofloxacin<br />
pro Tag oral je über<br />
5 Tage<br />
4 x 500 mg Erythromycin<br />
pro Tag oral über 7 Tage<br />
–<br />
z. B. 2 x 500 mg Ciprofloxacin<br />
oral/Tag bis zu 8 Wochen<br />
EPEC, ETEC, EHEC nein –<br />
EPEC = enteropathogene Escherichia (E.) coli; ETEC = enterotoxische E. coli;<br />
EIEC = enteroinvasive E. coli; EHEC = enterohämorrhagische E. coli<br />
Salmonellen als Enteritiserreger (nicht-typhöse Salmonellen)<br />
Die enteritischen Salmonellen verursachen bei immunkompetenen Patienten meist<br />
mild verlaufende, selbstlimitierte Diarrhöen, die nur wenige Tage anhalten und keiner<br />
antibiotischen Therapie bedürfen. Die Diagnose wird durch den kuturellen Nachweis<br />
des Erregers im Stuhl gesichert. Hierfür wird meist ein Zeitraum von 3 Tagen benötigt.<br />
Bei Patienten mit Fieber kann der Erreger auch in Blutkulturen nachgewiesen werden.<br />
Die Schleimhautschädigung reicht von diskreten Entzündungszeichen über mäßige<br />
Entzündung mit Fibrinausschwitzung bis zu oberflächigen Ulzerationen. Eine antibiotische<br />
Therapie kann sogar den Krankheitsverlauf verlängern und zur Dauerausscheidung<br />
des Erregers führen. Daher sollten nur schwere, komplizierte Verläufe oder<br />
immunsupprimierte Patienten behandelt werden. Zurzeit wird hierfür Ciprofloxacin<br />
(2 x 500 mg/Tag) oral über 7 Tage empfohlen [1]. In den USA werden auch Patienten<br />
über 65 Jahre mit Antibiotika behandelt, da bei genereller Arteriosklerose das Risiko<br />
für eine Gefäßinfektion mit Ausbildung eines mykotischen Aneurysmas erhöht sein<br />
könnte. Bei Dauerausscheidern mit hohem Verbreitungsrisiko (z. B. Beschäftigte in Lebensmittelbetrieben)<br />
wird die Erregerelimination mit Ciprofloxacin (2 x 500 mg/Tag)<br />
über 4 Wochen in den meisten Fällen erreicht [2].<br />
P Die Salmonellenenteritis ist in der<br />
Regel eine selbstlimitierende Erkrankung,<br />
die nur in besonderen klinischen<br />
Situationen einer antibiotischen<br />
Therapie bedarf.<br />
Shigellenenteritis<br />
Die Shigellenenteritis ist in Deutschland sehr selten und wird meist als Reiseerkrankung<br />
erworben. Die Shigellenenteritis kann sich klinisch unterschiedlich schwer von<br />
milden Verlaufsformen bis hin zu schweren blutigen Durchfallerkrankungen manifestieren.<br />
Die Diagnostik stützt sich auf die kulturelle Anzucht des Erregers aus dem Stuhl<br />
und dem Toxinnachweis. Die Behandlung von Shigellen ist weltweit durch die zunehmende<br />
Resistenz dieser Bakterien gegen diverse Antibiotika erschwert. Dies wird<br />
durch den unsachgemäßen übermäßigen Einsatz von Antibiotika und durch die Verwendung<br />
dieser Medikamente von Fleischlieferanten im Futter von Schweinen und<br />
Rindern gefördert [3]. In den meisten Fällen führt die Infektion zu einer kurzen selbstlimitierten<br />
Durchfallerkrankung, die keiner antibiotischen Therapie bedarf. Schwere<br />
Erkrankungsverläufe können eine antibiotische Therapie erforderlich machen. Auf-<br />
P Die Shigellenenteritis ist in<br />
Deutschland selten.<br />
18
grund der erwähnten zunehmenden Resistenz ist eine nach einem Antibiogramm<br />
gezielte Behandlung wünschenswert. Ampicillin (4 x 500 mg/Tag), Trimethoprim-Sulfamethoxazol<br />
(2 x 160 mg/800 mg/Tag) oral und Ciprofloxacin (2 x 500 mg/Tag) oral,<br />
jeweils über 5 Tage, sind dabei wirksame Therapieoptionen [1, 4].<br />
Campylobacterenteritis<br />
Campylobacterinfektionen zählen mittlerweile zu den häufigsten bakteriellen Enteritiden<br />
und sind in manchen Bundesländern schon häufiger als die Salmonelleninfektionen.<br />
Die Diagnostik beruht auf dem kulturellen Nachweis des Erregers aus dem Stuhl<br />
des Patienten. Die Anzucht gelingt in nur etwas über der Hälfte der Fälle. In den anderen<br />
Fällen kann man die Infektion im Nachhinein durch einen 3-fachen Antikörpertiter<br />
im Serum noch nachweisen. Dies hat aber keine klinische Relevanz. Die Infektion ist in<br />
der Mehrzahl der Fälle auf 1 Woche limitiert, in selteneren Fällen dauert die Erkrankung<br />
bis zu 2 Wochen. Rezidive werden bei Campylobacterinfektionen häufiger als bei<br />
Salmonelleninfektionen beobachtet. Im Gefolge der Campylobacterinfektion können<br />
immunologische Reaktionen wie Guillain-Barré-Syndrom, reaktive Arthritiden oder<br />
ein Erythema nodosum auftreten. Die meisten Campylobacterinfektionen verlaufen<br />
selbstlimitierend (Therapie: Flüssigkeits- und Elektrolytsubstitution). Eine Antibiotikabehandlung<br />
beeinflusst den Verlauf in diesen Fällen nicht und wird nur bei schweren<br />
Verlaufsformen und bei Patienten mit einer Immundefizienz empfohlen. Therapie der<br />
Wahl ist Erythromycin 4 x 500 mg pro Tag oral über 1 Woche. Wegen der Resistenzentwicklung<br />
von 41–88% gegenüber Quinolonen in Europa und Asien und auch einer<br />
zunehmenden Resistenz in den USA und Kanada sollten die bei anderen enteropathogenen<br />
Bakterien oft verwendeten Quinolone (z. B. Ciprofloxacin) nicht mehr eingesetzt<br />
werden [5]. Azithromycin in einer Dosierung von 500 mg pro Tag oral für<br />
3 Tage konnte ebenfalls erfolgreich in Gebieten mit hoher Quinolon-Resistenz eingesetzt<br />
werden [6].<br />
P Die Campylobacterenteritis gehört in<br />
Deutschland zu den häufigsten Ursachen<br />
einer bakteriellen Enteritis und<br />
ist nicht selten mit immunologischen<br />
Folgeerkrankungen assoziiert (Arthritis,<br />
Guillain-Barré-Syndrom, Erythema<br />
nodosum). Die Quinolon-Resistenz<br />
nimmt zu, Makrolide sind die<br />
Therapeutika der Wahl.<br />
Yersinienenteritis<br />
Die Yersinienenteritis ist eine extrem seltene Erkrankung. Diese Durchfallerkrankung<br />
dauert meist nicht länger als 10 Tage und bedarf in der Regel keiner antibiotischen<br />
Therapie. Hochrisikopatienten mit Immundefizienz einschließlich Patienten mit Leberzirrhose<br />
und Patienten mit einer Eisenüberladung (z. B. Eisenspeichererkrankung)<br />
hingegen können eine Yersiniensepsis entwickeln und sollten antibiotisch behandelt<br />
werden. Kleine unkontrollierte Studien an Patienten mit Yersiniensepsis haben einen<br />
Effekt von Fluoroquinolonen allein oder in Kombination mit Cephalosporinen oder<br />
Aminoglycosiden der dritten Generation gezeigt [7].<br />
P Hochrisikopatienten (Immundefizienz,<br />
Eisenüberladung) sollten<br />
antibiotisch behandelt werden.<br />
Clostridium-difficile-assoziierte Diarrhö (CDAD)<br />
C. difficile-assoziierte Erkrankungen (CDAD), von der Antibiotika-assoziierten Diarrhö<br />
bis zur pseudomembranösen Kolitis, stellen schwerwiegende nosokomiale Probleme<br />
dar [8]. Die Kosten u. a. durch intensivere Betreuung und verlängerte Krankenhausaufenthalte<br />
werden in Europa bis auf 3 Milliarden Euro/Jahr geschätzt [9, 10].<br />
In den letzten Jahren sind vor allem in Nordamerika Ausbrüche mit einem neuen<br />
hochvirulenten Stamm von C. difficile beschrieben worden, bei denen eine um den<br />
Faktor 5–20 erhöhte Inzidenz sowie eine um den Faktor 3–5 erhöhte Morbidität und<br />
Letalität auffiel. Seit 2003 konnte der neue Stamm auch in England, Belgien, den Niederlanden,<br />
Frankreich und Österreich isoliert werden. Mittlerweile wurde der Stamm<br />
auch in Deutschland nachgewiesen. Typischerweise manifestiert sich die CDAD als<br />
akute wässrige Diarrhö mit krampfartigen Unterbauchschmerzen, erhöhter Temperatur,<br />
einer Leukozytose im Blut und Leukozyten im Stuhl. Die abdominellen Beschwerden<br />
treten meist 5–10 Tage nach Beginn der Antibiotikatherapie auf, selten bereits am<br />
zweiten Tag oder erst mehrere Monate nach deren Abschluss. Das klinische Spektrum<br />
der CDAD reicht von einer leichten Diarrhö ohne entzündliche Schädigung der Mukosa<br />
über eine Kolitis unterschiedlicher Ausprägung mit fakultativer (in 10–20% der Fäl-<br />
19
le) Bildung der charakteristischen Pseudomembranen (Abb. 1) mit den typischen histologischen<br />
Veränderungen bis hin zur fulminanten Kolitis. Die Durchfälle sind breiig<br />
bis wässrig, seltener auch blutig. Je nach Schweregrad kann es zur Dehydratation,<br />
Elektrolytentgleisung oder Hypoproteinämie kommen. Gefürchtete Komplikationen<br />
mit signifikanter Letalität sind das toxische Megakolon und die häufig zur Sepsis führende<br />
<strong>Darm</strong>perforation. Obwohl C. difficile als häufigste Ursache der erregerbedingten<br />
Antibiotika-assoziierten Kolitis identifiziert wurde, sollte betont werden, dass in der<br />
Mehrheit der Fälle die Antibiotika-assoziierte Diarrhö nicht infektiöser Genese, sondern<br />
durch Störungen der bakteriellen Flora bedingt ist.<br />
Bei Verdacht auf eine CDAD kann die Endoskopie mit dem Nachweis der typischen<br />
Pseudomembranen rasch zur Diagnosesicherung führen (Abb. 1). In den meisten Fällen<br />
ist jedoch eine weiterführende mikrobiologische Diagnostik notwendig. Diese beruht<br />
auf dem Nachweis der Toxine sowie des Erregers (bzw. seiner Antigene) aus einer<br />
frisch gewonnenen Stuhlprobe.<br />
Abb. 1<br />
Endoskopisches Bild einer<br />
pseudomembranösen Kolitis<br />
Die erste und wichtigste Maßnahme nach Diagnosestellung einer CDAD ist das Absetzen<br />
von Antibiotika, soweit die klinische Situation des Patienten dies zulässt. Eine<br />
supportive Therapie zielt auf Normalisierung des Wasser- und Elektrolythaushalts.<br />
Asymptomatische Keimträger oder Erkrankte mit milder Symptomatik bedürfen keiner<br />
spezifischen Therapie. Indikationen zur antibiotischen Therapie sind Hinweise für<br />
das Vorliegen einer Kolitis (Fieber, Leukozytose, ggf. endoskopischer Befund), schwere<br />
Diarrhö, persistierende Diarrhö nach Absetzen des auslösenden Antibiotikums oder<br />
die Notwendigkeit einer fortgesetzten Antibiotikatherapie.<br />
In einer Metaanalyse fand sich kein Unterschied im klinischen Ansprechen auf Metronidazol,<br />
Bacitracin, Fusidinsäure oder Vancomycin (Evidenzlevel I–II) [11]. Bezüglich<br />
der Elimination der Clostridien aus dem Stuhl zeigte sich in einer kleinen Studie eine<br />
leichte Überlegenheit für Teicoplanin [12].<br />
Um die Verbreitung Vancomycin-resistenter Enterokokken nicht zu begünstigen und<br />
auch aus Kostengründen (Tagestherapiekosten für Metronidazol ca. 2,50 für Vancomycin<br />
ca. 75 Euro) ist seit Mitte der 1990er-Jahre Metronidazol als Standardtherapie<br />
der CDAD etabliert [13]. Bei Ansprechen auf die Therapie kommt es in den meisten<br />
Fällen zur raschen Entfieberung und zum Sistieren der Diarrhö nach 4–5 Tagen. Verlaufsuntersuchungen<br />
auf Clostridien oder deren Toxin im Stuhl haben keinen Einfluss<br />
auf die Therapiedauer. Sollte eine orale Therapie nicht möglich sein, kann Metronidazol<br />
(nicht aber Vancomycin) auch intravenös appliziert werden. Für die Therapie<br />
schwerkranker (Sub-)Ileus-Patienten wird auf der Basis von Expertenmeinungen die<br />
Kombinationstherapie von Vancomycin (bis 4 x 500 mg) per Magensonde und intravenös<br />
appliziertem Metronidazol empfohlen [12] (Tab. 2). Aktuelle Beobachtungsstudien<br />
aus Nordamerika deuten auf eine Häufung schwerer Verläufe unter Metronidazol-Therapie<br />
hin [14, 15]. Da diese Daten retrospektiv erhoben wurden, der Einsatz von<br />
Metronidazol oder Vancomycin somit nicht randomisiert erfolgte und es zudem im<br />
Beobachtungszeitraum zu einer CDAD-Epidemie durch einen neuen, virulenteren<br />
Stamm gekommen war, ist die Aussagekraft dieser Studien nicht ausreichend, um<br />
derzeit zu einer Änderung der obigen Empfehlungen zu führen.<br />
20
Ein erhebliches Problem in der Therapie der CDAD ist das signifikante Risiko zum klinischen<br />
Rezidiv. Es tritt in ca. 20% der mit Metronidazol oder Vancomycin behandelten<br />
Patienten meist innerhalb von 3–21 Tagen auf [12]. Risikofaktoren für ein Rezidiv<br />
sind erneute Antibiotikaexposition, Alter > 65 Jahre, schwere Grunderkrankung, Hypoalbuminämie,<br />
längerer Krankenhausaufenthalt, Aufenthalt auf Intensivstationen<br />
sowie noch nicht näher charakterisierte bakterielle Faktoren. Da die Therapie des ersten<br />
Rezidivs die gleiche Erfolgswahrscheinlichkeit besitzt wie die Therapie der Erstmanifestation,<br />
erfolgt die erste Re-Therapie erneut mit Metronidazol. Beim zweiten<br />
Rezidiv wurde eine intermittierende ausschleichende Vancomycin-Therapie über<br />
7 Wochen empfohlen [16]. In einer randomisierten Studie konnte das zusätzlich zu<br />
einer antibiotischen Therapie verabreichte Probiotikum Saccharomyces boulardii bei<br />
rezidivierender CDAD (nicht aber bei Erstmanifestation) das Risiko weiterer Rezidive<br />
senken [17] (Tab. 2).<br />
Therapie der CDAD<br />
Tab. 2<br />
CDAD 1. Rezidiv > 1. Rezidiv sehr schwere Fälle<br />
(<strong>Darm</strong>perforation,<br />
Peritonitis,<br />
toxisches<br />
Megakolon)<br />
Metronidazol<br />
oral (i. v.)<br />
(4 x 250 mg oder<br />
3 x 500 mg)<br />
für 10 Tage<br />
bei Unverträglichkeit,<br />
Gravidität<br />
oder Stillen:<br />
Vancomycin oral<br />
(4 x 125 mg)<br />
für 10 Tage*<br />
Metronidazol<br />
oral (i. v.)<br />
(4 x 250 mg oder<br />
3 x 500 mg)<br />
für 10 Tage<br />
bei Unverträglichkeit,<br />
Gravidität<br />
oder Stillen:<br />
Vancomycin oral<br />
(4 x 125 mg)*<br />
Metronidazol<br />
oder<br />
Vancomycin oral<br />
14–21 Tage<br />
+ Saccharomyces<br />
boulardii<br />
Metronidazol<br />
evtl. i. v.<br />
+ Vancomycin über<br />
Ernährungssonde<br />
totale Kolektomie<br />
erwägen<br />
* Vancomycin ist intravenös bei CDAD unwirksam<br />
Die geschilderten zunehmenden Probleme bei der Antibiotikatherapie machen die<br />
Entwicklung neuer Substanzen zur Behandlung der CDAD dringend notwendig. Ein<br />
monoklonaler Antikörper gegen das Toxin A von C. difficile wird gerade in einer Phase-<br />
II-Studie getestet [18]. Zurzeit läuft außerdem eine internationale, multizentrische Studie<br />
zur Wirksamkeit eines Toxinbinders (Tolevamer) im Vergleich zu Metronidazol und<br />
Vancomycin. In einer ersten klinischen Studie bei Patienten mit leichter bis mittelschwerer<br />
CDAD zeigte Tolevamer eine vergleichbare Wirksamkeit wie oral verabreichtes<br />
Vancomycin [19]. Tendenziell kam es unter Vancomycin zu einem schnelleren<br />
Ansprechen, hingegen wurde unter Tolevamer eine geringere Rezidivrate beobachtet<br />
(19). Die im Moment laufenden großen Studien müssen zeigen, ob sich dieses Ergebnis<br />
bestätigen lässt, und ob die Tendenz zur Hypokaliämie bei Tolevamer klinisch relevant<br />
wird.<br />
CDAD kann in seltenen Fällen zu <strong>Darm</strong>perforation, Peritonitis und toxischem Megakolon<br />
führen. Diese Verläufe sind mit einer erhöhten Letalität assoziiert, und ein chirurgisches<br />
Vorgehen muss in solchen Fällen erwogen werden. In einer kleinen retrospektiven<br />
Untersuchung war die totale Kolektomie anderen Resektionsverfahren überlegen.<br />
Es starben 11% (1/9) in der totalen Kolektomie- und alle in der Hemikolektomie-Gruppe<br />
(4/4) [20].<br />
Die Übertragung erfolgt fäkal-oral, über die Umwelt und über die Hände des Personals,<br />
von einem kolonisierten oder infizierten Patienten ausgehend [21]. Die Prävention<br />
beruht auf drei Stufen: 1) rationale Antibiotikatherapie [22], 2) Kontaktisolierung<br />
der betroffenen Patienten sowie 3) Reinigung der Umgebung.<br />
P Die CDAD ist ein zunehmendes<br />
klinisches Problem, das vor allem bei<br />
älteren Patienten im Krankenhaus zur<br />
Mortalität beitragen kann. Wenn ein<br />
Absetzen des auslösenden Antibiotikums<br />
nicht ausreicht oder Antibiotika<br />
weiterhin gegeben werden müssen,<br />
sollte primär Metronidazol zur Therapie<br />
der CDAD gegeben werden.<br />
21
Escherichia-coli-bedingte Diarrhö<br />
Escherichia coli (E. coli) gehört zur normalen <strong>Darm</strong>flora. Es gibt aber einige Vertreter<br />
dieser Gruppe, die durch die Bildung bestimmter Pathogenitätsfaktoren zu Erkrankungen<br />
führen können. Bei einigen E. coli wird die genetische Information für die Pathogenität<br />
durch bestimmte Viren (Bakteriophagen) übertragen.<br />
Enteropathogene E. coli (EPEC)<br />
EPEC wurden als erste E. coli-Gruppe erkannt, die Diarrhöen auslösen kann. Die Übertragung<br />
erfolgt von Person zu Person wahrscheinlich fäkal oral. Insbesondere bei Ausbrüchen<br />
von Durchfallerkrankungen bei Neugeborenen durch diesen Erreger kam es<br />
zu Verläufen mit hoher Mortalität. Die Anzahl der EPEC-Infektionen in den Industrienationen<br />
ist rückläufig. In den Entwicklungsländern ist die EPEC-Infektion bei Kindern<br />
unter 6 Monaten die häufigste bakterielle Ursache für Durchfallerkrankungen. Wie bei<br />
allen Durchfallerkrankungen stehen auch bei dieser Infektion die Flüssigkeits- und<br />
Elektrolytsubstitution sowie die ausreichende Kalorienzufuhr im Vordergrund. Da die<br />
Erkrankung meist selbstlimitierend verläuft, ist eine antibiotische Therapie in der Regel<br />
nicht notwendig. Trimethoprim-Sulfamethoxazol kann unter bestimmten Umständen<br />
die Erkrankungsdauer verkürzen [23].<br />
Enterotoxische E. coli (ETEC)<br />
ETEC sind eine häufige Ursache für Diarrhöen bei Kindern in Entwicklungsländern.<br />
Darüber hinaus ist ETEC der bei der Reisediarrhö am häufigsten gefundene Erreger.<br />
Gelegentlich verursacht er auch lokale Epidemien von Durchfällen durch kontaminierte<br />
Speisen oder Getränke. Da die Erkrankung meist selbstlimitierend ist, sollte sich<br />
die Behandlung auf die Rehydratation und die Elektrolytsubstitution beschränken. Ein<br />
Nutzen von Antibiotika zur Verkürzung der Erkrankung ist nicht nachgewiesen. Da<br />
immer mehr resistente Stämme entstehen, sollte im Regelfall auf eine antibiotische<br />
Therapie verzichtet werden.<br />
Enteroinvasive E. coli (EIEC)<br />
Zwischen EIEC und Shigellen gibt es eine große Antigenverwandtschaft. Die Symptomatik<br />
und Therapie ist bei beiden Infektionen gleich und wird deshalb dort abgehandelt.<br />
Enterohämorrhagische E. coli (EHEC)<br />
EHEC produzieren ein Zellgift, das Verotoxin oder Shigella-like Toxin (SLT). Mehr als<br />
30 E. coli-Serotypen können SLT produzieren. In Europa und Nordamerika ist jedoch<br />
der Serotyp O157:H7 der häufigste. EHEC ist auch als Ursache des hämolytischurämischen<br />
Syndroms (HUS) erkannt worden. Die Frage, ob eine adäquate und rechtzeitige<br />
Antibiose die Entwicklung eines HUS beeinflussen kann, wird zurzeit kontrovers<br />
diskutiert. Einige Studien zeigten eine Verschlechterung der Erkrankung durch<br />
eine antibiotische Behandlung [24, 25]. Dies wurde auch durch eine neuere größere<br />
prospektive Studie bestätigt [26]. Die Zerstörung der Bakterien durch die Antibiose<br />
könnte hierbei zu einer vermehrten Toxinfreisetzung führen. Andere Studien deuten<br />
auf einen möglichen Vorteil einer antibiotischen Behandlung hin [27]. Auch die<br />
in-vitro-Daten sind widersprüchlich: Die einen berichten über eine vermehrte SLT-Produktion<br />
von E. coli O157:H7 unter Ciprofloxacin, die anderen über eine verminderte<br />
Toxinproduktion unter demselben Antibiotikum. Wichtig ist hervorzuheben, dass bei<br />
Patienten mit blutiger Diarrhö die Gabe von Motilitätshemmern kontraindiziert ist. In<br />
retrospektiven Untersuchungen konnte gezeigt werden, dass in Fällen mit Infektionen<br />
mit E. coli O157:H7, die länger als 24 Stunden mit Motilitätshemmern behandelt wurden,<br />
das Risiko, zentralnervöse Manifestationen im Rahmen eines HUS zu entwickeln,<br />
erhöht war.<br />
P Die E. coli-assoziierten Durchfallerkrankungen<br />
sollten nicht anti-<br />
biotisch behandelt werden. EHEC<br />
können Auslöser des hämolytischurämischen<br />
Syndroms sein.<br />
22
Aufgrund der unbefriedigenden zur Verfügung stehenden therapeutischen Möglichkeiten<br />
werden zurzeit Antiseren gegen das SLT auf ihre Wirksamkeit bei dieser Erkrankung<br />
geprüft. Zur Vermeidung von epidemischen Ausbrüchen ist eine strenge Kontrolle<br />
der Nahrungsmittel, insbesondere von Fleischprodukten notwendig.<br />
Virale <strong>Gastro</strong>enteritiden<br />
Enteropathogene Viren sind eine häufige Ursache von gastrointestinalen Infektionen<br />
bei Kindern (Rotaviren), aber auch bei Erwachsenen, besonders im höheren Lebensalter<br />
(Noroviren). Mittlerweile sind Noroviren die häufigste gemeldete Infektionserkrankung<br />
überhaupt und verursachen durch ihre hohe Kontagiosität erhebliche<br />
Probleme in Pflegeeinrichtungen und Krankenhäusern. Klinisch verlaufen die viralen<br />
Enteritiden in der Regel selbstlimitierend. Es gibt bisher keine spezifische Therapie.<br />
Die Behandlung beschränkt sich auf Flüssigkeits- und Elektrolytsubstitution. Je nach<br />
Schwere der Erkrankung muss diese oral und in einigen Fällen auch intravenös<br />
erfolgen.<br />
Rotaviren<br />
Die Infektion mit Rotaviren betrifft vorwiegend Kinder und erfolgt meist fäkal-oral. Die<br />
Rotaviren replizieren in den apikalen Enterozyten der Dünndarmzotten. Nach einer<br />
Inkubationszeit von 2–3 Tagen treten die klinischen Symptome auf. Meist tritt<br />
Erbrechen gefolgt von Fieber und Diarrhö auf. Die übliche Erkrankungsdauer kann<br />
6 bis 8 Tage betragen. Vermutlich wird durch das virale Protein (NSP4), welches Eigenschaften<br />
eines Enterotoxins aufweist, die Wirkung noch verstärkt. Eine spezielle Therapie<br />
existiert nicht. Es ist in jedem Fall auf eine ausreichende Flüssigkeits- und Elektrolytzufuhr<br />
zu achten. Von der Einnahme von Antidiarrhoika (Loperamid) ist abzuraten,<br />
da diese die Ausscheidung des Erregers erschweren und somit den Krankheitsverlauf<br />
verlängern.<br />
Infizierte Kinder dürfen keine öffentlichen Gemeinschaftseinrichtungen, wie z. B. Kindertagesstätten,<br />
besuchen. Eine Infektion ist der Kindertagesstätte zu melden.<br />
Aufgrund der hohen Morbidität und auch Mortalität der Erkrankung bei Kleinkindern<br />
weltweit wurde intensiv an der Entwicklung eines Impfstoffs gearbeitet. Ein in den<br />
USA lizensierter Impfstoff zeigte eine Effektivität von 49–68% gegen alle Rotavirusbedingten<br />
Durchfallerkrankungen und eine Effektivität von 69–91% gegen schwere<br />
Verlaufsformen [28]. In einer weiteren Studie mit einem abgeschwächten oralen<br />
Lebendimpfstoff konnte bei Kindern ebenfalls die Häufigkeit einer Rotavirus-bedingten<br />
Durchfallerkrankung signifikant gesenkt werden [29]. 1998 wurde eine<br />
Schluckimpfung gegen Rotaviren (RotaShield®) in den USA in den normalen Impfplan<br />
aufgenommen. Die Impfung wurde aber schon bald wieder zurückgezogen, nachdem<br />
76 Fälle einer Intussuszeption (Invagination, <strong>Darm</strong>einstülpung) aufgetreten waren,<br />
und ein Zusammenhang mit der Impfung nicht ausgeschlossen werden konnte.<br />
Mittlerweile gibt es 2 zugelassene Impfstoffe (Rotarix® und Rotateq®), die eine noch<br />
bessere Wirksamkeit und eine hervorragende Verträglichkeit zeigen [30, 31, 32]. Insbesondere<br />
der zwischenzeitlich aufgekommene Verdacht, dass der Rotavirusimpfstoff<br />
vermehrt Dünndarminvaginationen induzieren könnte, wurde komplett ausgeräumt<br />
[30, 31, 32]. Das Impfschema besteht aus 2 oder 3 Teilimpfungen. Es handelt sich um<br />
Schluckimpfungen. Die Immunisierung muss mit dem vollendeten 6. Lebensmonat<br />
abgeschlossen sein. Ohne Impfung erkrankt bis zum 5. Lebensjahr nahezu jedes Kind<br />
an Rotaviren.<br />
P Rotaviren sind die häufigste Ursache<br />
für Durchfallerkrankungen bei Kindern.<br />
Die Infektion kann durch eine Impfung<br />
effektiv verhindert werden.<br />
Noroviren<br />
Norovirusinfektionen sind die häufigste Ursache akuter <strong>Gastro</strong>enteritiden [33, 34]. Die<br />
epidemiologische Bedeutung dieser meldepflichtigen Infektionserkrankung wurde in<br />
den letzten Jahren durch mehrere Ausbrüche auf Kreuzfahrtschiffen, in Krankenhäusern<br />
und in Altersheimen deutlich. Die Erkrankung äußert sich typischerweise durch<br />
23
plötzlich auftretendes Erbrechen und akut einsetzende wässrige Diarrhö. Die Erkrankung<br />
dauert in der Regel nur 2–3 Tage. Die Infektion kann auch über Aerosole erfolgen,<br />
sodass insbesondere Erbrochenes als hochkontagiös gilt. Der Verdacht auf diese<br />
Erkrankung sollte klinisch gestellt werden, insbesondere, wenn mehrere Personen mit<br />
diesen Symptomen aus einer gemeinsamen Umgebung kommen. Genetische Veränderungen<br />
des Erregers haben wahrscheinlich zu der erhöhten Kontagiosität in den<br />
letzten Jahren beigetragen. Der Schutz einiger Personen vor der Erkrankung wird mit<br />
dem Fehlen des Rezeptors für Noroviren in Verbindung gebracht. Die letzten Epidemien<br />
haben gezeigt, dass nur strikte hygienische Maßnahmen die Ausbreitung des<br />
Erregers in Gemeinschaftseinrichtungen verhindern können.<br />
Der Verdacht auf die Noroviruserkrankung sollte schnell klinisch gestellt werden, dies<br />
gelingt meist durch die Anwendung der sogenannten Kaplan-Kriterien [4]:<br />
• Erbrechen (häufig explosiv) in > 50% der Fälle<br />
• wässrige akute Diarrhö (Dauer der Erkrankung 12–60 Stunden, Inkubationszeit<br />
6–48 Stunden, Personal und Betreute betroffen)<br />
Sollten diese Kriterien erfüllt sein, muss man zunächst von einer Norovirusinfektion<br />
ausgehen und die entsprechenden hygienischen Maßnahmen einleiten. Auf keinen<br />
Fall sollte hiermit bis zum Eintreffen der labortechnischen Bestätigung der klinischen<br />
Diagnose gewartet werden. Es ist noch anzumerken, dass die Kaplan-Kriterien bei<br />
Chemotherapiepatienten zur Differenzierung zwischen Noroviruserkrankung und<br />
Nebenwirkungen der Chemotherapie versagen können.<br />
Die Laborbestätigung erfolgt durch den Nachweis des Erregergenoms im Stuhl mittels<br />
Polymerasekettenreaktion (PCR) oder durch den Nachweis von Norovirusantigenen<br />
im Stuhl mittels eines Capture-ELISAs. Es reicht voll aus, wenn aus jedem Infektionsherd<br />
höchstens 2–3 Patienten getestet werden. Die Infektion ist meldepflichtig.<br />
Die Therapie ist in erster Linie symptomatisch und konzentriert sich, wie bei anderen<br />
Durchfallerkrankungen, auf die ausreichende Flüssigkeits- und Elektrolytsubstitution.<br />
Bei Immungeschwächten, die eine chronische Diarrhö durch die Norovirusinfektion<br />
entwickeln, muss überlegt werden, ob die immunsuppressive Therapie zurückgefahren<br />
werden kann. Eine spezifische virustatische Therapie gibt es zurzeit nicht.<br />
Noroviren zeichnen sich durch eine hohe Umweltresistenz (Tenazität) und eine eingeschränkte<br />
Empfindlichkeit gegenüber üblichen Desinfektions- und Reinigungsmitteln<br />
aus. Diese Charakteristika sind – zusammen mit der geringen infektiösen Dosis von<br />
weniger als 100 Viruspartikeln und der Möglichkeit einer aerogenen Übertragung des<br />
Virus – Ursache für die erschwerte Kontrolle von Krankheitshäufungen. Norovirusinfektionen<br />
in Gemeinschaftseinrichtungen können auch in Zukunft nicht sicher verhindert<br />
werden. Daher ist die rasche klinische Diagnosestellung von größter Bedeutung.<br />
Die Einleitung eines adaptierten Hygieneregimes sollte dann unmittelbar<br />
erfolgen, ohne die Bestätigung durch virologische Untersuchungen abzuwarten. Betroffenes<br />
Personal ist bis 72 Stunden nach Sistierung der Symptomatik vom Dienst<br />
freizustellen [34, 35]. Die Patienten sowie Kontaktpatienten sollten sofort mittels<br />
Einzel- oder Kohortenisolierung vom übrigen Publikums- und Patientenverkehr<br />
abgeschirmt werden. Dies kann am sichersten auf einer dafür ausgelegten Infektionsstation<br />
mit entsprechender Vorzone umgesetzt werden. Besucher, Personal und<br />
Ärzte müssen vor Betreten des Zimmers Kittel, Handschuhe und einen Mundschutz<br />
(am besten OP-Maske) anlegen. Beim Verlassen des Zimmers verbleiben Kittel,<br />
Handschuhe und Mundschutz innerhalb der Vorzone in dafür vorgesehenen Entsorgungsbeuteln.<br />
Vor Verlassen einer betroffenen Pflegeeinheit wird eine hygienische<br />
Händedesinfektion mit einem alkoholischen Desinfektionsmittel durchgeführt (Wirkstoffbereich<br />
B der RKI-Liste). Die Zimmer und alle Kontaktflächen einschließlich Türklinken,<br />
Lichtschalter etc. müssen einer konsequenten Desinfektion mit aldehydhaltigen<br />
Reinigungsmitteln unterzogen werden. Die durch zeitweilige Schließung von<br />
Stationen und Freistellung von Mitarbeitern verursachten ökonomischen Belastungen<br />
sind dabei in Relation zu den vielfach höheren Kosten eines unkontrollierten Ausbruchs<br />
zu sehen [36].<br />
P Noroviren sind hochkontagiös und<br />
können daher durch eine rasche<br />
Ausbreitung der Infektion auch auf das<br />
medizinische Personal für erhebliche<br />
ökonomische Belastungen führen.<br />
24
Zytomegalievirus (CMV)<br />
Das Zytomegalievirus (CMV) kann bei immunsupprimierten Patienten eine Kolitis<br />
verursachen. Diese kann bei diesen Patienten sehr schwerwiegend verlaufen. Endoskopisch<br />
sieht man meist scharf begrenzte, wie ausgestanzt wirkende Ulzerationen<br />
(Abb. 2). Die Diagnose wird in der Regel bioptisch durch den Nachweis von Eulenaugenzellen<br />
oder den immunhistologischen Nachweis von CMV-Proteinen gesichert.<br />
Die CMV-Kolitis war früher bei AIDS-Patienten mit sehr niedriger CD4-Lymphozytenzahl<br />
relativ häufig. Heute ist sie in den Industrieländern seit Einführung der hochwirksamen<br />
antiretroviralen Kombinationstherapie (HAART) in dieser Risikogruppe seltener<br />
geworden. Dafür findet man sie jetzt gelegentlich bei anderweitig immunsupprimierten<br />
Patienten, wie z. B. bei Patienten mit einer chronisch entzündlichen <strong>Darm</strong>erkrankung,<br />
Patienten nach Organtransplantation oder Patienten unter Chemotherapie.<br />
Abb. 2<br />
Typische ausgestanzte, scharf<br />
begrenzte Ulzerationen im Dickdarm<br />
bei CMV-Kolitis<br />
Die Behandlung der CMV-Infektion des Intestinaltrakts sollte mit Ganciclovir (5 mg/kg<br />
2 x täglich) oder Foscarnet (60 mg/kg 3 x täglich oder 90 mg/kg 2 x täglich) in schweren<br />
Fällen über mindestens 2–3 Wochen intravenös erfolgen [34]. Die Hauptnebenwirkung<br />
von Ganciclovir sind Thrombo- und Neutropenie; die von Foscarnet Nierenfunktionsstörungen.<br />
Die Frage nach einer Erhaltungstherapie bei immunrekonstituierten Patienten<br />
unter HAART ist nicht geklärt. Bei immunsupprimierten Patienten mit anderer<br />
Ursache als HIV ist eine Sekundärprophylaxe mit 3 x 1000 mg Ganciclovir 3 x täglich<br />
[37] oder mit Valganciclovir 1 x 900 mg pro Tag möglich und sollte solange fortgeführt<br />
werden, wie die Immunsuppression anhält. In Fällen, in denen eine dauerhafte<br />
Immunsuppression vorliegt oder durch eine Therapie eine anhaltende Immunsuppression<br />
aufrechterhalten werden muss, sollte über die Dauer der Sekundärprophylaxe<br />
individuell entschieden werden.<br />
P Die CMV-Kolitis ist eine Erkrankung<br />
bei immunsupprimierten Patienten, die<br />
schwerwiegende Verläufe verursachen<br />
kann und daher rasch diagnostiziert<br />
und behandelt werden sollte.<br />
25
Zu empfehlende Literatur<br />
Literatur<br />
1 Bassily S, Hyams KC, el-Masry NA, Farid Z, Cross E, Bourgeois AL, Ayad E, Hibbs RG.<br />
Short-course norfloxacin and trimethoprim-sulfamethoxazole treatment of<br />
shigellosis and salmonellosis in Egypt.<br />
Am J Trop Med Hyg 1994; 51: 219–223.<br />
2 Gotuzzo E, Guerra JG, Benavente L, Palomino JC, Carrillo C, Lopera J, Delgado F,<br />
Nalin DR, Sabbaj J.<br />
Use of norfloxacin to treat chronic typhoid carriers.<br />
J Infect Dis 1988; 157: 1221–1225.<br />
3 Tauxe RV, Puhr ND, Wells JG, Hargrett-Bean N, Blake PA.<br />
Antimicrobial resistance of Shigella isolates in the USA: the importance of<br />
international travelers.<br />
J Infect Dis 1990; 162: 1107–1111.<br />
4 Bennish ML, Salam MA, Haider R, Barza M.<br />
Therapy for shigellosis. II. Randomized, double-blind comparison of ciprofloxacin<br />
and ampicillin.<br />
J Infect Dis 1990; 162: 711–716.<br />
5 Smith KE, Besser JM, Hedberg CW, Leano FT, Bender JB, Wicklund JH, Johnson BP,<br />
Moore KA, Osterholm MT.<br />
Quinolone-resistant Campylobacter jejuni infections in Minnesota, 1992–1998.<br />
Investigation Team.<br />
N Engl J Med 1999; 340: 1525–1532.<br />
6 Kuschner RA, Trofa AF, Thomas RJ, Hoge CW, Pitarangsi C, Amato S, Olafson RP,<br />
Echeverria P, Sadoff JC, Taylor DN.<br />
Use of azithromycin for treatment of Campylobacter enteritis in travelers to<br />
Thailand, an area where ciprofloxacin resistance is prevalent.<br />
Clin Infect Dis 1995; 21: 536–541.<br />
7 Crowe M, Ashford K, Ispahani P.<br />
Clinical features and antibiotic teatment of septic arthritis and osteomyelitis due to<br />
Yersinia enterocolitica.<br />
J Med Microbiol 1996; 45: 302–309.<br />
8 Schneider T, Eckmanns T, Ignatius R, Weist K, Liesenfeld O.<br />
Clostridium-difficile-assoziierte Diarrhö: ein zunehmendes klinisches Problem<br />
durch neue hochvirulente Erreger. Clostridium difficile-associated diseases – an<br />
emerging problem.<br />
Dtsch Ärztebl 2007; 104: 22, A-1588/B-1403/C-1343.<br />
9 Kuijper EJ, van den Berg RJ, Debast S, Visser CE, Veenendaal D, Troelstra A,<br />
van der Kooi T, van den Hof S, Notermans DW.<br />
Clostridium difficile ribotype 027, toxinotype III, the Netherlands.<br />
Emerg Infect Dis 2006; 12: 827–830.<br />
10 Kyne L, Hamel MB, Polavaram R, Kelly CP.<br />
Health care costs and mortality associated with nosocomial diarrhea due to<br />
Clostridium difficile.<br />
Clin Infect Dis 2002; 34: 346–353.<br />
11 Bricker E, Garg R, Nelson R, Loza A, Novak T, Hansen J.<br />
Antibiotic treatment for Clostridium difficile-associated diarrhea in adults.<br />
Cochrane Database Syst Rev 2005; 1: CD004610.<br />
26
12 Bartlett JG.<br />
Narrative review: the new epidemic of Clostridium difficile-associated enteric<br />
disease.<br />
Ann Intern Med 2006; 145: 758–764.<br />
Literatur<br />
13 Fekety R.<br />
Guidelines for the diagnosis and management of Clostridium difficile-associated<br />
diarrhea and colitis. American College of <strong>Gastro</strong>enterology, Practice Parameters<br />
Committee.<br />
Am J <strong>Gastro</strong>enterol 1997; 92: 739–750.<br />
14 Fernandez A, Anand G, Friedenberg F.<br />
Factors associated with failure of metronidazole in Clostridium difficile-associated<br />
disease.<br />
J Clin <strong>Gastro</strong>enterol 2004; 38: 414–418.<br />
15 Pépin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, Pépin K,<br />
Chouinard D.<br />
Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003:<br />
a changing pattern of disease severity.<br />
CMAJ 2004; 171: 466–472.<br />
16 Surawicz, CM.<br />
Treatment of recurrent Clostridium difficile-associated disease.<br />
Nat Clin Pract <strong>Gastro</strong>enterol Hepatol 2004; 1: 32–38.<br />
17 McFarland LV, Surawicz CM, Greenberg RN, Fekety R, Elmer GW, Moyer KA,<br />
Melcher SA, Bowen KE, Cox JL, Noorani Z, et al.<br />
A randomized placebo-controlled trial of Saccharomyces boulardii in combination<br />
with standard antibiotics for Clostridium difficile disease.<br />
JAMA 1994; 271: 1913–1918.<br />
18 Babcock GJ, Broering TJ, Hernandez HJ, Mandell RB, Donahue K, Boatright N,<br />
Stack AM, Lowy I, Graziano R, Molrine D, Ambrosino DM, Thomas WD Jr.<br />
Human monoclonal antibodies directed against toxins A and B prevent<br />
Clostridium difficile-induced mortality in hamsters.<br />
Infect Immun 2006; 74: 6339–6347.<br />
19 Louie TJ, Peppe J, Watt CK, Johnson D, Mohammed R, Dow G, Weiss K, Simon S,<br />
John JF Jr, Garber G, Chasan-Taber S, Davidson DM; Tolevamer Study Investigator<br />
Group.<br />
Tolevamer, a novel nonantibiotic polymer, compared with vancomycin in the<br />
treatment of mild to moderately severe Clostridium difficile-associated diarrhea.<br />
Clin Infect Dis 2006; 43: 411–420.<br />
20 Koss K, Clark MA, Sanders DS, Morton D, Keighley MR, Goh J.<br />
The outcome of surgery in fulminant Clostridium difficile colitis.<br />
Colorectal Dis 2006; 8: 149–154.<br />
21 McFarland LV, Mulligan ME, Kwok RY, Stamm WE.<br />
Nosocomial acquisition of Clostridium difficile infection.<br />
N Engl J Med 1989; 320: 204–210.<br />
22 Gerding DN, Johnson S, Peterson LR, Mulligan ME, Silva J Jr.<br />
Clostridium difficile-associated diarrhea and colitis.<br />
Infect Control Hosp Epidemiol 1995; 16: 459–477.<br />
23 Thorén A, Wolde-Mariam T, Stintzing G, Wadström T, Habte D.<br />
Antibiotics in the treatment of gastroenterits caused by enteropathogenic<br />
Escherichia coli.<br />
J Infect Dis 1980; 141: 27–31.<br />
27
24 Carter AO, Borczyk AA, Carlson JA, Harvey B, Hockin JC, Karmali MA, Krishnan C,<br />
Korn DA, Lior H.<br />
A severe outbreak of Escherichia coli O157:H7-associated hemorrhagic colitis in a<br />
nursing home.<br />
N Engl J Med 1987; 317: 1496–1500.<br />
Literatur<br />
25 Pavia AT, Nichols CR, Green DP, Tauxe RV, Mottice S, Greene KD, Wells JG,<br />
Siegler RL, Brewer ED, Hannon D, Blake PA.<br />
Hemolytic-uremic syndrome during an outbreak of Escherichia coli O157:H7<br />
infections in institutions for mentally retarded persons: clinical and epidemiologic<br />
observations.<br />
J Pediatr 1990; 116: 544–551.<br />
26 Wong CS, Jelacic S, Habeeb RL, Watkins SL, Tarr PI.<br />
The risk of the hemolytic-uremic syndrome after antibiotic treatment of<br />
Escherichia coli O157:H7 infections.<br />
N Engl J Med 2000; 342: 1930–1936.<br />
27 Ostroff SM, Kobayashi JM, Lewis JH.<br />
Infections with Escherichia coli O157:H7 in Washington State. The first year of<br />
statewide disease surveillance.<br />
JAMA 1989; 262: 355–359.<br />
28 Joensuu J, Koskenniemi E, Pang XL, Vesikari T.<br />
Randomised placebo-controlled trial of rhesus-human reassortant rotavirus<br />
vaccine for prevention of severe rotavirus gastroenterits.<br />
Lancet 1997; 350: 1205–1209.<br />
29 Bernstein DI, Sack DA, Rothstein E, Reisinger K, Smith VE, O’Sullivan D,<br />
Spriggs DR, Ward RL.<br />
Efficacy of live, attenuated, human rotavirus vaccine 89-12 in infants: a randomised<br />
placebo-controlled trial.<br />
Lancet 1999; 354: 287–290.<br />
30 Ruiz-Palacios GM, Pérez-Schael I, Velázquez FR, Abate H, Breuer T, Clemens SC,<br />
Cheuvart B, Espinoza F, Gillard P, Innis BL, Cervantes Y, Linhares AC, López P,<br />
Macías-Parra M, Ortega-Barría E, Richardson V, Rivera-Medina DM, Rivera L, Salinas B,<br />
Pavía-Ruz N, Salmerón J, Rüttimann R, Tinoco JC, Rubio P, Nuñez E, Guerrero ML,<br />
Yarzábal JP, Damaso S, Tornieporth N, Sáez-Llorens X, Vergara RF, Vesikari T,<br />
Bouckenooghe A, Clemens R, De Vos B, O’Ryan M; Human Rotavirus Vaccine<br />
Study Group.<br />
Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis.<br />
N Engl J Med 2006; 354: 11–22.<br />
31 Vesikari T, Matson DO, Dennehy P, Van Damme P, Santosham M, Rodriguez Z,<br />
Dallas MJ, Heyse JF, Goveia MG, Black SB, Shinefield HR, Christie CD, Ylitalo S,<br />
Itzler RF, Coia ML, Onorato MT, Adeyi BA, Marshall GS, Gothefors L, Campens D,<br />
Karvonen A, Watt JP, O’Brien KL, DiNubile MJ, Clark HF, Boslego JW, Offit PA,<br />
Heaton PM; Rotavirus Efficacy and Safety Trial (REST) Study Team.<br />
Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus<br />
vaccine.<br />
N Engl J Med 2006; 354: 23–33.<br />
32 Murphy TV, Gargiullo PM, Massoudi MS, Nelson DB, Jumaan AO, Okoro CA,<br />
Zanardi LR, Setia S, Fair E, LeBaron CW, Wharton M, Livengood JR; Rotavirus<br />
Intussusception Investigation Team.<br />
Intussusception among infants given an oral rotavirus vaccine.<br />
N Engl J Med 2001; 344: 564–572.<br />
28
33 Schneider T, Mankertz J, Jansen A, Schreier E, Zeitz M.<br />
Norovirusinfektion – häufigste Ursache akuter <strong>Gastro</strong>enteritiden in den Wintermonaten.<br />
Norovirus infection – the commonest cause of winter gastroenteritis.<br />
Dtsch Ärztebl 2005; 102; 38, A-2551/B-2153/C-2032<br />
Literatur<br />
34 Schneider T, Zeitz M.<br />
Behandlung gastrointestinaler Infektionen.<br />
Internist (Berl) 2000; 41: 1302–1317.<br />
35 Jansen A, Beyer A, Brandt C, Höhne M, Schreier E, Schulzke J, Zeitz M, Schneider T.<br />
The norovirus-epidemic in Berlin – clinic, epidemiology and prevention.<br />
Z <strong>Gastro</strong>enterol 2004; 42: 311–316.<br />
36 Johnston CP, Qiu H, Ticehurst JR, Dickson C, Rosenbaum P, Lawson P, Stokes AB,<br />
Lowenstein CJ, Kaminsky M, Cosgrove SE, Green KY, Perl TM.<br />
Outbreak management and implications of a nosocomial norovirus outbreak.<br />
Clin Infect Dis 2007; 45: 534–540.<br />
37 Whitley RJ, Jacobson MA, Friedberg DN, Holland GN, Jabs DA, Dieterich DT,<br />
Hardy WD, Polis MA, Deutsch TA, Feinberg J, Spector SA, Walmsley S, <strong>Dr</strong>ew WL,<br />
Powderly WG, Griffiths PD, Benson CA, Kessler HA.<br />
Guidelines for the treatment of cytomegalovirus disease in patients with AIDS in<br />
the era of potent antiretroviral therapy: recommendations of an international<br />
panel. International AIDS Society-USA.<br />
Arch Intern Med 1998; 158: 957–969.<br />
29
Fragen zur Therapie und Prophylaxe<br />
der akuten infektiösen Enteritis<br />
Frage 1:<br />
Welche Aussage ist richtig? Die Norovirusinfektion<br />
w ist eine seltene Infektionskrankheit<br />
w ist gut mit Antibiotika zu behandeln<br />
w kommt häufiger in den Wintermonaten vor<br />
w hinterlässt eine lebenslange Immunität<br />
w ist nur bedingt ansteckend<br />
Frage 2:<br />
Welche Aussage trifft für die Salmonellenenteritis zu?<br />
w In der Regel ist eine antibiotische Therapie notwendig<br />
w Die Diagnose wird durch die PCR bestätigt<br />
w Eine Salmonelleninfektion kann lebensbedrohlich verlaufen<br />
w Die Entwicklung einer Dauerausscheidung von Salmonellen kann<br />
durch eine frühe antibiotische Therapie verhindert werden<br />
w Nach einer Salmonelleninfektion tritt niemals ein Reizdarmsyndrom<br />
auf<br />
Frage 3:<br />
Welche Aussage trifft für die Campylobacterenteritis zu?<br />
w Die Campylobacterenteritis ist eine seltene bakterielle Ursache einer<br />
akuten Diarrhö<br />
w Im Gefolge einer Campylobacterinfektion können sich eine reaktive<br />
Arthritis und/oder ein Erythema nodosum entwickeln<br />
w Ciprofloxacin ist das Antibiotikum der Wahl zur Behandlung der<br />
Campylobacterenteritis<br />
w Bei Fieber gelingt der Nachweis von Campylobacterspezies meist im<br />
Blut<br />
w Eine Diarrhö verursacht durch Campylobacterspezies dauert in der<br />
Regel länger als 14 Tage<br />
Frage 4:<br />
Welche Aussage zur Yersinieninfektion ist richtig?<br />
w Yersinien werden als Ursache einer Diarrhö in Deutschland häufig<br />
gefunden<br />
w Yersinien können besonders bei Patienten mit einer Eisenüberladung<br />
einen schweren Verlauf nehmen<br />
w Yersinien sind bei AIDS-Patienten ein wichtiger Erreger von Durchfallerkrankungen<br />
w Eine Durchfallerkrankung, die durch Yersinien hervorgerufen wird,<br />
sollte in der Regel antibiotisch behandelt werden<br />
w Durchfälle, bedingt durch Yersinien, werden besonders häufig bei<br />
Reiserückkehrern gefunden<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Bitte beachten Sie:<br />
Bei der Beantwortung der Fragen<br />
ist immer nur 1 Antwort möglich.<br />
Die Beantwortung der Fragen und<br />
Erlangung des Fortbildungszertifikats<br />
ist nur online möglich.<br />
Bitte gehen Sie dazu auf unsere Homepage<br />
www.falkfoundation.de.<br />
Unter dem Menüpunkt <strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
können Sie sich anmelden und die Fragen<br />
beantworten.<br />
Bitte diesen Fragebogen nicht<br />
per Post oder Fax schicken!<br />
Wichtig:<br />
Fragebeantwortung unter<br />
www.falkfoundation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
30
Frage 5:<br />
Welche Aussage trifft zur CDAD zu?<br />
w Clostridien spielen bei der Diarrhö im Krankenhaus selten einer Rolle<br />
w Wird Clostridium difficile im Stuhl eines Patienten mit Diarrhö<br />
gefunden, sollte er mit Clont oder Vancomycin behandelt werden<br />
w CDAD ist ein zunehmendes Problem in Industrieländern<br />
w Wenn endoskopisch keine Pseudomembranen gesehen werden,<br />
ist eine CDAD ausgeschlossen<br />
w Der Verlauf der Erkrankung, besonders bei sehr alten Patienten,<br />
ist manchmal lebensbedrohlich<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Frage 6:<br />
Welche Aussage zur CDAD trifft nicht zu?<br />
w Zur Therapiekontrolle sollte der Toxinnachweis im Stuhl herangezogen<br />
werden<br />
w Metronidazol (Clont) ist Mittel der ersten Wahl bei der Behandlung<br />
der CDAD<br />
w Eines der wichtigsten Prinzipien der CDAD-Behandlung ist das<br />
Absetzen des auslösenden Antibiotikums<br />
w Rezidive treten relativ häufig auf<br />
w In der Regel wird bei einem Rezidiv wieder dasselbe Antibiotikum<br />
eingesetzt wie bei der ersten Therapie<br />
Frage 7:<br />
Welche Aussage zur CMV-Kolitis trifft zu?<br />
w Die CMV-Kolitis ist eine häufige Ursache einer Diarrhö bei Kindern<br />
w Eine CMV-Kolitis muss in der Regel nicht spezifisch behandelt werden<br />
w Die CMV-Kolitis kann häufig erst durch Koloskopie mit der Abnahme<br />
von Biopsien gesichert werden<br />
w Die CMV-Kolitis kommt bei Patienten mit Colitis ulcerosa nicht vor<br />
w Bei HIV-Patienten nimmt die Inzidenz der CMV-Kolitis in den letzten<br />
Jahren deutlich zu<br />
Frage 8:<br />
Welche Aussage zu Rotaviren trifft nicht zu?<br />
w Rotaviren verursachen vor allem bei Kindern eine akute Diarrhö<br />
w Rotaviren infizieren reife Enterozyten des Dünndarms<br />
w Ein Peptid des Rotavirus wirkt wie ein Enterotoxin<br />
w Ein Impfstoff gegen Rotaviren sollte erst nach dem ersten Lebensjahr<br />
eingesetzt werden, weil es sonst gehäuft zu Invaginationen des<br />
Dünndarms kommen kann<br />
w Die Flüssigkeitssubstitution ist bei der Behandlung einer Rotavirusinfektion<br />
das Wichtigste<br />
31
Frage 9:<br />
Welche klinischen Symptome sind nicht typisch für eine<br />
Norovirusinfektion?<br />
w Muskelschmerzen<br />
w Abdominelle Krämpfe<br />
w Durchfall<br />
w Sehstörungen<br />
w Erbrechen<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Frage 10:<br />
Welche Maßnahme ist bei dem Verdacht auf einen Norovirusausbruch<br />
im Krankenhaus nicht angezeigt?<br />
w Information des Personals in der betroffenen Einrichtung einschließlich<br />
der Reinigungskräfte und der Krankentransporter<br />
w Bei jedem Patienten ist eine Diagnosesicherung durch eine PCR<br />
notwendig<br />
w Patienten und Besucher sollten informiert werden, ggf. erfolgt eine<br />
zeitweilige Einschränkung des Besucherverkehrs<br />
w Meldung an das zuständige Gesundheitsamt<br />
w Freistellung von erkranktem Personal, ggf. Schließung von stark<br />
betroffenen Einheiten<br />
32