Alkane, Alkene, Alkine, Alkanole, Alkansäuren, Ester - guennet.de
Alkane, Alkene, Alkine, Alkanole, Alkansäuren, Ester - guennet.de Alkane, Alkene, Alkine, Alkanole, Alkansäuren, Ester - guennet.de
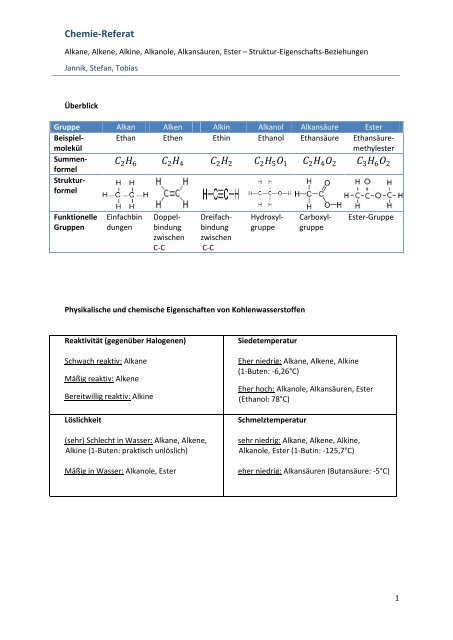
Chemie-Referat Alkane, Alkene, Alkine, Alkanole, Alkansäuren, Ester – Struktur-Eigenschafts-Beziehungen Jannik, Stefan, Tobias Überblick Gruppe Alkan Alken Alkin Alkanol Alkansäure Ester Beispielmolekül Ethan Ethen Ethin Ethanol Ethansäure Ethansäuremethylester Summenformel C 2 H 6 C 2 H 4 C 2 H 2 C 2 H 5 O 1 C 2 H 4 O 2 C 3 H 6 O 2 Strukturformel Funktionelle Gruppen Einfachbin dungen Doppelbindung zwischen C-C Dreifachbindung zwischen C-C Hydroxylgruppe Carboxylgruppe Ester-Gruppe Physikalische und chemische Eigenschaften von Kohlenwasserstoffen Reaktivität (gegenüber Halogenen) Schwach reaktiv: Alkane Mäßig reaktiv: Alkene Bereitwillig reaktiv: Alkine Löslichkeit (sehr) Schlecht in Wasser: Alkane, Alkene, Alkine (1-Buten: praktisch unlöslich) Mäßig in Wasser: Alkanole, Ester Siedetemperatur Eher niedrig: Alkane, Alkene, Alkine (1-Buten: -6,26°C) Eher hoch: Alkanole, Alkansäuren, Ester (Ethanol: 78°C) Schmelztemperatur sehr niedrig: Alkane, Alkene, Alkine, Alkanole, Ester (1-Butin: -125,7°C) eher niedrig: Alkansäuren (Butansäure: -5°C) 1
- Seite 2: Chemie-Referat Alkane, Alkene, Alki
Chemie-Referat<br />
<strong>Alkane</strong>, <strong>Alkene</strong>, <strong>Alkine</strong>, <strong>Alkanole</strong>, <strong>Alkansäuren</strong>, <strong>Ester</strong> – Struktur-Eigenschafts-Beziehungen<br />
Jannik, Stefan, Tobias<br />
Überblick<br />
Gruppe Alkan Alken Alkin Alkanol Alkansäure <strong>Ester</strong><br />
Beispielmolekül<br />
Ethan Ethen Ethin Ethanol Ethansäure Ethansäuremethylester<br />
Summenformel<br />
C 2 H 6 C 2 H 4 C 2 H 2 C 2 H 5 O 1 C 2 H 4 O 2 C 3 H 6 O 2<br />
Strukturformel<br />
Funktionelle<br />
Gruppen<br />
Einfachbin<br />
dungen<br />
Doppelbindung<br />
zwischen<br />
C-C<br />
Dreifachbindung<br />
zwischen<br />
C-C<br />
Hydroxylgruppe<br />
Carboxylgruppe<br />
<strong>Ester</strong>-Gruppe<br />
Physikalische und chemische Eigenschaften von Kohlenwasserstoffen<br />
Reaktivität (gegenüber Halogenen)<br />
Schwach reaktiv: <strong>Alkane</strong><br />
Mäßig reaktiv: <strong>Alkene</strong><br />
Bereitwillig reaktiv: <strong>Alkine</strong><br />
Löslichkeit<br />
(sehr) Schlecht in Wasser: <strong>Alkane</strong>, <strong>Alkene</strong>,<br />
<strong>Alkine</strong> (1-Buten: praktisch unlöslich)<br />
Mäßig in Wasser: <strong>Alkanole</strong>, <strong>Ester</strong><br />
Sie<strong>de</strong>temperatur<br />
Eher niedrig: <strong>Alkane</strong>, <strong>Alkene</strong>, <strong>Alkine</strong><br />
(1-Buten: -6,26°C)<br />
Eher hoch: <strong>Alkanole</strong>, <strong>Alkansäuren</strong>, <strong>Ester</strong><br />
(Ethanol: 78°C)<br />
Schmelztemperatur<br />
sehr niedrig: <strong>Alkane</strong>, <strong>Alkene</strong>, <strong>Alkine</strong>,<br />
<strong>Alkanole</strong>, <strong>Ester</strong> (1-Butin: -125,7°C)<br />
eher niedrig: <strong>Alkansäuren</strong> (Butansäure: -5°C)<br />
1
Chemie-Referat<br />
<strong>Alkane</strong>, <strong>Alkene</strong>, <strong>Alkine</strong>, <strong>Alkanole</strong>, <strong>Alkansäuren</strong>, <strong>Ester</strong> – Struktur-Eigenschafts-Beziehungen<br />
Jannik, Stefan, Tobias<br />
Struktur-Eigenschafts-Beziehungen<br />
- Länge <strong>de</strong>r Ketten<br />
o Je länger die Kette <strong>de</strong>r C-Atome, <strong>de</strong>sto höher <strong>de</strong>r Sie<strong>de</strong>punkt<br />
=> stärkere Van-<strong>de</strong>r-Waals-Kräfte<br />
- Bindungskräfte<br />
o Je höher die zwischenmolekularen Kräfte, <strong>de</strong>sto höher <strong>de</strong>r Sie<strong>de</strong>punkt.<br />
o Allgemein gilt:<br />
Van-<strong>de</strong>r-Waals-Kräfte < Dipol-Dipol-Kräfte < Wasserstoffbrücken-Bindungen<br />
- Einfach- /Doppel- /Dreifachbindung<br />
o Zunehmen<strong>de</strong> Elektronendichte<br />
o Steigen<strong>de</strong> Reaktionsbereitschaft (z.B. elektrophile Addition)<br />
- Löslichkeit<br />
o Wasser ist ein polares Lösungsmittel<br />
o Unpolare Stoffe sind schlecht löslich, polare hingegen gut<br />
- Räumliche Struktur<br />
o Moleküle mit größerer Oberfläche haben höheren Sie<strong>de</strong>punkt<br />
=> stärkere Van-<strong>de</strong>r-Waals-Kräfte<br />
- Funktionelle Gruppen<br />
o Einfluss <strong>de</strong>r funktionellen Gruppen nimmt mit steigen<strong>de</strong>r Kettenlänge ab<br />
2