Löslichkeit, Osmose, Diffusion
Löslichkeit, Osmose, Diffusion
Löslichkeit, Osmose, Diffusion
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
22.Partialdruck,<strong>Löslichkeit</strong>,Os<br />
mose,<strong>Diffusion</strong><br />
18. Lektion:<br />
<strong>Löslichkeit</strong>, <strong>Osmose</strong> und <strong>Diffusion</strong><br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 1
Lernziel<br />
Der osmotische Druck von gelösten Stoffen folgt aus<br />
der Zustandsgleichung für ideale Gase.<br />
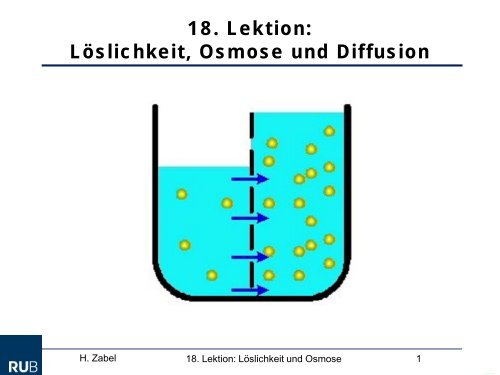
<strong>Diffusion</strong> ist ein Teilchenstrom, der einen<br />
Konzentrationsgradienten ausgleicht.<br />
Moleküle diffundieren immer von der höheren<br />
Konzentration zur niedrigeren.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 2
Begriffe:<br />
• <strong>Löslichkeit</strong><br />
• Henry’sches Gesetz<br />
• <strong>Osmose</strong><br />
• Wasserverschiebung<br />
• Physiologische Kochsalzlösung<br />
• Teilchenstromdichte<br />
• Fick‘sches Gesetz<br />
• <strong>Diffusion</strong>skonstante<br />
• Permeabilität<br />
• Aktivierte <strong>Diffusion</strong><br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 3<br />
Begriffe
<strong>Löslichkeit</strong> von Stoffen in Flüssigkeiten<br />
<strong>Löslichkeit</strong> S = Zahl der gelösten Mole n eines Stoffes pro Volumen in<br />
einer Flüssigkeit (Lösungsmittel):<br />
P i,außen<br />
Gelöster Stoff<br />
Lösungsmittel<br />
S<br />
=<br />
n<br />
V<br />
n = Molzahl, V = Volumen<br />
<strong>Löslichkeit</strong> S ist eine Anzahldichte<br />
bezogen auf das Volumen des<br />
Lösungsmittels, auch Molarität<br />
genannt.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 4<br />
<strong>Löslichkeit</strong> Konzentration in<br />
Flüssigkeiten
Zusammenhang zwischen<br />
<strong>Löslichkeit</strong> und Partialdruck<br />
(Henry-Gesetz)<br />
p Luft<br />
H 2 O<br />
Gelöste<br />
Luft in<br />
Wasser<br />
• Dynamisches Gleichgewicht zwischen<br />
äußerem Partialdruck p i eines Gases und<br />
<strong>Löslichkeit</strong> S von Gasmolekülen in der<br />
Flüssigkeit<br />
• Linearer Zusammenhang zwischen Druck und<br />
<strong>Löslichkeit</strong>.<br />
• Die Proportionalitätskonstante ist die Henry-<br />
Konstante K H :<br />
ni<br />
Si<br />
= = KH<br />
⋅pi<br />
, [ S]<br />
=<br />
V<br />
Henry −Konstante :<br />
mol<br />
[ KH]<br />
=<br />
Liter × bar<br />
mol<br />
Liter<br />
,<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 5<br />
Henry-Gesetz Zusammenhang<br />
<strong>Löslichkeit</strong>-Partialdruck
<strong>Löslichkeit</strong> von Gasen in Wasser<br />
(20°C und 1bar Gesamtluftdruck)<br />
K H<br />
[10 -3 mol/l⋅bar]<br />
S<br />
[10 -4 mol/l]<br />
Ar 1.5 0.14<br />
CO 2<br />
23 0.07<br />
N 2<br />
0.7 5.4<br />
O 2<br />
1.3 2.7<br />
Bitte beachten, dass die Partialdrücke in die <strong>Löslichkeit</strong> eingehen.<br />
Henry-Gesetz gilt nur bei idealer physikalischer <strong>Löslichkeit</strong> ohne<br />
chemische Bindung.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 6<br />
<strong>Löslichkeit</strong> von Gasen in Wasser
Gelöster Sauerstoff in Wasser bei<br />
Normaldruck<br />
p 02<br />
H 2 O<br />
Gelöster<br />
Sauerstoff in<br />
Wasser<br />
Partialdruck von Sauerstoff P 02 = 0.21 bar<br />
Henry-Konstante für Sauerstoff in Wasser:<br />
1.3 x 10 -3 mol/l⋅bar<br />
Zu erwartende <strong>Löslichkeit</strong> von Sauerstoff in Wasser:<br />
S O2 = 1.3 x 10 -3 x 0.21 mol/l<br />
= 0.27 x 10 -3 mol/l = 2.7 x 10 -4 mol/l<br />
Minimale O 2 – <strong>Löslichkeit</strong> für Leben in Wasser:<br />
1.3 x 10 -4 mol/l.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 7
<strong>Löslichkeit</strong> von Stickstoff in Blut bei<br />
Tauchern<br />
In 30 m Tiefe muss Atemluft mit<br />
4 bar angeboten werden. Bei 4 bar<br />
steigt die <strong>Löslichkeit</strong> von N 2 im Blut<br />
um einen Faktor 4 an. Beim<br />
Auftauchen entstehen N 2 -<br />
Bläschen, die platzen und die<br />
Gefäße zerstören.<br />
Zugabe von He zu Luft mit<br />
geringerer <strong>Löslichkeit</strong> im Blut<br />
reduziert die Gefahr der<br />
Bläschenbildung.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 8<br />
2. <strong>Löslichkeit</strong> von Gasen-Taucher
Sauerstofflöslichkeit im Blut<br />
S<br />
Chemische<br />
Bindung<br />
Bei 13.3 kPa, 98% der<br />
Sauerstoffbindung<br />
erreicht<br />
P [kPa]<br />
10 20 30<br />
Physikalische <strong>Löslichkeit</strong> Sauerstoffpartialdruck in Luft<br />
O 2 gelangt ins Blut durch <strong>Löslichkeit</strong> und durch chemische<br />
Bindung: Hb + O 2 = HbO 2 . Die physikalische <strong>Löslichkeit</strong> wäre zu<br />
gering, um den Sauerstoffbedarf des Körpers zu decken.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 9<br />
3. Sauerstoffkonzentration im Blut
Partialdruck von gelösten Stoffen<br />
in Flüssigkeiten<br />
P i,außen<br />
Gelöster Stoff<br />
Gelöster Stoff in Flüssigkeit<br />
erzeugt einen Partialdruck Π in<br />
der Flüssigkeit = osmotischer<br />
Druck,<br />
Analog zu der Zustandsgleichung<br />
für ideale Gase folgt der<br />
osmotische Druck aus:<br />
Lösungsmittel<br />
Π V =<br />
Flüssigkeit<br />
nRT<br />
Π = Partialdruck<br />
R = allgemeine Gaskonstante<br />
T = absolute Temperatur<br />
n = Molzahl<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 10<br />
<strong>Osmose</strong>: Partialdruck-Flüssigkeit
Osmotischer Druck<br />
Im Gleichgewicht mit äußerem Gasdruck p folgt aus der Henry-<br />
Gleichung:<br />
S<br />
i<br />
i<br />
= n<br />
V<br />
K<br />
H<br />
⋅p<br />
i,außen<br />
der osmotischen Druck in der Flüssigkeit:<br />
=<br />
Π<br />
=<br />
V<br />
n<br />
Flüssigkeit<br />
<br />
i<br />
RT<br />
=<br />
SRT<br />
i<br />
= K<br />
H<br />
RT<br />
p<br />
i,außen<br />
S i<br />
Der äußere Gasdruck bestimmt den inneren osmotischen<br />
Druck<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 11
<strong>Löslichkeit</strong> und Konzentration<br />
<strong>Löslichkeit</strong>:<br />
ni<br />
S i<br />
=<br />
V<br />
Konzentration:<br />
ni<br />
ci<br />
=<br />
n + n<br />
i<br />
Wasser<br />
n = Molzahl, V = Volumen<br />
<strong>Löslichkeit</strong> S ist eine Anzahldichte bezogen auf<br />
das Volumen des Lösungsmittels.<br />
Beispiel: 0.3 Mol Salz auf 1 Liter Wasser ergibt<br />
eine <strong>Löslichkeit</strong> von 0.3 Mol/l oder 0.3 Mol/10 -3<br />
m 3<br />
Konzentration ist die Anzahl von Teilchen einer<br />
Komponente bezogen auf die Gesamtzahl<br />
Beispiel: 0.3 Mol auf 1 Liter Wasser. 1 Liter Wasser<br />
enthält 1000g/18g=55,5 Mole. Die Konzentration ist<br />
damit:<br />
c i = 0.3/(55,5 + 0,3) = 0,3/55,8 = 0.0053 oder 0,53%<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und<br />
<strong>Osmose</strong><br />
12
Osmotischer Druck<br />
Unterschiedliche Mengen von NaCl gelöst in Wasser ergeben einen<br />
unterschiedlichen osmotischen Partialdruck:<br />
Π<br />
i<br />
=<br />
ni<br />
V<br />
RT;<br />
Konzentration :<br />
c<br />
i<br />
=<br />
n<br />
i<br />
n<br />
+ n<br />
i<br />
Wasser<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 13<br />
Osmotischer Druck
Osmotischer Druck und<br />
Wasserverschiebung<br />
Falls Wand zwischen Flüssigkeit 1 und 2 für Wasser permeabel ist,<br />
dann fließt Wasser von 1 nach 2 bis der osmotische Druckunterschied<br />
ausgeglichen ⇒ Wasserverschiebung<br />
Höhendifferenz der Wassersäule entspricht dem ursprünglichen<br />
Druckunterschied:<br />
Semipermeable Wand<br />
Der ursprüngliche osmotische<br />
h Druckunterschied folgt aus der<br />
Wasserhöhe h nach Wasserverschiebung:<br />
n 1 n 2<br />
∆Π = ρgh<br />
Osmotischer Druckausgleich durch Wasserverscihiebung führt gleichzeitig<br />
zum Konzentrationsausgleich. Lösungsmittel fließt von niedrigem Druck zu<br />
hohem Druck um den osmotischen Druck zu reduzieren.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 14<br />
Osmotischer Druck u. Wasserverschiebung
Wasserverschiebung<br />
+<br />
+<br />
+<br />
+<br />
+<br />
+<br />
+<br />
+<br />
<strong>Osmose</strong> hat die Tendenz der Verdünnung:<br />
Lösungsmittel (Wasser) fließt in die Richtung, in der die Konzentration<br />
(osmotische Druck) größer ist. Wasserverschiebung führt daher zum<br />
Konzentrationsausgleich. Der Konzentrationsausgleich erfolgt nicht<br />
durch <strong>Diffusion</strong> der Ionen, sondern durch <strong>Diffusion</strong> des<br />
Lösungsmittels durch die Membrane.<br />
+<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 15<br />
Wasserverschiebung Konzentrationsausgleich
<strong>Osmose</strong> bei einer Blase<br />
mit semi-permeabler Wand für Wasser<br />
Modell einer Zelle<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 16
Biologische Zelle<br />
Wasser und<br />
Mineralien, Π a<br />
+<br />
+<br />
+<br />
+<br />
+<br />
—<br />
—<br />
—<br />
K +<br />
—<br />
—<br />
—<br />
+ +<br />
+<br />
+<br />
+<br />
+<br />
Na +<br />
Wasser, Enzyme,<br />
Proteine, Π i<br />
Zellmembrane ist eine semipermeable Wand für H 2 O. Wasser und<br />
Mineralien fliessen durch die Membrane, um den osmotischen Druck<br />
auszugleichen<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 17<br />
Beispiel: Biologische Zelle
Rote Blutzellen<br />
Rote Blutzellen<br />
K + Na +<br />
Blutplasma:<br />
H 2 O + Na + +<br />
Proteine<br />
Membrane lässt kein Na + durch, dadurch herrscht im Plasma ein<br />
osmotischer Druck von ca. 7.5 bar! Umgekehrt kann auch kein K + nach<br />
außen dringen, und der osmotische Druck in der Blutzelle ist in etwa<br />
gleich groß. Wenn die Drücke innen und außen ausgeglichen sind,<br />
spricht man von isotonen Druckverhältnissen. Osmotischer Druck im<br />
Plasma muss reguliert werden. Jede Abweichung vom Normaldruck<br />
führt zur Wasserverschiebung zwischen Zelle und Plasma.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 18
Physiologische Kochsalzlösung<br />
0.9% Lösung bzw. 9 g NaCl auf 1000 ml H 2 O.<br />
Wieviel Mole sind 9 g? Molare Masse von NaCl ist:<br />
m Mol = 23 Na + 35.5 Cl = 58.5 g; Molzahl: n = 9g/58.5 g = 0.15<br />
Durch Dissoziation von NaCl in Wasser zu Na + und Cl - , sind pro<br />
Molekül zwei Teilchen in Lösung, d.h. die Molzahl ist doppelt so<br />
groß = 0.3<br />
Osmotischer Druck bei Körpertemperatur T = 272K + 36°C =308 K<br />
ergibt einen Druck:<br />
nRT 0.3×<br />
8.31×<br />
308<br />
Π = =<br />
kPa<br />
V 1<br />
= 773kPa = 7.7bar<br />
PKL hat den gleichen osmotischen Druck wie Blutplasma.<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 19<br />
Physiologische NaCl-Lösung
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 20
<strong>Diffusion</strong>sprozesse im Alltag<br />
Bratenluft dringt nach außen,<br />
frische Luft kommt rein.<br />
Kondensstreifen am<br />
Himmel löst sich durch<br />
<strong>Diffusion</strong> auf.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 21
<strong>Diffusion</strong>srichtung folgt<br />
Konzentrationsgradient<br />
C<br />
Permeable Wand<br />
Zeit = t 1<br />
x<br />
C Zeit = t 2 > t 1<br />
Permeable Wand<br />
x<br />
C Zeit = t 3 >> t 1<br />
Permeable Wand<br />
∆x<br />
Wenn zwei verschiedene Konzentrationen durch eine permeable<br />
Wand räumlich getrennt sind, dann erfolgt notwendigerweise ein<br />
Konzentrationsausgleich mit zunehmender Zeit.<br />
x<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 22
<strong>Diffusion</strong> bedeutet Massetransport<br />
Teilchenstrom ist transportierte Teilchen pro Zeiteinheit:<br />
I N<br />
=<br />
ΔN<br />
Δt<br />
Teilchenstrom folgt dem Konzentrationsgradienten von hoher zu<br />
niedriger Konzentation um Konzentrationsunterschied auszugleichen.<br />
IN ~ (cA-cB)<br />
=<br />
Δc<br />
Der Ausgleich wird umso schneller erfolgen, je kleiner der<br />
Teilchenstromwiderstand R m ist:<br />
I =<br />
N<br />
Δc<br />
R<br />
N<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 23
Ohmsches Gesetz der <strong>Diffusion</strong><br />
Zusammengefasst folgt das Ohm’sche Gesetz für die Teilchendiffusion:<br />
Teilchenstromwiderstand R N :<br />
D = <strong>Diffusion</strong>skonstante,<br />
∆x = permeable Wanddicke,<br />
A = Querschnittsfläche.<br />
I<br />
N<br />
=<br />
∆ N =<br />
∆t<br />
R N<br />
=<br />
1<br />
D<br />
∆c<br />
R<br />
N<br />
Δx<br />
A<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 24
Teilchenstromwiderstand<br />
Teilchen kommen durch eine permeable Wand üblicherweise<br />
nicht geradlinig durch, sondern erleiden auf ihrem Weg viele<br />
Stöße, ähnlich wie ein betrunkener Matrose, der versucht, sein<br />
Schiff wieder zu finden. Teilchenstromwiderstand hängt daher<br />
von Wanddicke und Querschnittsfläche ab, während die<br />
<strong>Diffusion</strong>skonstante die Beweglichkeit der Atome oder<br />
Moleküle in der Wand ausdrückt.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 25
Vergleich:<br />
Wärmestrom und <strong>Diffusion</strong>sstrom<br />
Wärmestrom =<br />
Energietransport durch<br />
Temperaturgradient, der<br />
Temperatur-unterschiede<br />
ausgleicht<br />
<strong>Diffusion</strong>sstrom =<br />
Teilchentransport durch<br />
Konzentrationsgradient, der<br />
Konzentrations-unterschiede<br />
ausgleicht.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 26<br />
Wärmestrom-<strong>Diffusion</strong>sstrom
Vergleich:<br />
Wärmestrom und <strong>Diffusion</strong>sstrom<br />
Wärmestrom:<br />
ΔQ TA<br />
− TB<br />
ΔT<br />
IQ = = = , RQ<br />
=<br />
Δt R R<br />
Q<br />
Q<br />
ρ<br />
Δx<br />
A<br />
Teilchenstrom:<br />
ΔN (c<br />
A<br />
- cB<br />
) Δc<br />
IN = = = , RN<br />
=<br />
Δt R R<br />
N<br />
N<br />
1<br />
D<br />
Δx<br />
A<br />
D = <strong>Diffusion</strong>skonstante,<br />
R N = Teilchenstromwiderstand<br />
In beiden Fällen handelt es sich um einen Strom, der ein Gefälle<br />
(Temperaturgefälle ∆T bzw. Konzentrationsgefälle ∆c) ausgleicht.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 27<br />
Wärmestrom-<br />
<strong>Diffusion</strong>sstrom
Teilchenstromdichte<br />
Üblicherweise wird der Teilchenstrom auf die Querschnittsfläche, durch die die<br />
Teilchen durch müssen, bezogen. Damit erhält man die Teilchenstromdichte:<br />
j<br />
IN<br />
A<br />
1<br />
A<br />
Δc<br />
R<br />
1<br />
A<br />
AD∆c<br />
∆x<br />
N<br />
= = = =<br />
N<br />
D<br />
Δc<br />
Δx<br />
Diese Beziehung ist als das 1. Fick’sche Gesetz bekannt. Falls ∆c > 0:<br />
Teilchen diffundieren von der höheren zur niedrigeren Konzentration. Die<br />
<strong>Diffusion</strong>skonstante ist ein Maß für die thermische Beweglichkeit von<br />
Molekülen. Sie hängt stark von der Temperatur ab.<br />
Einheiten:<br />
1<br />
s<br />
1<br />
m s<br />
m<br />
s<br />
2<br />
cm<br />
s<br />
[ I] = ; [ j ] = , [ D] = bzw. , = =<br />
2<br />
4<br />
2<br />
⎡Δc<br />
⎤<br />
⎢ Δx ⎥<br />
⎣ ⎦<br />
m<br />
m<br />
−3<br />
1<br />
m<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 28<br />
Teilchenstromdichte
Permeabilität P<br />
Andere Schreibweise für die Teilchenstromdichte:<br />
(c - c<br />
= D<br />
∆x<br />
1 2<br />
jN<br />
)<br />
=<br />
D<br />
∆x<br />
∆c<br />
=<br />
P<br />
∆c<br />
Permeabilität P ist <strong>Diffusion</strong>skonstante pro Wandstärke, oder<br />
Teilchenstromdichte pro Konzentrationsdifferenz:<br />
P<br />
=<br />
D<br />
Δx<br />
=<br />
jN<br />
Δc<br />
Einheit [P] = m/s, entspricht einer Geschwindigkeit<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 29<br />
Permeabilität
Permeabilität einer Zellmembrane<br />
Zellmembrane<br />
c A<br />
∆x<br />
c B<br />
Beispiel:<br />
Wanddicke einer Membrane:<br />
∆x = 1nm<br />
<strong>Diffusion</strong>skonstante von Wasser durch die<br />
Doppellipidschicht:<br />
D = 3×10 -10 cm 2 /s<br />
Wie groß ist die Permeabilität?<br />
P = D/∆x = 3x10 -3 cm/s<br />
In welcher Zeit durchquert H 2 O die Membrane?<br />
∆t = ∆x/P = 1 nm/3x10 -3 cm/s = 30 µs<br />
Quelle: Schmidt-Thews, Physiologie des<br />
Menschen, Springer, 1995<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 30
Permeabilität von Molekülen<br />
durch die Zellmembrane<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 31
Vergleich von <strong>Diffusion</strong> und <strong>Osmose</strong><br />
<strong>Osmose</strong>:<br />
Konzentrationsausgleich durch<br />
Wasserverschiebung<br />
<strong>Diffusion</strong>:<br />
Konzentrationsausgleich<br />
durch Ionenstrom<br />
Bei der Wasserverschiebung wird die<br />
Volumenarbeit pV =mgh geleistet<br />
<strong>Diffusion</strong> kostet keine<br />
Energie, da sie dem<br />
Konzentrationsgefälle folgt<br />
H. Zabel 18. Lektion: <strong>Löslichkeit</strong> und <strong>Osmose</strong> 32
Vergleich von <strong>Diffusion</strong> und <strong>Osmose</strong><br />
<strong>Diffusion</strong> 1. Gelöster Stoff diffundiert,<br />
nicht Lösungsmittel<br />
2. Kostet keine Energie<br />
<strong>Osmose</strong> 1. Lösungsmittel diffundiert,<br />
nicht gelöster Stoff<br />
2. Kostet Volumenenergie<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 33
Bezug zur Medizin<br />
• Gasaustausch in der Lunge<br />
• Wasser- und Protonenaustausch<br />
in der Zelle<br />
• Dialyse<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 34
Gasaustausch in der Lunge<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 35
Gasaustausch<br />
• Zellen brauchen Sauerstoff und produzieren<br />
CO 2 .<br />
• Atemorgane liefern beim Inhalieren O 2 und<br />
stoßen bei der Exspiration CO 2 aus.<br />
• Blut transportiert diese Gase, indem es O 2 zum<br />
Gewebe bringt und CO 2 zu den Lungen<br />
transportiert.<br />
• Der Austausch findet durch eine dünne<br />
Gewebewand zwischen Kapillare und<br />
Alveolarraum statt.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 36
Gasaustausch im Alveolarenraum<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 37
Dialysator<br />
Im Dialysator sind Blut und Dialysat<br />
durch eine Membrane getrennt. Die<br />
Porengröße in der Membran lässt<br />
Kreatin, Harnstoff und Harnsäure<br />
durch, aber nicht Erythrozyten,<br />
Proteine und Lipide. Das Blut wird<br />
durch <strong>Diffusion</strong> durch die Membrane<br />
von den harnpflichtigen Stoffen<br />
befreit. Das Dialysat setzt sich<br />
ähnlich wie Blut zusammen. Durch<br />
die jeweiligen chemische<br />
Konzentration der Elektrolyte kann<br />
kontrolliert werden, welche Ionen<br />
vom Blut ins Dialysat diffundieren,<br />
und welche nicht.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 38
Zusammenfassung:<br />
• <strong>Löslichkeit</strong> von Gasen in Lösungsmittel hängt vom Gasdruck ab.<br />
• Osmotischer Druck ist proportional zur Konzentration der gelösten<br />
Stoffmenge<br />
• Osmotische Druckdifferenz stellt sich bei unterschiedlichen<br />
Konzentrationen ein<br />
• Falls Wand zwischen Bereichen unterschiedlicher Konzentration<br />
semipermeabel ist, tritt Wasserverschiebung auf, um den osmotischen<br />
Druck auszugleichen.<br />
• <strong>Diffusion</strong> ist ein Teilchenstrom, der durch Massentransport einen<br />
Konzentrationsgradienten ausgleicht.<br />
• Permeabilität ergibt sich aus Teilchenstromdichte pro<br />
Konzentrationsdifferenz.<br />
• Man unterscheidet zwischen freier <strong>Diffusion</strong> und aktiviertem Transport.<br />
• Aktivierter Transport kann auch gegen den Konzentrationsgradienten<br />
gerichtet sein.<br />
H. Zabel 20. Lektion: <strong>Diffusion</strong> 39<br />
Zusammenfassung