Vorlesung Organische Chemie II
Vorlesung Organische Chemie II
Vorlesung Organische Chemie II
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Vorlesung</strong> <strong>Organische</strong> <strong>Chemie</strong> <strong>II</strong><br />
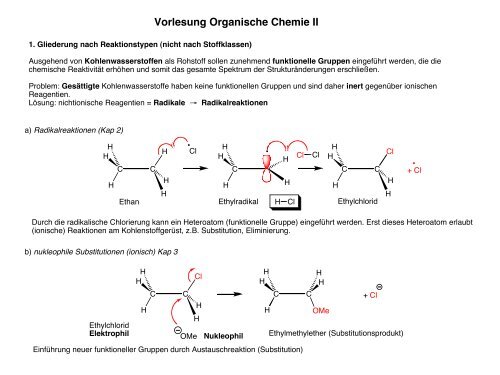
1. Gliederung nach Reaktionstypen (nicht nach Stoffklassen)<br />
Ausgehend von Kohlenwasserstoffen als Rohstoff sollen zunehmend funktionelle Gruppen eingeführt werden, die die<br />
chemische Reaktivität erhöhen und somit das gesamte Spektrum der Strukturänderungen erschließen.<br />
Problem: Gesättigte Kohlenwasserstoffe haben keine funktionellen Gruppen und sind daher inert gegenüber ionischen<br />
Reagentien.<br />
Lösung: nichtionische Reagentien = Radikale → Radikalreaktionen<br />
a) Radikalreaktionen (Kap 2)<br />
H<br />
H<br />
H<br />
C<br />
Ethan<br />
C<br />
H<br />
H<br />
H<br />
Cl<br />
H<br />
H<br />
C<br />
H<br />
Ethylradikal<br />
H<br />
Cl<br />
H<br />
H<br />
Cl<br />
Cl<br />
H<br />
H<br />
C C<br />
H<br />
Ethylchlorid<br />
Cl<br />
H<br />
H<br />
+ Cl<br />
Durch die radikalische Chlorierung kann ein Heteroatom (funktionelle Gruppe) eingeführt werden. Erst dieses Heteroatom erlaubt<br />
(ionische) Reaktionen am Kohlenstoffgerüst, z.B. Substitution, Eliminierung.<br />
b) nukleophile Substitutionen (ionisch) Kap 3<br />
Ethylchlorid<br />
Elektrophil<br />
H<br />
H<br />
H<br />
C<br />
OMe<br />
Cl<br />
H<br />
Nukleophil<br />
Einführung neuer funktioneller Gruppen durch Austauschreaktion (Substitution)<br />
C<br />
H<br />
H<br />
H<br />
H<br />
C<br />
C<br />
H<br />
H<br />
OMe<br />
+ Cl<br />
Ethylmethylether (Substitutionsprodukt)
c) Eliminierungen (ionisch) Kap 4<br />
Ethylchlorid<br />
Elektrophil<br />
H<br />
H<br />
H<br />
C<br />
Cl<br />
C<br />
H<br />
H<br />
OMe<br />
Base<br />
H<br />
H<br />
H<br />
C C<br />
MeOH + Cl<br />
H<br />
Ethylen (Eliminierungsprodukt)<br />
Entfernung von funktionellen Gruppen durch Eliminierung, gleichzeitig Erzeugung von Doppelbindungsfunktion<br />
Nebenreaktion bei Substitutionen.<br />
d) Additionen (ionisch) Kap 5<br />
H<br />
H<br />
C<br />
C<br />
H<br />
H<br />
Ethylen (Nukleophil)<br />
HCl<br />
Elektrophil (H + )<br />
H<br />
H<br />
H<br />
C<br />
C<br />
Cl<br />
H<br />
H<br />
Einführung von bis zu zwei funktionellen Gruppen durch elektrophile Addition an die Doppelbindung. Umkehr der Eliminierung.
e) Aromatische Substitutionen (ionisch) Kap 6<br />
Benzol<br />
(Nukleophil)<br />
Br<br />
Elektrophil<br />
H<br />
Br<br />
Br<br />
+ H +<br />
Addition<br />
Eliminierung<br />
Durch zweistufigen Additions-Eliminierungsmechanismus können Aromaten mit einem neuen Substituenten versehen werden.<br />
Elektrophile u. nukleophile Substitution am Aromaten möglich.<br />
f) Oxidationen u. Dehydrierungen (ionisch + radikalisch) Kap 7<br />
rad. ion. ion.<br />
CH 4 CH 3 OH CH 2 O<br />
HCOOH<br />
Methanol<br />
Formaldehyd<br />
Ameisensäure<br />
Einführung und Änderung funktioneller Gruppen durch Oxidation bzw. Dehydrierung. Rückreaktion = Reduktionen.<br />
g) Carbonylreaktionen (ionisch) Kap 8<br />
O<br />
O<br />
El<br />
H<br />
O<br />
H<br />
protoniertes Aceton<br />
Aceton<br />
(Dimethylketon)<br />
Nu<br />
CH 3 MgBr<br />
(CH 3 - )<br />
OMgBr<br />
tert.Butoxymagnesiumbromid
Bei Reaktionen von Carbonsäurederivaten an der CO-Gruppe können Heteroatomsubstituenten ausgetauscht werden.<br />
Die CO-Gruppe bleibt dabei erhalten.<br />
O<br />
MeOH (H + )<br />
O<br />
MeNH 2<br />
O<br />
OH<br />
OMe<br />
Essigsäuremethylester<br />
NHMe<br />
Essigsäure-N-methylamid<br />
Bei Reaktionen von Aldehyden u. Ketonen an der CO-Gruppe wird diese verändert. Z.B. Bildung einer neuen C-<br />
Heteroatombindung.<br />
O MeNH 2<br />
Me<br />
N<br />
Aceton-N-methylimin<br />
-H 2 O<br />
Bei Reaktionen von Carbonylverbindungen mit C-Nukleophilen entstehen C-C-Bindungen.<br />
O<br />
O<br />
O<br />
O<br />
H +<br />
OH<br />
O<br />
H<br />
Acetaldehyd<br />
H<br />
H<br />
Acetaldol<br />
H<br />
Vinyloge Carbonylverbindungen übertragen Polarität der CO-Gruppe auf das konjugierte Doppelbindungssystem<br />
O<br />
OMe<br />
Acrylsäuremethylester<br />
El<br />
O<br />
OMe<br />
Nu<br />
HC<br />
COOEt<br />
COOEt<br />
Anion des<br />
Malonsäurediethylesters<br />
COOEt<br />
O<br />
EtOOC<br />
OMe<br />
Michael-Addition
h) Reaktionen von Heterocarbonylverbindungen (ionisch) Kap 9<br />
O<br />
C<br />
O<br />
N<br />
O<br />
S<br />
N<br />
C<br />
S<br />
C<br />
N<br />
C<br />
Heterocarbonylgruppen zeigen Reaktivität analog zur Carbonylgruppe<br />
i) Umlagerungen (ionisch) Kap 10<br />
a) Pinakolonumlagerung:<br />
H + , - H 2 O<br />
OH OH<br />
OH<br />
HO<br />
-H + O Pinakolon<br />
Carbeniumion
1.1 Unterschiedliche Reaktionstypen in der <strong>Organische</strong>n Synthese<br />
Einteilung nach:<br />
1. elektronischen Gesichtspunkten:<br />
a) Radikalreaktionen<br />
Homolyse<br />
Cl Cl Cl + Cl<br />
Radikalaustausch<br />
2.Strukturänderungen:<br />
a) Substitution (S)<br />
NO 2<br />
+ HNO 3 + H 2 O<br />
b) polare (ionische) Reaktionen<br />
Heterolyse<br />
Cl + H CH 3 Cl-H +<br />
Elektrophil<br />
ionischer Austausch<br />
Cl + Cl<br />
I + Cl<br />
Et I + Cl<br />
Nukleophil<br />
Säure-Base-Rkt.<br />
+<br />
Et 3 N +<br />
Base<br />
Elektrophil<br />
H<br />
Et 3 N-H<br />
c) konzertierte Mehrzentrenreaktionen (Cycloadditionen)<br />
Cl<br />
Säure<br />
Elektrophil<br />
CH 3<br />
+<br />
Nukleophil<br />
d) Elektronenübertragungsreaktionen (Oxidationen u. Reduktionen)<br />
Cl<br />
b) Addition (A)<br />
c) Eliminierung (E)<br />
d) Umlagerungen<br />
+ Br 2<br />
Br Br<br />
NOH<br />
OH<br />
3. kinetischen Gesichtspunkten:<br />
a) monomolekulare Rkt.<br />
b) bimolekulare Rkt.<br />
c) trimolekulare Rkt.<br />
(H + )<br />
-H 2 O<br />
(H + )<br />
NH<br />
O<br />
Einelektronentransfer<br />
R 3 N + M 3+ R 3 N + M 2+<br />
Reduktionsmittel Oxidationsmittel<br />
(engl. SET)<br />
meistens Kombination: z.B. S N 2
1.2 Wichtige Prinzipien in der <strong>Organische</strong>n Synthese:<br />
a) Bei ionischen Reaktionen reagieren nukleophile Zentren immer mit elektrophilen Zentren<br />
b) Basen reagieren sehr schnell mit Säuren (Neutralisation)<br />
c) Harte Nukleophile (hohe e-Dichte) reagieren bevorzugt mit harten Elektrophilen (weiche Reagentien analog)<br />
d) Für den Reaktionsverlauf ist oft die Stabilität der Zwischen- oder Endprodukte wichtig:<br />
e) Reaktive Intermediate:<br />
H<br />
H<br />
C<br />
N<br />
R<br />
Br<br />
Carbeniumion<br />
Carbokation<br />
(sp 2 planar)<br />
Radikal<br />
(sp 2 planar)<br />
Carbanion<br />
(sp 3 tetraedrisch)<br />
Carben<br />
Elektronensextett<br />
(sp 2 planar)<br />
Radikalkation<br />
(sp 2 planar)<br />
Radikalanion<br />
f) Stabilisierung der Intermediate (Produkte) durch:<br />
Induktiven Effekt (+I, -I) mesomeren Effekt (+M, -M) Hyperkonjugation<br />
CH 3<br />
Cl<br />
O<br />
O<br />
H 3 C CH 3 Cl Cl<br />
O<br />
+I -I<br />
O<br />
+M - M<br />
g) Lösungsmitteleffekte: Stabilisierung polarer Zentren durch polare LM (festere Solvathülle)
2. Radikalreaktionen<br />
2.1 Erzeugung von Radikalen<br />
a) Thermolyse<br />
Crackprozesse spalten<br />
C-C-Bindungen (800°)<br />
Gomberg<br />
CH 2<br />
+<br />
CH 2<br />
ΔT Pb(Me) 4<br />
+<br />
H 2 C<br />
CH 3<br />
ΔT<br />
Mesomerie<br />
Tritylradikal<br />
Radikalische<br />
Kombination<br />
Hexaphenylethan<br />
(instabil)<br />
H<br />
Olefine + Alkane<br />
Thermolyse<br />
Δ D H= 46 KJ/mol<br />
b) Photolyse, Radiolyse durch Absorption von Lichtquanten<br />
(λ = 300nm ≈ 400 kJ / mol)<br />
Pb + 4 CH 3<br />
O<br />
Strahlung muß absorbiert werden z.B. durch Sensibilisator (Farbstoffe, Ketone)<br />
Cl<br />
Cl<br />
hν<br />
hν<br />
Cl<br />
Cl<br />
O<br />
Benzophenon<br />
c) Redoxprozesse (chemische Energie)<br />
e - -Transfer<br />
ROOH + Fe 2+ R O O H + Fe 3+ RO + OH + Fe 3+<br />
Kolbe Synthese<br />
R<br />
O<br />
O<br />
Anode (+)<br />
- e - R<br />
O<br />
O<br />
- CO 2 R Anode<br />
R<br />
R R<br />
R<br />
R<br />
präp. Dimerisierung von Alkylradikalen<br />
(Orientierung der Carboxylate an der Anode)
Cl<br />
Ag<br />
Cl<br />
Ag<br />
- AgCl<br />
O<br />
Na-Metall<br />
O<br />
Na<br />
Tritylchlorid<br />
Tritylradikal<br />
Benzophenon<br />
Ketyl (blaues Radikalanion)<br />
Sauerstoff- u. Wasserfänger<br />
d) mechanische Energie<br />
(Ultraschall, Schwingmühle)<br />
2.2. Stabilität von Radikalen ≈ Stabilisierung des freien Radikalelektrons<br />
Allyl u. Benzylverbindungen bilden leicht Radikale (Mesomeriestab. des Radikals)<br />
Dissoziationsenthalpie einer Bindung ist niedriger, wenn energieärmeres (stabileres) Radikal entsteht<br />
Allylradikal:<br />
Benzylradikal:<br />
CH 2 CH 2 CH 2 CH 2<br />
Stabilisierung (leichtere Bildung): allyl = benzyl > tert. > sek. > prim. C-Radikal<br />
Erklärung: sterische Entspannung oder Hyperkonjugation
Radikalstrukturen und Radikalstabilitäten
2.3 Lebensdauer von Radikalen<br />
reaktive, meist kurzlebige Teilchen ( 10 -3 s), niedrige Konzentration<br />
Stabile isolierbare Radikale: niedrige Reaktivität u. hohe Langlebigkeit<br />
O 2 N<br />
O 2 N<br />
N<br />
N<br />
NO 2<br />
N<br />
N<br />
NO 2<br />
N<br />
N<br />
O 2 N<br />
O 2 N<br />
O<br />
O<br />
DPPH (Diphenylpikrylhydrazyl)<br />
TEMPO (2,2,6,6-Tetramethylpiperidin-1-oxyl)<br />
2.4 Typische Reaktionen von Radikalen<br />
a.) Verlust der Radikaleigenschaften<br />
1.) Radikalkombination<br />
b) Übertragung der Radikaleigenschaften<br />
1.) Zersetzung oder Fragmentierung (z.B. Starter)<br />
H 2 C<br />
CH 2<br />
O<br />
O<br />
+ CO 2<br />
2.) Disproportionierung<br />
2 H +<br />
H<br />
2.) Addition an Mehrfachbindungen (z.B. Polymerisation)<br />
Br + Br CH 2 CH 2<br />
3.) Abspaltung von Atomen oder Gruppierungen durch Radikale<br />
Cl + H R<br />
Cl-H + R<br />
(wesentlicher Teilschritt radikalischer Substitutionen)
c) Radikalkettenreaktionen (allg. Schema)<br />
Kettenstart: X X<br />
Kettenfortpflanzung:<br />
(Übertragung)<br />
Kettenabbruch:<br />
(Rekombination)<br />
X + H-R<br />
R + X-X<br />
X + X<br />
R + X<br />
2 X<br />
X-H + R<br />
R-X + X<br />
X-X<br />
R-X<br />
Start (X 2 )<br />
(Produkt) R-X<br />
X<br />
X 2<br />
R<br />
H-R (Edukt)<br />
H-X<br />
R + R<br />
R-R<br />
Radikalübertragung<br />
2.5. Reaktivität und Selektivität von Radikalen<br />
a) Relative Reaktivitäten von Radikalen mit Toluol<br />
H<br />
H H<br />
X<br />
H<br />
H<br />
+ H-X<br />
Reaktivität (X ):<br />
F > HO > CL > CH 3 > Br > ROO<br />
b) Radikalische Halogenierungen von Methan:<br />
X 2 + CH 4 H-X + X-CH 3 F: -423 kJ/mol (zu exotherm)<br />
Gesamtbilanz für X =<br />
Cl: -100<br />
(wenig selektiv)<br />
Br: -25<br />
(selektiv)<br />
I: +54 (endotherm - keine Rkt) Reaktivität<br />
F<br />
Cl<br />
Br<br />
I<br />
Selektivität
c) relative Reaktivitäten<br />
F<br />
Cl<br />
Br<br />
1° C-H 2° C-H 3° C-H<br />
1<br />
1<br />
1<br />
normiert<br />
1.2<br />
3.9<br />
32<br />
1.4<br />
5.1<br />
1600<br />
experimentelle<br />
Best. der rel.<br />
Reaktivitäten:<br />
+<br />
(Butan+Isobutan)<br />
X 2<br />
X<br />
X<br />
+<br />
X<br />
X<br />
häufig: hohe Reaktivität bedingt niedrige Selektivität und umgekehrt: Erklärung über Hammond-Postulat<br />
Hammond-Postulat<br />
freie Energie<br />
Reaktionskoordinate<br />
Exotherme Reaktion (früher ÜZ)<br />
Struktur des ÜZ ähnelt Edukten<br />
Endotherme Reaktion (später ÜZ)<br />
Struktur des ÜZ ähnelt Produkten<br />
>1kcal<br />
freie Energie<br />
Cl<br />
+Alkan<br />
2kcal<br />
2kcal<br />
1°<br />
2°<br />
3°<br />
HCl+ R<br />
freie Energie<br />
Br<br />
+Alkan<br />
1.5 kcal<br />
2kcal<br />
2kcal<br />
1°<br />
2°<br />
3°<br />
HBr+ R<br />
Reaktionskoordinate<br />
Cl-Radikal unselektiv, da früher ÜZ<br />
(nahe an Alkan mit ähnlichem Energieinhalt)<br />
Reaktionskoordinate<br />
Br-Radikal selektiv, da später ÜZ<br />
(nahe an Alkylradikalen (1°,2°,3°) mit verschiedenem<br />
Energieinhalt)
2.6 Radikalische Chlorierung<br />
a) in Seitenkette (benzylische H) von Aromaten präparativ nutzbar: SSS-Regel (Siedehitze, Sonnenlicht, Seitenkette)<br />
Kettenstart: Kette:<br />
H<br />
Cl H Cl-Cl H<br />
H<br />
hν<br />
Cl<br />
Cl 2 2 Cl<br />
H - HCl<br />
H<br />
H<br />
Toluol<br />
Benzylchlorid<br />
+ Cl<br />
H<br />
Cl<br />
H<br />
Benzylchlorid<br />
Cl 2<br />
hν (ΔT)<br />
- HCl<br />
Cl<br />
H<br />
Cl<br />
Benzylidendichlorid<br />
(Benzalchlorid)<br />
Cl 2<br />
hν (ΔT)<br />
- HCl<br />
Cl<br />
Cl<br />
Cl<br />
Benzotrichlorid<br />
Cl 2<br />
hν (ΔT)<br />
Cl<br />
Ethylbenzol<br />
- HCl<br />
1-Phenylethylchlorid<br />
b) von aromatischen Aldehyden u. Derivaten<br />
X Cl 2 (Cl )<br />
X<br />
R<br />
R<br />
H<br />
Cl<br />
X<br />
R<br />
+ HCl<br />
z.B.<br />
O<br />
H<br />
Benzaldehyd<br />
OH<br />
N<br />
Cl 2<br />
- HCl<br />
Cl 2<br />
O<br />
Cl<br />
Benzoylchlorid<br />
OH<br />
N<br />
X = O, N-OH, N-NH 2<br />
H<br />
- HCl<br />
Cl<br />
Benzaldoxim<br />
Benzhydroximoylchlorid<br />
c) Selektive Chlorierung mit Sulfurylchlorid: R-H + SO 2 Cl 2 R-Cl + SO 2 + HCl
Initiatoren:<br />
AIBN (Azo-bis-isobutyronitril)<br />
Δ T<br />
NC N N CN 2 N<br />
N C +N 2<br />
Kettenstart<br />
Kettenfortpflanzung<br />
Dibenzoylperoxid<br />
Initiator<br />
(AIBN, Dibenzoylperoxid)<br />
O<br />
2 St<br />
St Cl S Cl<br />
St-Cl +<br />
O<br />
R-H + SO 2 Cl<br />
R + Cl-SO 2 Cl<br />
O<br />
O<br />
R + H-SO 2 Cl (SO 2 +HCl)<br />
RCl + SO 2 Cl<br />
2.7. Radikalische Bromierung Br<br />
o-Xylol<br />
Br 2 , hν<br />
O<br />
O<br />
O<br />
S<br />
O<br />
Cl<br />
Δ T<br />
2<br />
+ HBr<br />
O<br />
O<br />
SO 2 Cl selektiver als Cl<br />
Beisp.:<br />
2 + 2 CO 2<br />
Phenylradikal<br />
SO 2 Cl 2<br />
AIBN<br />
-HCl,<br />
-SO 2<br />
Cl<br />
Selektive Bromierung mit NBS in Allyl(Benzyl-)stellung unter Erhalt der Doppelbindung<br />
Starter<br />
(AIBN)<br />
H<br />
H<br />
Br<br />
O<br />
N<br />
O<br />
N-Bromsuccinimid<br />
(NBS)<br />
AIBN<br />
3-Bromcyclohexen<br />
Br + HN<br />
O<br />
O<br />
Succinimid<br />
Mech: a) NBS Br 2<br />
(geringe Konz.)<br />
b) HBr + NBS<br />
c) Br 2 +<br />
H<br />
O<br />
NH<br />
O<br />
Br<br />
+ Br 2<br />
-HBr<br />
Br<br />
+ Br<br />
H<br />
analog: Ethylbenzol<br />
H<br />
H
2.8. Peroxygenierung<br />
R-H + O 2<br />
R-OO-H<br />
(Hydroperoxid)<br />
R-OO-R (Peroxid)<br />
Start<br />
R-H + O-O<br />
R + H-O-O<br />
Fortpflanzung<br />
R<br />
+ O-O<br />
R-OO<br />
OOH<br />
R-O-O-H + M + M<br />
R-OO + H-R<br />
R-OOH + R<br />
H<br />
R-OO + H<br />
Katalyse durch Schwermetallionen, Peroxide, Licht<br />
O 2 H +<br />
R-O-O-H + M + R-O - O-H + M 2+<br />
R-O + OH + M 2+<br />
Isopropylbenzol Cumolhydroperoxid<br />
2+ +<br />
(Cumol)<br />
Phenol +<br />
Aceton<br />
Autoxidation von Aldehyden:<br />
O<br />
H<br />
O-O<br />
O<br />
OOH<br />
Benzaldehyd Perbenzoesäure Halbacetal von Benzaldehyd mit<br />
Benzoesäure<br />
Perbenzoesäure<br />
O<br />
O<br />
OH<br />
H<br />
O<br />
2<br />
O<br />
OH<br />
Bei Ölfarben Siccative: Co,Mn, Pb-Salze<br />
(katalysieren Autoxidation in Allylstellung)<br />
R-O-O - H + M + M + , O 2 Harzbildung<br />
O<br />
H<br />
O 2<br />
COOR<br />
COOR<br />
O 2, RH<br />
OOH<br />
COOR<br />
(Vernetzung)
Peroxidgefahr bei Ethern:<br />
Diethylether, Diisopropylether, THF<br />
Anreichern d. Peroxide im Destillationsrückstand<br />
Peroxidteststäbchen<br />
Extrahieren mit Alkali<br />
O<br />
THF<br />
O 2<br />
-HOO<br />
O<br />
H<br />
O<br />
H<br />
O 2, THF<br />
O<br />
OOH<br />
+<br />
O<br />
H<br />
2.9. Radikalische Reduktion R-X + Bu 3 SnH R-H + Bu 3 Sn-X<br />
Start<br />
Kette<br />
(Initiator) St + H-SnBu 3 St-H + SnBu 3<br />
Br<br />
R-X + SnBu 3 R + X-SnBu<br />
AcO<br />
O<br />
3<br />
AcO<br />
AcO<br />
R + H-SnBu 3 R-H + SnBu 3 MeO<br />
AIBN<br />
D-SnBu 3<br />
D<br />
AcO<br />
AcO<br />
O<br />
AcO<br />
MeO<br />
2.10. Radikalische Addition an Mehrfachbindungen<br />
a) radikalische Polymerisation<br />
St<br />
St<br />
AIBN<br />
(Starter)<br />
NC<br />
+<br />
Styrol<br />
mesomeriestab.<br />
Benzylradikal<br />
+ n<br />
Styrol<br />
n<br />
Abbruch
) radikalische Addition an Doppelbindungen (Peroxideffekt)<br />
HBr (Br) HBr (H + )<br />
hν<br />
Radikalstarter<br />
(Dibenzoylperoxid)<br />
Br<br />
Anti-Markovnikov Addition<br />
ionisch:<br />
Br<br />
Markovnikov Addition<br />
Starter<br />
2<br />
O<br />
O<br />
- CO 2 H-Br<br />
+ Br<br />
H<br />
Br<br />
H-Br<br />
H<br />
+ Br<br />
Br<br />
Beisp:<br />
R<br />
Starter<br />
HBr (Br )<br />
CCl 4 (CCl 3 )<br />
R'CHO (R'CO)<br />
R'SH (R'S )<br />
R<br />
R<br />
R<br />
R<br />
H<br />
Cl<br />
H<br />
H<br />
Br<br />
mit HCl, HI keine Rkt.<br />
S R' CCl 3<br />
Bei Polymerisation Bildung von Telomeren<br />
R'<br />
O<br />
2.11. Radikale in der Stratosphäre<br />
Start:<br />
F<br />
Cl<br />
C<br />
F<br />
Cl<br />
h ν<br />
Cl<br />
Kette:<br />
F C + Cl<br />
Cl O O O O 2 + O Cl<br />
F<br />
FCKW<br />
Cl O<br />
O O O<br />
Cl + 2 O 2
2.12. Radikale in biologischen Systemen<br />
a) Ribonukleotid-Reduktase<br />
Tyrosylradikal<br />
P<br />
O<br />
O<br />
P<br />
H<br />
O<br />
H<br />
O<br />
Base<br />
P<br />
O<br />
P<br />
O<br />
O<br />
Base<br />
- OH<br />
+ H<br />
+ H<br />
P<br />
O<br />
P<br />
O<br />
H<br />
O<br />
Base<br />
Protein<br />
S<br />
HO OH<br />
Ribonukleotid (RNA)<br />
HO<br />
OH<br />
HO H<br />
Desoxyribonukleotid (DNA)<br />
b) Antioxidantien (Radikalinhibitoren)<br />
O<br />
H<br />
R<br />
O<br />
R<br />
O<br />
O<br />
OH<br />
Hydrochinon<br />
-RH<br />
O<br />
H<br />
-RH<br />
O<br />
O<br />
Chinon (p-Benzochinon)<br />
stab. Radikale<br />
H<br />
CH 2 OH<br />
OH<br />
O<br />
O<br />
R<br />
H<br />
CH 2 OH<br />
OH<br />
O<br />
O<br />
R<br />
H<br />
CH 2 OH<br />
OH<br />
O<br />
O<br />
HO<br />
O<br />
Vitamin E (α-Tocopherol)<br />
O<br />
O<br />
R<br />
-RH<br />
O OH<br />
H<br />
Ascorbinsäure<br />
O<br />
O<br />
H<br />
-RH<br />
O O<br />
Dehydroascorbinsäure<br />
HO<br />
tBu<br />
OCH 3<br />
HO<br />
tBu<br />
tBu<br />
O<br />
tBu<br />
tBu<br />
BHA<br />
BHT
3. Nukleophile Substitution, Elimierung, Addition<br />
Nukleophile Substitution<br />
Nukleophil reagiert am C<br />
(als Lewis Base)<br />
Br<br />
O-Me<br />
OMe<br />
+ Br<br />
Eliminierung<br />
Nukleophil reagiert am H<br />
(als Brönstedt Base)<br />
Br<br />
H<br />
O-Me<br />
Me-OH+ Br<br />
+H-Br<br />
Addition<br />
formale Rückreaktion<br />
der Eliminierung<br />
3.1 Nukleophile Substitution<br />
Allgemein: Nu + R-X Nu-R + X<br />
Nukleophil Elektrophil Nukleofuge Austrittsgruppe
a) Nukleophile: Anionen oder Neutralstoffe mit freiem Elektronenpaar<br />
Nu =<br />
Cl, Br, I, HO, RO, HS, RS, R 3 C lN Cl H-O-H, R-O-H, R-S-H, lNH 3 , lNR 3<br />
b) Elektrophile: enthalten nukleofuge Austrittsgruppe:<br />
elektronenziehender Substituent polarisiert C-X-Bindung<br />
C<br />
δ +<br />
δ -<br />
X<br />
Dipol<br />
Halogenide<br />
Sulfate, Sulfonate<br />
Oxonium-, Sulfonium-, Ammonium-,<br />
Diazoniumverbindungen<br />
Cl Br I<br />
O<br />
OH<br />
S O<br />
O<br />
O<br />
OR<br />
S O<br />
O<br />
O<br />
S<br />
O<br />
O<br />
O<br />
CF 3<br />
S O<br />
O<br />
H<br />
O<br />
H<br />
R<br />
R<br />
H X<br />
R<br />
R<br />
O S N<br />
R<br />
N<br />
N<br />
p-Toluolsulfonat<br />
(Tosylat)<br />
Trifluormethansulfonat<br />
(Triflat)<br />
weitere Elektrophile<br />
Cl<br />
Cl<br />
O O O O
c) Nukleophile Substitution: 2 Teilreaktionen<br />
Nukleophiler Angriff<br />
NuI C X<br />
Nukleofuger Austritt<br />
Teilraktionen gleichzeitig oder nacheinander:<br />
Energieprofile<br />
1) zuerst Spaltung C-X-Bindung,<br />
dann Aufbau der C-Y-Bindung: (S N 1)<br />
Cl<br />
-Cl<br />
INu<br />
Nu<br />
E<br />
Reaktionskoordinate<br />
2) Bindungsbruch und Bindungsbildung<br />
erfolgen gleichzeitig: (S N 2)<br />
Nu<br />
H<br />
C<br />
X<br />
H<br />
Nu C X<br />
Nu<br />
C<br />
H<br />
+ X<br />
E<br />
3) zuerst Aufbau der C-Y-Bindung, dann Spaltung C-X-Bindung:<br />
bei Si-Verbindungen<br />
am sp 2 -Kohlenstoff<br />
Nu - Si X<br />
Nu Si X<br />
MeO<br />
O<br />
N +<br />
F<br />
O<br />
NO 2<br />
O<br />
OMe<br />
OH<br />
HO O<br />
OMe<br />
E<br />
nukleophile<br />
aromatische<br />
Substitution<br />
Rkt. von<br />
Carboxylverbindungen
3.2.Faktoren, die S N -Reaktionen beeinflussen:<br />
a) Struktur des Elektrophils<br />
b) Reaktivität der Austrittsgruppe<br />
c) Reaktivität des Nukleophils<br />
d) Lösungsmittel<br />
e) Katalysator<br />
3.2.1. Einfluß der Struktur des Elektrophils<br />
Sterische Hinderung am C-Atom<br />
Stabilisierung des Carbeniumions<br />
H 3 C<br />
H 3 C X < H 2 C X<br />
H 3 C<br />
< HC X<br />
H 3 C<br />
CH 3<br />
< H 3 C C X<br />
CH 3<br />
Austrittsgruppe am prim. C<br />
S N 2 Mechanismus<br />
bei sek. C<br />
Grenzfälle<br />
(S N 2 + S N 1 möglich)<br />
Austrittsgruppe am tert. C<br />
S N 1 Mechanismus
a) Beschleunigung der S N 1-Reaktion durch Mesomeriestabilisierung des Carbeniumions<br />
OMe<br />
z.B. leichte Bildung u. Spaltung (sauer) von Tritylethern<br />
OMe<br />
Benzyl + < Diphenylmethyl + < Trityl + < Dimethoxytrityl +<br />
Cl<br />
-Cl<br />
HO-R<br />
R<br />
O<br />
H<br />
R<br />
O<br />
+H<br />
(Triphenylmethyl)<br />
b) Beschleunigung der S N 2-Reaktion bei Stabilisierung des S N 2-Üz durch benachbarte π-Systeme<br />
Testreaktion (S N 2):<br />
H 3 C<br />
CH 2 CH 2<br />
Cl<br />
KI/Aceton<br />
H 3 C<br />
CH 2 CH 2<br />
I<br />
+ KCl<br />
H 3 C CH 2 CH 2 Cl H 2 C CH CH 2 Cl CH 2 Cl<br />
V rel 1 90 270<br />
S N 2'<br />
Nu<br />
S N 2<br />
π*<br />
Nu -<br />
EtO<br />
O<br />
CH 2 Cl N C CH 2 Cl C CH 2 Cl<br />
O<br />
1600 2800 32000<br />
X<br />
X<br />
σ*<br />
Chloressigsäureethylester Chloracetonitril Phenacylchlorid<br />
c) Reaktivitätserniedrigung der S N 2-Reaktion durch sterische Hinderung am β-Kohlenstoff<br />
H 3 C<br />
H 3 C<br />
CH 2 CH 2 Cl<br />
H 3 C C CH 2<br />
V rel 10 6 H 3 C<br />
1<br />
Cl<br />
Neopentylchlorid
d) Reaktivitätserhöhung bei intramolekularen Reaktionen (Nachbargruppenreaktionen)<br />
Br<br />
OH<br />
Br<br />
O<br />
intramolekulare Reaktion durch<br />
Vororientierung (Nähe) bevorzugt<br />
HO<br />
O<br />
Br<br />
HO<br />
O<br />
Br<br />
OH<br />
intermolekulare Reaktion (bimolekular)<br />
sehr langsam (Spuren)<br />
3.2.2. Einfluß der Austrittsgruppe bei S N 2 u. S N 1 Reaktionen<br />
Testreaktion<br />
X<br />
Vrel<br />
OH + R-CH 2 -X<br />
- X<br />
R-CH 2 -OH<br />
I<br />
Br<br />
30000<br />
20000<br />
Cl<br />
200<br />
F<br />
1<br />
Reaktivität des Elektrophils:<br />
unreaktiv<br />
reaktiv<br />
R-NH 2 > F ><br />
Cl > Br ≈ OTs > I<br />
Basizität der Abgangsgruppe<br />
Bindungsdissoziationsenergie
3.2.3. Reaktivitätsabschätzung von Nukleophilen bei S N 2 Reaktionen<br />
bei deprotonierbaren Nukleophilen:<br />
RCOOH < RCOO<br />
Ar-OH < ArO<br />
R-OH < R-O<br />
Anion: besseres Nukleophil + stärkere Base<br />
als die korrespondierende Säure<br />
bei gleichem nukleophilem Atom:<br />
bei Wechsel der Periode des nu. Atoms meist:<br />
RCOOH < ArOH < ROH < RCOO < ArO < R-O<br />
Reaktivität (Nukleophilie)<br />
Basizität<br />
Reaktivität (Nukleophilie)<br />
höhere Polarisierbarkeit<br />
geringere Solvatation<br />
RO<br />
RS<br />
RSe<br />
F<br />
Cl<br />
I<br />
3.2.4. Lösungsmitteleffekte<br />
a) Solvatisierung in protischen LM<br />
b) Solvatisierung in dipolar aprotischen LM<br />
H<br />
O<br />
H<br />
H<br />
O<br />
H<br />
Cl H O<br />
H<br />
O<br />
H<br />
H<br />
H<br />
H<br />
O<br />
H<br />
H<br />
O<br />
Na +<br />
O<br />
H<br />
H<br />
H<br />
O<br />
H<br />
gute Solvatisierung von Anionen u. Kationen<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
O -<br />
S +<br />
H<br />
H<br />
H<br />
S +<br />
O -<br />
H H<br />
H<br />
Cl S + O - Na +<br />
S +<br />
O -<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Anionen schlecht solvatisiert<br />
H<br />
H H<br />
H<br />
H<br />
H<br />
O -<br />
S +<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
O -<br />
Kationen gut solvatisiert<br />
H H<br />
H<br />
S +<br />
H<br />
H H
c) In protonischen LM<br />
bei S N 1 Substraten verbesserte Abspaltung der Abgangsgruppe durch hohe Solvatation (Stabilisierung) der entstehenden Ionen<br />
Solvolyse:<br />
Cl<br />
- Cl<br />
NuH<br />
- H +<br />
Nu<br />
NuH<br />
k rel<br />
EtOH<br />
MeOH HCOOH H 2 O<br />
1 9 12200 335000<br />
(NuH = Lösungsmittel)<br />
im S N 2-ÜZ erfordert die Desolvatisierung eines anionischen Nukleophils Energie<br />
starke H-Brücken (H + hart) zu harten Nukleophilen (Reaktivitätserniedrigung)<br />
weniger H-Brücken zu weichen Nukleophilen (Reaktivitätserhöhung)<br />
H<br />
O<br />
H<br />
H<br />
Reaktivität bei S N 2 im prot. LM : CH 3 COO - < F - < Cl - < HO - < Br - < I -<br />
O<br />
H<br />
H<br />
Cl<br />
H<br />
O<br />
H<br />
H<br />
H<br />
I<br />
d) Im dipolar-aprotonischen LM (HMPT, DMF, DMSO) niedrige Solvatation von Anionen (nackte Anionen)<br />
Reaktionsgeschwindigkeit bei S N 2-Reaktionen in dip. aprot. LM erhöht<br />
Nu - + CH 3 -I<br />
I - + CH 3 -Nu<br />
(Reaktionszeiten<br />
97% Umsatz)<br />
MeOH (prot.)<br />
I - (17min)<br />
DMF (dip. aprot.)<br />
I - (8.7s)<br />
Br - (12h)<br />
Br - (8.7s)<br />
Cl - (13d)<br />
Cl - (1.4s)<br />
F - (2,2 a)<br />
F - (
e) Nukleophilie von Salzen: Anion nur als freies Ion nukleophil (Ionenpaar unreaktiv)<br />
bei S N 2 Reaktionen:<br />
Reaktivität d. Anions<br />
Ionenradius<br />
Dissoziation im org LM<br />
LiF < LiCl < LiBr < LiI<br />
LiCl < NaCl < KCl < CsCl<br />
Cs-Effekt: Cs-Salz reaktiver als Na-Salz<br />
Reaktivitätsverbesserung durch Kationensolvatisierung im LM oder Kryptanden<br />
Fähigkeit zur Kationensolvatisierung:<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
Et 2 O < THF < Ethylenglycoldimethylether
Nitrit<br />
3.2.6 Regioselektivität ambidenter<br />
Nukleophile O N O<br />
Cyanid<br />
C<br />
N<br />
Enolat<br />
C C O<br />
H<br />
N O<br />
O<br />
O<br />
C N<br />
C C<br />
Nitril<br />
S N 2<br />
S N 1<br />
CH 2 C N<br />
KCN<br />
N=C Isonitril<br />
H<br />
O: hart<br />
N: weich<br />
N: hart<br />
C: weich<br />
O: hart<br />
C: weich<br />
a) hartes Elektrophil reagiert bevorzugt mit dem härteren Nukleophil (größere Ladungsdichte)<br />
O<br />
O<br />
O<br />
O<br />
Me-I<br />
Me-OTf<br />
OMe<br />
C: weich O: hart<br />
weiches El.<br />
hartes El.<br />
C-Alkylierung<br />
O-Alkylierung<br />
Enolether<br />
b) Härte (Ladungsdichte) des reagierenden C-Atoms steigt an beim S N 1-Mechanismus (rel. zu S N 2)<br />
S N 2<br />
S N 1<br />
Nitroalkan<br />
CH 2 NO 2 AgNO 2<br />
ONO tert. Alkylnitrit<br />
CH 2 -Cl<br />
Cl<br />
weich-weich-Kombination<br />
hart-hart-Kombination
3.2.7 Phasentransferkatalyse (Beschleunigung im Zweiphasensystem)<br />
ohne PTC:<br />
H 2 O<br />
<strong>Organische</strong> Phase<br />
(z.B. CH 2 Cl 2 )<br />
Na N 3<br />
R-X<br />
(unlösl. in H 2 O)<br />
keine Reaktion<br />
(NaN 3 unlöslich in org. LM)<br />
sehr langsame Rkt. an der Grenzfläche<br />
mit Phasentransferkatalysator(PTC):<br />
PTC:<br />
Bu<br />
Bu<br />
N<br />
Bu<br />
Bu<br />
HSO 4<br />
Me<br />
Oct<br />
N<br />
Oct<br />
Oct<br />
Cl<br />
(Aliquat 336)<br />
Nukleophil<br />
PTC<br />
COONa<br />
H 2 O<br />
freie Ionen<br />
Na N 3 NR 4 X<br />
NR 4 Cl<br />
<strong>Organische</strong><br />
R-Cl<br />
Phase (CH 2 Cl 2 )<br />
[Kontaktionenpaare]<br />
Extraktion (lipophil)<br />
[NR 4 N 3 + H 2 O 0-4 ]<br />
R-N 3 + [NR 4 Cl]<br />
Produkt<br />
Extraktion hydrophil)<br />
O<br />
C<br />
Bu-Br, Aliquat 336<br />
CH 2 Cl 2, H 2 O<br />
O-Bu<br />
+ NaBr<br />
Reaktionsbeschleunigung durch hohe Lipophilie der Ammoniumsalze (leichter Phasentransfer)<br />
hohe Umsätze bei niedrigen Reaktionstemperaturen<br />
keine hochsiedenden dipolar aprotischen LM notwendig<br />
Aussalzeffekt erhöht Ionenpaarkonzentration in org. Phase
3.2.8 S N -Reaktionen von Alkoholen u. Ethern<br />
a) Bildung von Halogeniden<br />
Br<br />
CH 3 Br<br />
H 3 C OH<br />
+ OH<br />
H-Br<br />
OH<br />
S N 2<br />
2<br />
Br<br />
OH<br />
H 2 SO 4 ΔT 6h (93%)<br />
+ H 2 O<br />
Br<br />
H-Cl<br />
- H Cl<br />
2 O<br />
OH OH 2<br />
Cl HCl, H 2 O RT 20 min (99%)<br />
Reaktionsgeschwindigkeit ≈ Säurestärke: HI > HBr > HCl > HF<br />
Ausbeutesteigerung in Gleichgewichtsreaktionen durch Extraktion oder Überschuß von Reaktanden<br />
Nebenraktionen: Ether, Olefine, Umlagerung bei sek u. tert. ROH (S N 1)<br />
Cl<br />
OH<br />
H + (HBr)<br />
~ H<br />
Br<br />
Br<br />
-H 2 O<br />
H<br />
Alternativen: Halogenide aus Alkohol + SOCl 2 (PCl 3 , PCl 5 )<br />
oder Tosylat nach Finkelstein substituieren<br />
OH<br />
Cl<br />
O<br />
O<br />
O O<br />
Pyridin<br />
S<br />
S<br />
O S Cl<br />
Cl Cl -H + Cl Cl -<br />
OH<br />
Cl<br />
O<br />
S<br />
O<br />
Pyridin<br />
-HCl<br />
O<br />
O<br />
S<br />
O<br />
DMSO<br />
Na + Br -<br />
Br<br />
NaO<br />
O<br />
S<br />
O<br />
(NaOTs)
) Saure Veretherung HO CH 2 CH 3<br />
2 Et-OH<br />
H<br />
H 3 C CH 2<br />
H<br />
O<br />
H<br />
- H 2 O<br />
H<br />
O<br />
O<br />
+ H<br />
OH<br />
H (H 2 SO 4 )<br />
-H 2 O<br />
-H (E1)<br />
EtOH (Lösungmittel)<br />
S N 1<br />
O<br />
Et<br />
+ H<br />
c) Etherspaltung (sauer)<br />
Nu<br />
H 3 C<br />
OR<br />
CH 3 Nu<br />
+ RO<br />
O<br />
H-Hal<br />
H<br />
O<br />
Hal<br />
+<br />
OH<br />
Reaktionsgeschwindigkeit:<br />
HI > HBr > HCl<br />
Hal<br />
O<br />
Et<br />
H-Hal<br />
O<br />
Et<br />
HO<br />
Et<br />
Hal<br />
HO<br />
Et<br />
Beisp:<br />
O<br />
THF<br />
H<br />
Hal<br />
Hal<br />
HCl<br />
S N 2 OH Cl<br />
HCl<br />
S N 2 Cl Cl<br />
NaCN<br />
S N 2<br />
NC<br />
CN<br />
Adipinsäuredinitril<br />
Adipinsäure<br />
COOH<br />
HOOC<br />
H 2 N<br />
NH 2<br />
Hexamethylendiamin<br />
-H 2 O<br />
Nylon (Polyamid)
3.2.9 S N -Reaktionen an Alkylhalogeniden, Sulfaten u. Sulfonaten<br />
a) Hydrolyse R-X + HOH R-OH + HX<br />
Problem: H 2 O schwaches Nu; Mischbarkeit<br />
1.) saure Katalyse<br />
H<br />
H<br />
O<br />
R X FeCl 3 HO-R + HX + FeCl 3<br />
2.) basische Hydrolyse HO + R X<br />
schnelle Hydrolyse nach S N 1:<br />
- X<br />
R-OH<br />
OH (- H 2 O) R X<br />
R-O<br />
- X<br />
R-O-R<br />
Cl<br />
H 2 O<br />
HO-H<br />
O H H<br />
O H<br />
Tritylchlorid<br />
-Cl<br />
-H<br />
Tritylalkohol<br />
10 min Rückfluß (95%)<br />
b) Ethersynthese (Williamson) aus Alkoholen und Phenolen<br />
R-O + R'-X R-O-R' + X -<br />
OH<br />
KOH<br />
- H 2 O<br />
O H 3 C O<br />
O<br />
S O CH 3<br />
O<br />
K<br />
S N 2<br />
OMe<br />
Methyl-ß-naphthylether<br />
+<br />
KO<br />
O<br />
S<br />
O<br />
O CH 3<br />
CH 3 -Br<br />
O<br />
O-Me<br />
Br + MeO<br />
S N 2<br />
K + S N 2<br />
Na +<br />
tert.-Butylmethylether<br />
E2<br />
(-HBr)
c) Estersynthese durch Alkylierung von Carboxylaten<br />
COOH<br />
COOK CH<br />
K 2 CO 3 -I<br />
3 Aceton<br />
COOMe<br />
HO<br />
COO<br />
Cs +<br />
Br<br />
HO<br />
O<br />
O<br />
O<br />
O<br />
- KI<br />
O<br />
DMF<br />
d) Alkylierung von Aminen<br />
R-X + NH 3 R-NH 3 X R-NH 2 R-NH-R<br />
NR 3<br />
- HX - HX<br />
+ HX<br />
+ HX + HX<br />
R-X<br />
R-X<br />
R-X<br />
Hauptprodukt<br />
NR 4 X<br />
Problem: Überreaktion,<br />
da Produkte nukleophiler als Edukt<br />
Monoalkylamine: Gabriel Synthese<br />
Phthalimid: pK S 9<br />
O<br />
N-H<br />
O<br />
KOH<br />
- H 2 O<br />
O<br />
N<br />
O<br />
K +<br />
Bu-OTs<br />
O<br />
N<br />
O<br />
H + (OH - )<br />
(Hydrazin)<br />
Bu NH 2 Bu<br />
Dialkylamine aus Derivaten von Monoalkylaminen: z.B. Sulfonamiden pK S 10<br />
O<br />
S<br />
O<br />
H<br />
N Me<br />
KOH<br />
-HOH<br />
O<br />
S<br />
O<br />
N Me<br />
K +<br />
Et<br />
- KI<br />
I<br />
O<br />
S<br />
O<br />
N<br />
Et<br />
Me<br />
H 2 O (H + )<br />
O<br />
S<br />
O<br />
OH<br />
+<br />
HN<br />
Et<br />
Me<br />
Ethyldicyclohexylamin:<br />
H<br />
N<br />
OSO 3 Et<br />
- HOSO 3 Et<br />
N<br />
94%<br />
Aminosäuren:<br />
O<br />
OH<br />
Br<br />
NH 3 in H 2 O<br />
NH 2<br />
O<br />
OH Alanin<br />
(rac.)<br />
Aromatische Amine durch Reduktion von Nitroverbindungen<br />
Amine auch durch Reduktion von: Amiden, Iminen, Nitrilen
e) Alkylierung von Phosphorverbindungen<br />
1.Phosphoniumsalze<br />
R'-X + PR 3<br />
R'-PR 3 X<br />
P<br />
Br<br />
ΔT<br />
Toluol<br />
P<br />
H<br />
Br<br />
Bu-Li<br />
P<br />
+ LiBr<br />
+ Bu-H<br />
2. Michaelis-Arbuzov-Reaktion P(<strong>II</strong>I) P(V)<br />
Isopropyltriphenylphosphoniumbromid<br />
(P-Ylid für Wittig-Rkt.)<br />
Br<br />
150°C<br />
S N 2<br />
OEt<br />
P<br />
O<br />
OEt<br />
+ Et-Br<br />
OEt<br />
150°C<br />
P(OEt) 3 P OEt<br />
S N 2<br />
Triethylphosphit<br />
O<br />
(Phosphorigsäuretriethylester)<br />
Br<br />
Benzylphosphonsäurediethylester<br />
f) Alkylierung von Schwefelverbindungen<br />
HS + R-X<br />
R-SH + X<br />
Thiol<br />
(Mercaptan)<br />
Base<br />
- HX<br />
R-S<br />
Thiolat<br />
R'<br />
R-X<br />
R'-X<br />
X<br />
R-S-R<br />
S<br />
-X - R R<br />
Sulfid (sym.) Sulfoniumsalz<br />
Thiole durch Alkylierung von Thioharnstoff:<br />
Br-Bu<br />
S<br />
NH 2<br />
NH 2<br />
Bu<br />
S<br />
NH 2<br />
NH 2<br />
X<br />
H 2 O, OH<br />
HO<br />
NH 2<br />
Bu SH + CO 2<br />
+ 2 NH 3<br />
Butanthiol + HX<br />
Thioharnstoff<br />
S-Alkyl-thiuroniumsalz<br />
(Kohlensäurederivat)<br />
Bu-S<br />
NH 2
Disulfidbildung von Thiolen:<br />
O 2<br />
(rad.)<br />
Disulfidaustausch:<br />
Pr-SH + Et-S-S-Et<br />
Base<br />
2 Et-SH Et-S-S-Et + H 2 O + 0.5 O 2<br />
Mech.:<br />
Pr-S-S-Et + Et-SH<br />
Pr-S<br />
Et<br />
S<br />
S<br />
Et<br />
Pr<br />
S<br />
S<br />
S<br />
Et<br />
Et<br />
Sulfoniumverbindungen in der Natur:<br />
Diethyldisulfid<br />
(elektrophil)<br />
H 2 N<br />
H 3 C<br />
COOH<br />
S<br />
O<br />
N<br />
N<br />
NH 2<br />
N<br />
N<br />
H 2 N<br />
3 x SAM<br />
O<br />
P<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
R<br />
R<br />
Phosphatidylethanolamin<br />
O O - O<br />
OH OH<br />
S-Adenosylmethionin (SAM)<br />
N<br />
O P O<br />
O O -<br />
O<br />
O<br />
R<br />
R<br />
Phosphatidylcholin<br />
g) Finkelstein-Reaktion<br />
Hal' + R-OTs<br />
R-Hal' +<br />
(R-Hal)<br />
OTs<br />
(Hal)<br />
Iodide:<br />
Br<br />
KI-Aceton<br />
I<br />
+ KBr<br />
KI in Aceton löslich<br />
KBr, KCl unlöslich<br />
Fluoride:<br />
OTs<br />
K F<br />
DMF<br />
F<br />
+ K-OTs Rückreaktion sehr langsam
3.2.10 Konkurrenz von S N 1 u. S N 2 Reaktionen<br />
S N 2 nur bei starken Nukleophilen u. hoher Konzentration (bimolekular) möglich<br />
H<br />
CH 3<br />
MeO konz.<br />
H<br />
CH 3<br />
Et<br />
NH 3<br />
Et<br />
Cl<br />
H<br />
-Cl<br />
H<br />
OMe<br />
H 3 C<br />
H<br />
Br<br />
-HBr<br />
H 2 N<br />
H 3 C<br />
H<br />
S N 1 bevorzugt bei schwachen oder niedrig konzentrierten Nukleophilen<br />
(S N 1 wird nicht beschleunigt aber S N 2 wird verlangsamt)<br />
H 3 C<br />
Et<br />
H<br />
Br<br />
Et<br />
MeOH<br />
MeOH<br />
-Br H 3 C H -H<br />
H<br />
MeO<br />
Et<br />
R<br />
CH 3<br />
+<br />
H 3 C<br />
S<br />
Et<br />
H<br />
OMe<br />
CH 3<br />
H<br />
MeOH<br />
CH 3<br />
H<br />
CH 3<br />
MeOH<br />
OMe<br />
CH 3<br />
H<br />
Cl<br />
-Cl<br />
H<br />
tert. Carbeniumion<br />
-H +
3.2.11 S N -Reaktionen an substituierten Silanen<br />
a) Bildung von Silylethern (S N 2-Si)<br />
Et 3 N (-H )<br />
CH 3<br />
H 3 C<br />
CH 3<br />
CH 3<br />
BuOH<br />
BuO<br />
H 3 C<br />
Si Cl<br />
CH 3<br />
BuO Si Cl<br />
BuO Si CH 3<br />
-Cl<br />
CH 3<br />
CH 3<br />
b) Desilylierung (Abspaltung) mit F<br />
Butyltrimethylsilylether<br />
(Bu-OTMS)<br />
CH 3<br />
H 3 C CH 3<br />
F (Bu 4 NF)<br />
BuO Si CH 3<br />
BuO Si F<br />
BuO +<br />
H 3 C<br />
CH 3<br />
Si<br />
F<br />
CH 3<br />
CH 3<br />
CH 3<br />
TMS-CN + TMS-N 3 Ersatz für HCN u. HN 3<br />
3.2.12 Reaktionen mit Epoxiden<br />
O<br />
n<br />
H<br />
OMe<br />
MeO-CH 2 -CH 2 -O<br />
MeO-(CH 2 -CH 2 -O) n -CH 2 -CH 2 -OH<br />
O<br />
Polyethylenglycolmonomethylether<br />
O<br />
2<br />
CH 2 -CH 2 -OH<br />
HO-CH 2 -CH 2 -NH 2 HO-CH 2 -CH 2 -N<br />
NH 3 CH 2 -CH 2 -OH<br />
Ethanolamin<br />
Triethanolamin
4. Eliminierungen unter Bildung von C-C-Mehrfachbindungen<br />
a) α,β(1,2)-Eliminierungen<br />
H-Abstraktion in der Peripherie (Umkehrung der Addition an Doppelbindung)<br />
B H C C X<br />
H-B + C C + X<br />
Base<br />
b) α,α(1,1)-Eliminierungen<br />
X<br />
C Y C<br />
+ X-Y<br />
4.1. Mechanismen<br />
Carben<br />
(Elektronensextett)<br />
a) monomolekulare Eliminierung E1<br />
Beisp: Solvolyse von tert. Alkylhalogeniden<br />
EtOH<br />
E1<br />
E<br />
S N<br />
H 3 C<br />
CH 3<br />
CH 3<br />
Br<br />
-Br<br />
(langsam)<br />
H 3 C<br />
H<br />
CH 3<br />
HO-Et<br />
S N 1<br />
-H<br />
+<br />
H 3 C<br />
CH 3<br />
CH 3<br />
O-Et<br />
25°C: 19% + 81%<br />
55°C: 28% + 72%
E1 begünstigt durch:<br />
a) Verzweigung am Carbeniumion (Stabilisierung)<br />
b) hohe Austrittstendenz von X: F
Präparative Verschiebung zu E2: konzentrierte, starke, voluminöse, Base in dip. aprot LM<br />
Et<br />
Beisp:<br />
H<br />
N<br />
+<br />
Et<br />
N<br />
Br<br />
Br<br />
1-Octen<br />
H<br />
keine S N 2-Rkt.<br />
(Quaternisierung am N ungünstig)<br />
c) monomolekulare Eliminierung E1cB (E1conjugierte Base): zuerst Bildung eines stabilisierten Anions<br />
B<br />
Base<br />
R<br />
H C C<br />
H<br />
X<br />
vorgelagertes<br />
Gleichgewicht<br />
B-H +<br />
R<br />
C<br />
H<br />
C<br />
X<br />
B-H +<br />
R<br />
H<br />
+<br />
X<br />
konjugierte Base<br />
(Anion meist stabilisiert)<br />
Beisp: Basische Dehydratisierung von Aldolprodukten<br />
Base<br />
OH<br />
O<br />
HO<br />
OH<br />
O<br />
OH<br />
O<br />
-HO<br />
O<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
konjugierte Base<br />
(mesomeriestab. Enolat)
4.2. Regioselektivität der Eliminierung:<br />
bei sek. und tert. Ausgangsverbindungen mehrere Möglichkeiten der Eliminierung<br />
H 2 SO 4 (15%)<br />
+ H + , - H 2 O<br />
H<br />
Base<br />
-H<br />
12.5 % Hofmann Produkt<br />
Rkt. am leichter zugängl. H-Atom<br />
bei E2, E1cB bevorzugt<br />
OH<br />
E1<br />
H<br />
87.5 % Zaitsev Produkt<br />
-H<br />
meist thermodyn. stabiler<br />
bei E1 bevorzugt<br />
Regioselektivität abhängig von der Austrittsgruppe (Änderung des Mechanismus):<br />
(E1; Abspaltungstendenz<br />
%-Zaitsev Produkt)<br />
N 2 > I - > Br - > Cl - > OTs - > R 2 S > F - > R 3 N<br />
(E2; E1cB<br />
%-Hofmann Produkt)<br />
Beisp:<br />
X<br />
KOEt<br />
EtOH<br />
-H-X<br />
Zait.<br />
+<br />
Hofm.<br />
X =<br />
% Hofm.<br />
I<br />
20<br />
Br<br />
25<br />
Cl<br />
36<br />
F<br />
83<br />
Hofmann- Eliminierung außerdem begünstigt bei:<br />
a) sterisch gehinderter Base<br />
OK > Et OK<br />
b) sterisch gehindertem Substrat<br />
H 2 O (-H )<br />
+<br />
20 % Zait. 80 % Hofm.
4.3. Konkurrenz zwischen S N 2 und E2<br />
prim. Halogenid:<br />
Br<br />
S N 2<br />
EtO<br />
Eliminierung<br />
Substitution<br />
1% OEt 99%<br />
H<br />
E2<br />
Br<br />
EtO<br />
10% OEt 90%<br />
Br<br />
EtO<br />
62% OEt 38%<br />
tBuO<br />
92% OtBu 8%<br />
sek. Halogenid:<br />
Br<br />
EtO<br />
55% OEt 45%<br />
Br<br />
EtO<br />
OEt<br />
18%<br />
82%
4.4. Stereochemie von Eliminierungen<br />
anti-Eliminierung:<br />
bei E2 bevorzugt<br />
(gestaffelte Konformation)<br />
EtO<br />
H<br />
H<br />
NaOEt<br />
EtOH 75°C<br />
H 3 C<br />
Br<br />
H 3 C<br />
H<br />
(Z)-α-Methylstilben<br />
syn-Eliminierung ungünstig wg.:<br />
a) ekliptischer Konformation<br />
b) WW-Base-Austrittsgruppe<br />
c) ÜZ<br />
EtO<br />
H 3 C<br />
H<br />
Br<br />
H<br />
nicht<br />
beobachtet<br />
H 3 C<br />
H<br />
(E)-α-Methylstilben<br />
Cl<br />
E2<br />
EtO<br />
H<br />
H<br />
- HCl<br />
75% 25%<br />
Neomenthylchlorid<br />
H<br />
OTs<br />
H<br />
H<br />
OTs<br />
H<br />
E2<br />
EtO<br />
- HOTs<br />
H<br />
Menthyltosylat
E1 nicht stereospezifisch.<br />
Ausnahme: E1cB von Olefinen (anti-Elim.)<br />
H<br />
Cl<br />
OH<br />
H<br />
Cl<br />
OH<br />
Cl<br />
H<br />
Cl<br />
H<br />
langsam<br />
Cl<br />
schnell<br />
Cl<br />
H<br />
Cl<br />
H<br />
Thermische syn-Eliminierungen: z.B. von Acetaten<br />
Ph<br />
Ph<br />
H CH 3<br />
H CH 3<br />
H OAc<br />
Ph<br />
H CH 3<br />
H OAc<br />
Ph<br />
H<br />
Ph<br />
Ph<br />
OAc<br />
O<br />
O<br />
H 3 C<br />
H<br />
H 3 C<br />
CH 3<br />
H<br />
H<br />
O<br />
O<br />
H<br />
400°C<br />
H<br />
anti Konformation<br />
syn Konformation<br />
O<br />
OH<br />
+<br />
Syn Eliminierung von N-Oxiden (Cope-Eliminierung)<br />
R<br />
H<br />
- O<br />
NMe 2<br />
ΔT<br />
R<br />
H<br />
H<br />
O<br />
H<br />
H<br />
NMe 2
4.5. Saure Eliminierungen von Alkoholen und Ethern<br />
a) saure Dehydratisierung von Alkoholen:<br />
bei prim. Alkoholen sehr hohe Reaktionstemp. (200°C) notw. sonst bevorzugt Etherbildung (S N 2)<br />
OH<br />
E1<br />
160°C<br />
H 3 PO 4<br />
(50%)<br />
- H 2 O<br />
(Kp 83°C)<br />
E1<br />
E1<br />
(Kp 37°C)<br />
OH<br />
OH<br />
160°C<br />
100°C<br />
H 3 PO O<br />
4<br />
H 3 PO 4<br />
O<br />
(50%)<br />
(5%)<br />
(70%) (80%)<br />
(80%)<br />
- H 2 O<br />
- H 2 O<br />
Acetaldol<br />
Crotonaldehyd<br />
b) saure Eliminierung von Alkoholen aus Acetalen<br />
OMe<br />
+H<br />
H 3 PO 4<br />
(0.5%)<br />
H<br />
O<br />
Me<br />
-MeOH<br />
OMe<br />
-H<br />
OMe<br />
OMe<br />
Phenylacetaldehyddimethylacetal<br />
OMe<br />
mesomeriestab.<br />
Oxocarbeniumion<br />
OMe<br />
β-Methoxystyrol<br />
(Enolether)<br />
4.6. Dehydrohalogenierungen<br />
Et<br />
Beisp:<br />
H<br />
N<br />
Br<br />
180°C<br />
-HBr<br />
1-Hexen<br />
(Kp 63°C)
a) Elektronenziehender Substituent<br />
an C-H-Bindung erhöht<br />
Acidität + Abspaltungstendenz<br />
O<br />
Me 2 N<br />
- H<br />
O<br />
E1cB<br />
- Cl - C O<br />
O<br />
Cl<br />
Cl<br />
H<br />
Methylvinylketon<br />
H<br />
O<br />
NEt 3 (0°C),<br />
- H<br />
O<br />
E1cB<br />
- Cl -<br />
b) Alkine aus Dihalogeniden<br />
vicinal<br />
geminal<br />
4.7. Hofmann-Abbau (E2)<br />
H<br />
X<br />
H<br />
H<br />
H<br />
X<br />
X<br />
X<br />
Cl<br />
Propionylchlorid<br />
E2<br />
H<br />
E1cB<br />
NaNH 2 , NH 3<br />
C C<br />
Br<br />
1,2-Dibromhexan<br />
- HX X - HX<br />
Br<br />
NaOH-Triglycol<br />
200°C<br />
-2 HBr<br />
Cl<br />
Hex-1-in<br />
Methylketen<br />
(Keten der Propionsäure)<br />
(60 %)<br />
3 Me-I<br />
Δ<br />
NH 2<br />
1.5 Ag 2 O<br />
-3 AgI<br />
- H 2 O<br />
HO<br />
N<br />
95%<br />
Hofmann Prod.<br />
(NR 3 schlechte Austrittsgruppe)<br />
5%<br />
Zaitsev<br />
+ H 2 O + Me 3 N
4.8. Thermische syn-Eliminierungen<br />
a) Chugaev<br />
R<br />
OH<br />
OH<br />
- H 2 O<br />
R<br />
O<br />
S<br />
C<br />
S<br />
R<br />
O<br />
C<br />
S<br />
S<br />
Me-I<br />
S N 2<br />
R<br />
O<br />
C<br />
S-Me<br />
S<br />
Dithiokohlensäure-O,S-dialkylester<br />
(Xanthogenat, stabil)<br />
200°C<br />
R<br />
O<br />
H<br />
S<br />
S-Me<br />
R<br />
O<br />
H<br />
S<br />
S-Me<br />
COS + MeSH<br />
Dithiokohlensäuremethylester<br />
(labil)<br />
OH<br />
Menthol<br />
1. KOH, CS 2<br />
2. Me-I<br />
H<br />
O<br />
S<br />
H<br />
S-Me<br />
H<br />
200°C<br />
+<br />
66% 34%<br />
b) weitere syn-Eliminierungen:<br />
Leichtigkeit der Eliminierung<br />
O<br />
Se<br />
O<br />
H<br />
20°C<br />
Ph<br />
N +<br />
O<br />
O<br />
O<br />
SMe<br />
OMe<br />
Me<br />
> O - > S > S ><br />
H<br />
H<br />
H<br />
H<br />
O<br />
Aminoxid (Cope-Elim.)<br />
80° 120-200° 400° (Pyrolyse)
O<br />
O<br />
O<br />
400°C<br />
OH<br />
Pyridin<br />
-AcOH<br />
H<br />
O<br />
O<br />
O<br />
O-H<br />
c) syn-Decarboxylierungen von ß-Ketosäuren: ("Malonestersynthesen + Acetessigestersynthesen")<br />
H<br />
H<br />
COOEt<br />
COOEt<br />
Malonsäurediethylester<br />
1. NaOEt, R-X, S N 2<br />
(Alkylierung des<br />
Na-Enolats)<br />
2. OH - , H 2 O<br />
(Basische<br />
Esterhydrolyse)<br />
R<br />
H<br />
COOH<br />
COOH<br />
subst.<br />
Malonsäure<br />
R H<br />
O<br />
OH<br />
O O<br />
H<br />
ß-Ketosäure<br />
Δ<br />
-CO 2<br />
R<br />
H OH<br />
OH<br />
Enoltautomer<br />
R<br />
O<br />
OH<br />
subst.<br />
Essigsäure<br />
H<br />
H<br />
COOEt<br />
O<br />
1. NaOEt, R-X<br />
2.. OH - , H 2 O<br />
O<br />
R<br />
O<br />
H<br />
O<br />
Δ<br />
-CO 2<br />
R<br />
OH<br />
R<br />
O<br />
Acetessigsäureethylester<br />
ß-Ketosäure<br />
Enoltautomer<br />
subst. Keton<br />
COOH<br />
COOH<br />
Δ<br />
-CO 2<br />
H 3 C<br />
COOH<br />
Cl<br />
O<br />
OH<br />
Na NO 2<br />
Δ<br />
- O<br />
N +<br />
O O<br />
S N 2 -CO 2<br />
H O<br />
analog ß-Ketosäure<br />
- O<br />
HO<br />
N +<br />
- O<br />
N +<br />
O<br />
Nitromethan
4.9. α,α-Eliminierung:<br />
Carbene u. Nitrene<br />
1.) Darstellung<br />
Cl<br />
Cl<br />
C<br />
H<br />
Cl<br />
RO<br />
Cl<br />
Cl<br />
C<br />
Cl<br />
- Cl<br />
Cl<br />
Cl<br />
C<br />
Dichlorcarben:<br />
elektrophil<br />
reaktiv<br />
kurzlebig (< 1s)<br />
H<br />
C N N<br />
H<br />
Diazomethan<br />
ΔT, hν<br />
H<br />
C + N 2<br />
H<br />
Carben (Methylen)<br />
R<br />
N N N<br />
Azid<br />
ΔT, hν<br />
N R + N 2<br />
Nitren<br />
2.) Struktur<br />
103°<br />
H<br />
H<br />
C<br />
Singlettcarben<br />
136°<br />
H<br />
H<br />
C<br />
Triplettcarben (Diradikal)<br />
3.) Reaktionen a) Insertion in C-H-Bindungen<br />
OEt<br />
CH 2<br />
H-CH 2<br />
H-CH 2<br />
OEt<br />
+<br />
OEt<br />
b) Addition an Doppelbindungen<br />
CH 2<br />
CH 2<br />
c) Radikalische Abstraktion bei Triplett-Carbenen<br />
CH 2 H 3 C CH 3 CH 3 + H 2 C CH 3<br />
d) Umlagerungen<br />
z.B. Wolff-Umlagerung<br />
v. Diazoketonen<br />
R<br />
O<br />
N<br />
N<br />
O<br />
hν<br />
~ R<br />
R CH<br />
-N 2 Acylcarben<br />
R<br />
H<br />
C<br />
Keten<br />
O<br />
Zn-Cu<br />
4. Carbenoide CH 2 I 2 I CH 2 ZnI<br />
H 2 C + ZnI 2<br />
Simmons-Smith-Rkt.
5. Additionen an Doppel- u. Dreifachbindungen<br />
5.1. Mechanismus der elektrophilen Addition: Zweistufenmechanismus<br />
C<br />
C<br />
1. Schritt 2. Schritt<br />
H Cl H C<br />
Cl<br />
C<br />
H<br />
C<br />
C<br />
Cl<br />
HOH<br />
(Lösungsmittel)<br />
ROH<br />
(LM)<br />
Br<br />
H<br />
C<br />
C<br />
OH<br />
H<br />
C<br />
C<br />
OR<br />
H<br />
C<br />
C<br />
Br<br />
Beweis des Zweistufenmechanismus<br />
durch Konkurrenzexperimente<br />
(Gegenwart von 2. Nukleophil)<br />
Elektrophile für Addition an Doppelbindungen : H-Hal, H 2 SO 4 , HNO 3 , H 3 O + , Hal 2 , Interhalogene, H-O-Hal<br />
Reaktivitätszunahme mit Elektrophilie (Acidität):<br />
H-F
5.2. Additionsrichtung u. sterischer Verlauf der elektrophilen Addition (Ad E )<br />
Nu<br />
Nu<br />
Nu<br />
El<br />
Nu<br />
El<br />
El<br />
H<br />
B<br />
Grenzfälle:<br />
a) klassisches Carbeniumion<br />
b) unsymmetrisch verbrücktes<br />
Carbeniumion<br />
c) symmetrisch verbrücktes<br />
Carbeniumion<br />
d) Vierzentren-ÜZ<br />
(Hydroborierung)<br />
Stereoselelektivität: keine<br />
(bei stab. Kation)<br />
Stereoselelektivität: anti<br />
Regioselektivität: +<br />
Stereoselelektivität: anti<br />
Regioselektivität: -<br />
Stereoselelektivität: syn<br />
R<br />
Regioselektivität bei Ad E :<br />
Markovnikov-Addition wg. stabilerem Carbeniumion<br />
X<br />
H<br />
OH<br />
H<br />
Cl<br />
I<br />
OH<br />
Hal<br />
H<br />
B<br />
5.3. Stereochemie der Halogenaddition<br />
(H + ) (H + ) (I + ) (Hal + )<br />
Br<br />
Br<br />
Br<br />
R<br />
R<br />
Br<br />
Fähigkeit zur Verbrückung<br />
steigt mit Polarisierbarkeit:<br />
H + < F + < Cl + < Br + < I +<br />
Br<br />
Br<br />
S N 2<br />
R<br />
Br<br />
analog<br />
S N 1<br />
syn + anti Addition<br />
H überbrückt nicht (Carbeniumion)<br />
Br<br />
anti-Addition bei Aliphaten<br />
nur bei besonders stab. Carbeniumion<br />
z. B. bei R = Phenyl
Beispiele für anti-selektive Halogenaddition:<br />
H<br />
H COOH<br />
Br (Br 2 )<br />
COOH<br />
H<br />
Maleinsäure<br />
H<br />
Br<br />
COOH<br />
COOH<br />
Br<br />
H<br />
H<br />
Br<br />
R<br />
R COOH<br />
Br<br />
Br H H S<br />
COOH<br />
+ COOH<br />
COOH S<br />
2 Br<br />
Br<br />
H<br />
COOH<br />
H<br />
Br<br />
+<br />
H<br />
Br<br />
COOH<br />
Br<br />
H<br />
COOH COOH<br />
D+L-Dibrombernsteinsäure<br />
HOOC<br />
H<br />
H<br />
Fumarsäure<br />
COOH<br />
Br (Br 2 )<br />
HOOC<br />
H<br />
Br<br />
H<br />
COOH<br />
Br<br />
HOOC<br />
H<br />
Br<br />
S<br />
R<br />
Br<br />
H<br />
COOH<br />
R<br />
Br<br />
Br<br />
S<br />
COOH<br />
H<br />
H<br />
COOH<br />
meso-Dibrombernsteinsäure<br />
Br 2<br />
Br<br />
Br<br />
Br<br />
Cyclohexen<br />
H<br />
H<br />
H<br />
Br<br />
H<br />
Br<br />
Br<br />
Br<br />
S<br />
S<br />
Br<br />
+<br />
Br<br />
R<br />
R<br />
Br<br />
Definition: Fischer-Projektion<br />
D-Glucose vs. L-Glucose<br />
Racemat der beiden Diasteromeren
5.4. Addition von Protonensäuren u. Wasser an Olefine u. Acetylene<br />
H OH 2<br />
(H 2 SO 4 verd.)<br />
OH<br />
+ H<br />
Nebenreaktionen: Umlagerung u. Doppelbindungsverschiebung<br />
Isomere<br />
H-Br<br />
I<br />
H<br />
Br<br />
<strong>II</strong><br />
Br<br />
(55%) (45%)<br />
Br + Br<br />
+ H - H<br />
+ H<br />
Dodec-1-en<br />
( konz. H 2 SO 4 )<br />
- 10°C<br />
OSO 3 H<br />
(alle isomeren Dodecylsulfate)<br />
Hydratisierung von Acetylenen nur in Gegenwart von Kat. (Hg 2+ )<br />
+ H 2 O<br />
(H 2 SO 4 ), HgSO 4 OH +H , -Hg ++ OH +H , -H<br />
- H<br />
Hg<br />
H<br />
OH<br />
Enol H<br />
H<br />
Keton<br />
O
5.5. Addition von Halogen (Cl 2 , Br 2 )<br />
Br<br />
Br<br />
H 3 C<br />
H<br />
H<br />
Br<br />
CH 3<br />
CH 3<br />
AcOH<br />
Br<br />
H 3 C<br />
H<br />
+<br />
S S R R<br />
Br<br />
Br<br />
H<br />
nur anti-Addition<br />
Br 2<br />
AcOH<br />
Br 2<br />
Br 2<br />
Bei Phenylsubstituent an der Doppelbindung: syn+anti-Addition<br />
H<br />
Br<br />
H<br />
Br<br />
Br<br />
H<br />
Br<br />
Br Me<br />
H<br />
Br Br<br />
Ph + Ph Me<br />
H Br H H<br />
72 % anti 28 % syn<br />
+ Enantiomere<br />
Br<br />
Br<br />
Dreifachbindung weniger reaktiv<br />
geg. Elektrophil<br />
Br<br />
Br<br />
5.6. Alkohole durch Oxymercurierung<br />
weniger günstig<br />
Hg(OAc) 2<br />
-AcO<br />
AcOHg<br />
Mercuriniumion<br />
HOH<br />
AcOHg<br />
OH<br />
NaBH 4 , HO<br />
- Hg, - HOAc<br />
radikalisch<br />
HO<br />
R-Hg-X<br />
NaBH 4<br />
R-Hg-H<br />
R-Hg-H R + Hg-H<br />
1.Hg(OAc) 2 H 2 O<br />
2.NaBH 4 , HO<br />
OH<br />
(94%)<br />
ohne Umlagerung<br />
R<br />
+ H-Hg-R<br />
R-H<br />
+ Hg 0 + R
5.7. Epoxidierung u. Hydroxylierungen<br />
COOOH<br />
H<br />
O<br />
O<br />
O R<br />
Persäure<br />
O<br />
H<br />
+<br />
O<br />
O<br />
R<br />
Cl<br />
MCPBA<br />
O<br />
1,2-Epoxycyclohexan<br />
OH<br />
OH<br />
- H<br />
H<br />
O<br />
HOH<br />
+ H<br />
O<br />
HO<br />
OH<br />
OH<br />
trans-Dihydroxylierung durch<br />
saure oder basische Öffnung<br />
von Epoxiden<br />
Regioselektivität bei Epoxidöffnungen<br />
H<br />
OH<br />
O<br />
MeOH<br />
H 2 SO 4 verd.<br />
O<br />
NaOEt<br />
HO<br />
(83%)<br />
MeO<br />
Me<br />
OH<br />
EtOH<br />
80°C<br />
OEt<br />
cis-Dihydroxylierungen (syn-Additionen)<br />
O V<strong>II</strong>IO<br />
Os<br />
O O<br />
O V<strong>II</strong><br />
O<br />
Mn<br />
O O<br />
O VI<br />
Os O<br />
O O<br />
O<br />
V<br />
Mn O<br />
O O<br />
O<br />
HO VI O<br />
- Os<br />
HO O<br />
H HO<br />
H<br />
HO<br />
-<br />
HO<br />
V<br />
O<br />
Mn<br />
HO O<br />
MnO 2<br />
OsO 4<br />
OH<br />
(MnO - 4 )<br />
H 2 O<br />
cis-Dihydroxylierung<br />
OH<br />
analog Esterhydrolyse
5.8. Spaltung von Doppelbindungen durch Ozonolyse<br />
[3+2] Cycloaddition<br />
(synchron)<br />
Cycloreversion<br />
[3+2] Cycloaddition<br />
H 2 O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
+<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
Ozon (1,3-Dipol)<br />
Primärozonid<br />
Carbonyloxid<br />
(1,3-Dipol)<br />
Sekundärozonid<br />
(Acetal)<br />
oxidative Aufarbeitung des Sekundärozonids:<br />
O 3<br />
O O<br />
reduktive Aufarbeitung mit PPh 3 oder MeSMe:<br />
O<br />
H 2 O, H<br />
O<br />
HO<br />
O<br />
OH<br />
O<br />
O<br />
OH<br />
Keton + H 2 O 2 : stabil<br />
Aldehyd + H 2 O 2 → Säure<br />
O<br />
O<br />
O<br />
S<br />
O<br />
O<br />
O<br />
S<br />
O<br />
O<br />
O<br />
S<br />
DMSO<br />
Ozonolyse in der Naturstoffaufklärung u. zur schonenden Erzeugung v. Aldehyden<br />
OH<br />
1. O 3<br />
OH<br />
2. P(Ph) 3<br />
OH+<br />
CH 2 O + O=PH(Ph) 3
5.9. Hydroborierungen<br />
syn-Addition (konzertiert), anti-Markovnikov<br />
Weiterreaktion + oxidative Aufarbeitung<br />
H<br />
B<br />
H<br />
H<br />
H<br />
B<br />
H<br />
H<br />
δ +<br />
H<br />
B<br />
δ -<br />
H<br />
H<br />
H BH 2<br />
O-OH<br />
H BH 2 H BH<br />
2<br />
H B<br />
3<br />
Trialkylboran<br />
H<br />
B<br />
3<br />
O<br />
- HO<br />
OH<br />
H<br />
B<br />
2<br />
O<br />
H<br />
+ 2 O-OH<br />
B<br />
O<br />
H<br />
3 H 2 O<br />
H 3 BO 3 + 3<br />
HO<br />
H<br />
- 2 HO<br />
3<br />
Borsäuretrialkylester<br />
Alkohol (Anti-Markovnikov)<br />
Beisp.:<br />
1. B 2 H 6<br />
(BH 3 -MeSMe)<br />
H<br />
B<br />
H<br />
B<br />
2. H 2 O 2 , HO<br />
H<br />
OH<br />
+<br />
H<br />
OH<br />
3<br />
syn-Addition (rac.)<br />
3<br />
anti-Markovnikov-Alkohol (rac.)<br />
H<br />
BH<br />
B 2<br />
2 H 6<br />
R * MeCOOH<br />
R * -H<br />
B<br />
(+)−α-Pinen Isopinocampheylboran<br />
R * R * MeCOOD R * -D<br />
= Ipc-BH 2 (chirales Boran)<br />
bei chiralem R Retention
5.10. Polymerisation von Olefinen<br />
a) kationisch (H + , BF 3 , AlCl 3 )<br />
Abbruch<br />
R<br />
H + n<br />
- H<br />
CH 2 CH 2 CH 2<br />
R +<br />
n<br />
b) anionisch<br />
Li<br />
+<br />
Li<br />
n<br />
∗<br />
∗<br />
n<br />
Li<br />
"lebendes<br />
Polymer"<br />
O 2 , H 2 O<br />
Abbruch<br />
c) radikalisch<br />
R<br />
R<br />
R<br />
n<br />
Abbruch<br />
5.11. Anionische Addition an Acetylene (Vinylierungen)<br />
HC CH +<br />
O-Et<br />
150°C<br />
H<br />
H<br />
OR<br />
H-OEt<br />
- EtO<br />
OEt<br />
Ethylvinylether<br />
analoge Vinylierung von:<br />
RCOOH, Ar-OH, R-SH, R 2 NH<br />
COOH<br />
+ kat. (R-COO) 2 Zn<br />
HC<br />
150°C<br />
CH<br />
O<br />
O<br />
Caprylsäurevinylester
5.12. Cycloadditionen (Synthese von Carbo- und Heterocyclen)<br />
2+1<br />
2+2<br />
2+3<br />
2+4<br />
O<br />
O<br />
X<br />
X<br />
O<br />
O<br />
O<br />
O<br />
X = Carben, Nitren<br />
meist photochemisch<br />
1,3-dipolare Cycloaddition<br />
Diels-Alder-Reaktion<br />
1,3-Dipole:<br />
Diazoalkane<br />
Azide<br />
Nitrone etc.<br />
5. 13. Grenzorbitale bei Cycloadditionen<br />
2+1 CA<br />
LUMO<br />
antibindend<br />
HOMO<br />
bindend<br />
Ψ 2<br />
∗<br />
Ψ 1<br />
Ethylen π-MOs<br />
hν<br />
Ψ 2<br />
∗<br />
Ψ 1<br />
HOMO<br />
LUMO<br />
HOMO<br />
H<br />
H<br />
H<br />
HOMO<br />
H<br />
LUMO<br />
thermische Besetzung<br />
photochemische Besetzung<br />
(nach Anregung)<br />
thermisch erlaubt
2+2 CA<br />
2+3 CA<br />
a<br />
LUMO<br />
HOMO<br />
s<br />
thermisch<br />
verboten:<br />
außer bei<br />
suprafacialantarafacial<br />
s<br />
s<br />
aber:<br />
photochemisch<br />
erlaubt:<br />
suprafacialsuprafacial<br />
LUMO<br />
HOMO<br />
eines<br />
photochemisch<br />
angeregten<br />
Olefins<br />
LUMO<br />
HOMO<br />
Ψ 3<br />
Ψ 2<br />
Ψ 1<br />
LUMO<br />
HOMO<br />
s<br />
s<br />
s<br />
s<br />
thermisch erlaubt<br />
suprafacialsuprafacial<br />
HOMO<br />
LUMO<br />
MOs 1,3-Dipol<br />
2+4 CA<br />
Ψ 4<br />
∗<br />
LUMO<br />
Ψ 3<br />
∗<br />
Ψ 2<br />
HOMO<br />
s<br />
Ψ 3<br />
∗<br />
LUMO<br />
HOMO<br />
Ψ 2<br />
LUMO<br />
s<br />
HOMO<br />
Butadien π-MOs<br />
Ψ 1<br />
thermisch erlaubt<br />
suprafacialsuprafacial
a) [2+1] Cycloadditionen Cl<br />
Cl Cl Cl<br />
C<br />
trans-2-Buten<br />
trans-Cyclopropan<br />
b) [2+2] Cycloadditionen<br />
thermisch<br />
Keten<br />
C<br />
O<br />
C<br />
O<br />
C O<br />
C O<br />
Diketen<br />
H 2 C C O<br />
s<br />
HOMO<br />
(C=O)<br />
O<br />
photochemisch<br />
NC<br />
CN<br />
hν<br />
NC<br />
CN<br />
+<br />
NC<br />
CN<br />
H 2 C<br />
a<br />
C<br />
LUMO<br />
(Keten)<br />
Keten reagiert<br />
antarafacial<br />
c) 1,3-Dipolare Cycloadditionen [2+3]<br />
H 2 C<br />
+<br />
N<br />
N<br />
(Diazomethan)<br />
H 2 C<br />
H<br />
1<br />
N<br />
3<br />
N<br />
2<br />
COOMe<br />
+<br />
H 2 C<br />
H<br />
N<br />
N<br />
COOMe<br />
H<br />
trans (E)<br />
COOMe<br />
trans (E)<br />
Δ 1 -Pyrazolin<br />
cis (Z)<br />
< 0.003%
Azid<br />
+<br />
Alkin<br />
Ph<br />
EtOOC<br />
N<br />
ΔT<br />
N<br />
N N<br />
Ph<br />
N N<br />
+ N-Phenyltriazol<br />
COOEt<br />
EtOOC COOEt<br />
d) Diels-Alder-Reaktion [2+4] O<br />
O<br />
O<br />
+<br />
O<br />
O<br />
O<br />
cis-1,3-Dien<br />
elektronenreich<br />
Dienophil<br />
elektronenarm<br />
quasi-aromatischer<br />
Übergangszustand<br />
syn-Addition<br />
COOH<br />
COOH<br />
COOH<br />
HOOC<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
HOOC<br />
COOH<br />
Hetero Diels-Alder Reaktionen<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
CHO<br />
Dihydropyran
endo-Selektivität bei Diels-Alder Reaktionen (endo-Regel)<br />
Hauptprod<br />
H<br />
H<br />
endo<br />
ΔT<br />
Cycloreversion<br />
Destillation<br />
ohne Vakuum!<br />
Sekundäre Orbitalwechselwirkungen<br />
als Grund für die endo-Selektivität<br />
HOMO<br />
Nebenprod.<br />
exo<br />
LUMO<br />
H<br />
H<br />
Dicyclopentadien<br />
RT<br />
5. 14. Heterogene Hydrierung<br />
H 2 /Pd<br />
RT<br />
H 2 /Ni<br />
175°C<br />
180 bar<br />
Pr<br />
H 2 /Pd<br />
Octan<br />
O<br />
H 2 /Pt<br />
O<br />
Pr<br />
H 2 /Pd/BaSO 4<br />
Pr<br />
RT (EtOAc)<br />
(81%)<br />
Lindlar-Kat.<br />
H H<br />
cis-Addition
6. Aromaten<br />
Welche Eigenschaften haben Aromaten?<br />
• cycl. konjugierte Systeme<br />
• nahezu eben<br />
• (4n+2) π-Elektronen<br />
• Ringstromeffekt im NMR<br />
• erniedrigte Hydrierwärme<br />
• Ausgleich der Bindungslängen<br />
2 π 6 π 6 π 6 π<br />
C<br />
H<br />
6.1. Elektrophile aromatische Substitution S E Ar<br />
Mechanismus:<br />
1) Erzeugung des Elektrophils<br />
H O - H O -<br />
H O N + O + N +<br />
OH H O<br />
H 2 O +<br />
O<br />
N<br />
O<br />
Br Br + FeBr 3 Br Br FeBr 3<br />
2) Addition zum σ-Komplex<br />
X<br />
X<br />
H<br />
X<br />
H<br />
X<br />
H<br />
X<br />
H<br />
3) Eliminierung<br />
σ-Komplex<br />
Wheland-Komplex)<br />
X<br />
H<br />
B<br />
X<br />
+ H-B
4) Bei Einführung eines neuen Substituenten ist die Aktivierungsenergie zum σ-Komplex entscheidend<br />
5) a) Substituenten 1. Ordnung (aktivierend) dirigieren ortho/para<br />
b) Halogene (desaktivierend) dirigieren ortho/para<br />
c) Substituenten 2. Ordnung (desaktivierend) dirigieren meta
6.1.1. Nitrierung<br />
Br<br />
2 H 2 SO 4 konz.<br />
OH<br />
OH<br />
SO 3 H 3 HNO 3<br />
TNT<br />
Br Br Br<br />
NO<br />
O 2 N<br />
2<br />
3. sehr<br />
schwer<br />
NO 2<br />
NO 2<br />
(36%) (62%) (2%)<br />
HSO 3<br />
(SO 3 )<br />
6.1.2. Sulfonierung (reversibel)<br />
OH<br />
HNO 3<br />
Essigsäure<br />
NO 2<br />
NO 2<br />
1.Nitrierung<br />
leicht<br />
ΔT (H )<br />
Ar Ar-SO 3 H Ar-SO 3 H + H 2 O Ar + H 2 SO 4<br />
SO 3 H<br />
2. schwer<br />
NO 2 Reduktion<br />
NH 2<br />
Fe / HCl<br />
Anilide<br />
(Ar-NH-CO-R)<br />
Isocyanate<br />
(Ar-NCO)<br />
O 2 N<br />
R-COCl<br />
OH<br />
NHSO 3 H<br />
Cyclamat (Süssstoff)<br />
NO 2<br />
Anilin<br />
1. Ra-Ni-H 2<br />
200°C<br />
2.ClSO 3 H<br />
ipso-Substitution<br />
- 2 H 2 SO 4<br />
SO 3 H<br />
durch NO 2<br />
O 2 N<br />
SO 3 H<br />
NO 2<br />
Pikrinsäure<br />
aromat. Amine<br />
NH 3 HSO 4<br />
200°C<br />
(Backverfahren)<br />
HO 3 S<br />
Sulfanilsäure<br />
NH 2<br />
+ H 2 O<br />
Chlorsulfonierung (Sulfochloride destillierbar)<br />
ArH + ClSO 3 H<br />
ArSO 3 H + HCl<br />
Cl<br />
OH<br />
S O<br />
HO<br />
Cl<br />
H<br />
O -<br />
S O<br />
O<br />
O<br />
S<br />
OH<br />
ArSO 3 H + ClSO 3 H ArSO 2 Cl + H 2 SO 4<br />
O
6.1.3. Halogenierung (Cl 2 , Br 2 , I 2 , Hal + ) F nur als F + einsetzbar<br />
Cl Cl + FeCl 3<br />
Cl<br />
H<br />
+ FeCl 4 + HCl + FeCl 3<br />
Cl<br />
für Halogenierung von Alkylaromaten SSS KKK Regel (Kälte, Katalysator, Kern) sonst rad. Halogenierung der Seitenkette<br />
NO 2<br />
CH 3<br />
Br 2 ,Fe<br />
NO 2<br />
OH<br />
OH<br />
3 Br 2<br />
Br Br<br />
Br 2<br />
- HBr -3 HBr - HBr<br />
Br<br />
CH 3<br />
Br<br />
tBu<br />
Br<br />
tBu blockiert<br />
o-Substitution<br />
BrN<br />
O<br />
NBr<br />
bei unreaktiven Aromaten: Halogenierung mit Hal +<br />
H<br />
H<br />
2<br />
O<br />
O<br />
Br<br />
H<br />
O 2 N NO 2<br />
2 SO<br />
Br<br />
4<br />
BrN N<br />
BrN N<br />
2<br />
Br<br />
+<br />
HN<br />
O<br />
NH<br />
O N O<br />
H<br />
Dibromisocyanursäure<br />
(DIB)<br />
O<br />
N<br />
H<br />
O<br />
O<br />
N<br />
H<br />
O<br />
O 2 N NO 2<br />
O<br />
N<br />
H<br />
O<br />
6.1.4. Friedel-Crafts-Alkylierung (reversibel)<br />
R<br />
Cl<br />
AlCl 3<br />
H<br />
R<br />
+ AlCl 4 + HCl + AlCl 3<br />
R
Elektrophil für FC-Alkylierung erzeugbar aus:<br />
ROH, Olefin:<br />
R-OH + H-X<br />
R + H 2 O + X<br />
R-Hal:<br />
R<br />
+ H 2 SO 4<br />
R<br />
+ HSO 4<br />
Nebenreaktionen:<br />
a) Mehrfachalkylierungen (Produkt basischer) daher Überschuß Aromat<br />
b) Umalkylierungen u. Regioisomerisierungen<br />
15-facher<br />
Überschuss<br />
AlCl 3<br />
Cl<br />
- HCl<br />
(83%)<br />
MeCl, AlCl 3<br />
- HCl<br />
ΔT<br />
lange Reaktionszeit<br />
m-Substitution<br />
thermodyn. stabiler<br />
c) Umlagerung des Elektrophils<br />
Beisp:<br />
- HCl<br />
Cl<br />
AlCl 3<br />
(27%)<br />
Butylbenzol<br />
+<br />
(49%)<br />
sec-Butylbenzol<br />
3<br />
CCl 4<br />
AlCl 3<br />
- 3 HCl<br />
C Cl<br />
(75%)<br />
2<br />
CCl 4<br />
AlCl 3<br />
- 2 HCl<br />
Cl<br />
C<br />
Cl<br />
H 2 O<br />
O<br />
H 2 SO 4<br />
5-10°C<br />
(65%)<br />
(65%)<br />
6.1.5. S E -AR durch Carbonylverbindungen<br />
R<br />
C<br />
O<br />
X<br />
E<br />
R Cl + AlCl 3 R Cl AlCl 3 R + AlCl 4<br />
R C<br />
Reaktivitätsanstieg (Elektrophilie)<br />
O<br />
O<br />
O<br />
CO < 2<br />
R C < R C < R C<br />
NR 2 OAr R<br />
< R C<br />
O<br />
H<br />
< R C<br />
O<br />
O<br />
O<br />
R<br />
~<br />
O<br />
Cl
a) Friedel-Crafts-Acylierungen<br />
R<br />
C<br />
O<br />
Cl<br />
+ AlCl 3<br />
R<br />
C<br />
O<br />
Cl<br />
AlCl 3<br />
R C<br />
O<br />
Cl AlCl 3<br />
R C O AlCl 4<br />
I<br />
<strong>II</strong><br />
<strong>II</strong>I<br />
Komplexe I u. <strong>II</strong> sehr voluminös → p-Subst<br />
(R = Alkyl)<br />
bei Acyliumion o/p-Verhältnis geringer<br />
(R = Aryl)<br />
CH 3 COCl + AlCl 3<br />
O<br />
AlCl 3<br />
+ HCl<br />
H 2 O<br />
O<br />
+<br />
O<br />
Acetophenon<br />
1.2 % o-Subst<br />
NO 2<br />
O<br />
Cl<br />
Me<br />
O<br />
AlCl 3<br />
+ HCl<br />
H 2 O<br />
O<br />
+<br />
O<br />
O 2 N<br />
AlCl 3<br />
NO 2<br />
NO 2 NO 2<br />
NO 2 NO 2<br />
NO 2<br />
2,4-Dinitrobenzophenon<br />
45 % o-Subst<br />
O<br />
O<br />
O<br />
O<br />
AlCl 3<br />
H 2 SO 4<br />
O<br />
HO<br />
O<br />
-H 2 O<br />
O<br />
Anthrachinon
Bei Phenolen: Fries'sche Verschiebung nach O-Acylierung<br />
OH<br />
Cl<br />
O<br />
-HCl<br />
O<br />
O<br />
O<br />
O<br />
AlCl 3<br />
intermolekulare<br />
FC-Acylierung<br />
OH<br />
O<br />
O<br />
O<br />
OH<br />
O<br />
+<br />
O<br />
O<br />
b) Formylierungen (Gattermann-Synthesen)<br />
H C<br />
Ar-H F<br />
(keine Phenole)<br />
O<br />
(CO + HCl)<br />
AlCl 3<br />
Ar-CHO<br />
für Phenole u. Phenylether<br />
MeO<br />
H<br />
C<br />
H<br />
N H-Cl<br />
NH<br />
AlCl 3<br />
MeO<br />
NH 2<br />
H<br />
Cl<br />
H 2 O<br />
MeO<br />
O<br />
C<br />
H<br />
Cl<br />
Formimidchlorid<br />
c) Formylierungen nach Vilsmeier (nur für Phenole, Ether, Amine)<br />
O<br />
N<br />
O<br />
H<br />
(DMF)<br />
O<br />
P<br />
Cl Cl Cl<br />
N<br />
Cl<br />
O<br />
H<br />
O<br />
P<br />
Cl Cl<br />
-HCl<br />
N<br />
Cl<br />
H<br />
P<br />
O<br />
N<br />
Cl<br />
N<br />
H 2 O<br />
-HOPOCl 2<br />
H<br />
OH<br />
N<br />
N<br />
-HNMe 2<br />
H<br />
C<br />
N<br />
O
d) Reaktion mit Aldehyden u. Ketonen<br />
1. Hydroxymethylierung<br />
H<br />
u. Chlormethylierung O<br />
H<br />
H<br />
OH<br />
H<br />
Nu:<br />
OOC-R<br />
OOC-R<br />
Cl -<br />
Cl<br />
=<br />
Polystyrol quervernetzt<br />
mit Divinylbenzol<br />
Merrifield-Harz<br />
Peptidsynthese,<br />
kombinatorische Bibliotheken<br />
2. Triphenylmethane<br />
N<br />
H<br />
O<br />
ZnCl 2<br />
Me 2 N<br />
H<br />
OH<br />
ZnCl 2<br />
Me 2 N<br />
- HO - H<br />
N<br />
H<br />
Me 2 N NMe 2<br />
Me 2 N<br />
Me 2 N<br />
O<br />
N<br />
POCl 3<br />
-HCl<br />
Me 2 N<br />
Me 2 N<br />
OPOCl 2<br />
NMe 2<br />
1. HO<br />
2. HCl<br />
Me 2 N<br />
Me 2 N<br />
Cl<br />
NMe 2<br />
Me 2 N<br />
Me 2 N<br />
Cl<br />
N<br />
Kristallviolett (chinoides System)<br />
e) Carboxylierungen mit CO 2<br />
O Na O<br />
O<br />
Na<br />
O O<br />
O<br />
H O Na<br />
ONa<br />
COONa<br />
OH<br />
+<br />
Druck<br />
OH<br />
Na-Salicylat<br />
COONa<br />
+<br />
ONa<br />
wg. Chelatmechanismus: o-Subst (Salicylsäure) mit Na-Phenolat; p-Subst (p-Hydroxybenzoesäure) mit K-Phenolat
6.1.6. Mehrfachsubstituierte Aromaten<br />
a) 3-Bromanilin NO 2 NO 2 NH 2<br />
Br 2 , Fe HCl, Fe<br />
Br<br />
Br<br />
b) 3-Butylchlorbenzol<br />
O<br />
Cl 2 , Fe<br />
O<br />
H 2 , Pd, EtOH<br />
Cl<br />
Cl<br />
c) o-tButylnitrobenzol<br />
HNO 3 , H 2 SO 4<br />
NO 2<br />
NO 2<br />
NO 2<br />
30°C<br />
(16%) (11%) (73%)<br />
SO 3 , H 2 SO 4<br />
HNO 3 , H 2 SO 4<br />
SO 3 HNO 2<br />
H 2 O, Δ<br />
kat. H 2 SO 4<br />
NO 2<br />
SO 3 H<br />
d) o-Nitroanilin<br />
NH 2<br />
AcCl<br />
Pyridin<br />
HN<br />
O<br />
SO 3 , H 2 SO 4<br />
HN<br />
O<br />
HNO 3 , H 2 SO 4<br />
HN<br />
O<br />
NO 2<br />
1. H 2 O, Δ<br />
kat. H 2 SO 4<br />
2. OH<br />
NH 2<br />
NO2<br />
SO 3 H<br />
SO 3 H
e) 9-Bromanthracen<br />
O<br />
Br N<br />
NBS H Br<br />
O<br />
H Br<br />
Br<br />
O<br />
-H + HN<br />
O<br />
6.1.6. Nukleophile Substitution an desaktivierten Aromaten (S N Ar) (Nitroaromaten, Pyridine etc.)<br />
Additions-<br />
Eliminierungs-<br />
Mechanismus<br />
O 2 N<br />
Cl<br />
NO 2<br />
H 2 O, pH 7<br />
40°C<br />
- H +<br />
Meisenheimer-Komplex<br />
HO Cl<br />
O 2 N NO 2<br />
O 2 N<br />
OH<br />
NO 2<br />
N<br />
N<br />
O O O O<br />
NO 2<br />
Cl<br />
OH, pH 10<br />
100°C<br />
NO 2<br />
NO 2<br />
OH<br />
NO 2<br />
NO 2<br />
Cl OH, pH 14<br />
160°C<br />
NO 2<br />
OH<br />
NO 2<br />
Eliminierungs-<br />
Additions-<br />
Mechanismus<br />
Cl OH, pH 14 Cl<br />
OH<br />
350°C<br />
-Cl<br />
* H<br />
*<br />
*<br />
*<br />
O-H (1.)<br />
* * OH<br />
- H 2 O<br />
+ H (2.)<br />
Arin<br />
58% 42%
Ciprofloxazin (Ciprobay)<br />
Cl<br />
F<br />
Cl<br />
O<br />
HN<br />
COOEt<br />
NaH<br />
- H 2<br />
Cl<br />
Cl<br />
F<br />
F<br />
Cl<br />
O<br />
N<br />
O<br />
COOEt<br />
S N Ar<br />
O<br />
OEt<br />
Cl<br />
F<br />
Cl<br />
O<br />
N<br />
COOEt<br />
-Cl<br />
Cl<br />
F<br />
H<br />
N<br />
N<br />
H<br />
F<br />
O<br />
COOEt<br />
N<br />
S N Ar -HCl<br />
O<br />
COOEt<br />
Cl<br />
N<br />
HN<br />
N<br />
N<br />
6.1.7. Substitutionen mit metallierten Aromaten<br />
a) Darstellung von metallierten Aromaten<br />
1) Ar-X + Metall<br />
(Oxidative Addition)<br />
Br<br />
Mg 0<br />
Mg <strong>II</strong> -Br<br />
Bu-Li<br />
2) Halogen-Metallaustausch Br Li + Bu-Br<br />
3) direkte Metallierung<br />
u. ortho-Metallierung<br />
MDG<br />
Bu-Li<br />
MDG<br />
Li<br />
+ Bu-H<br />
4) Ar-X + Metallkomplex<br />
(Oxidative Addition)<br />
Br<br />
L<br />
Pd 0 L<br />
L<br />
L<br />
Pd <strong>II</strong> Br
) dirigierte ortho-Metallierung (DOM)<br />
H<br />
O<br />
H<br />
MDG = Metallierung<br />
Li O<br />
O<br />
Dirigierende<br />
NEt<br />
sec BuLi<br />
NEt 2<br />
Bu-Br<br />
NEt Gruppe<br />
2<br />
2<br />
-78°C<br />
H + Li<br />
OMe<br />
OMe<br />
1) n BuLi, 0°C<br />
OMe<br />
OMe<br />
2) n-Decylbromid<br />
OMe<br />
OMe<br />
Li<br />
O<br />
NEt 2<br />
1) sec BuLi, -78°C<br />
O<br />
NEt 2<br />
2) B(OMe) 3<br />
- LiOMe<br />
O<br />
NEt 2<br />
H 2 O 2<br />
OH<br />
O<br />
NEt 2<br />
Li<br />
B(OMe) 2<br />
OH<br />
Br 2 , Fe<br />
O<br />
NEt 2<br />
O<br />
Br<br />
N<br />
O<br />
O<br />
NEt 2<br />
Br<br />
Br<br />
c) Pd-katalysierte Kreuzkupplungen<br />
Br<br />
(HO) 2 B<br />
L L<br />
L L<br />
L<br />
L L<br />
Pd <strong>II</strong><br />
Pd 0 OMe<br />
-<br />
Pd <strong>II</strong> L<br />
Pd 0<br />
Pd 0 (PPh 3 ) 4<br />
Br -BrB(OH) 2<br />
OMe<br />
instabil<br />
oxidative Addition Transmetallierung reduktive Eliminierung<br />
OMe
Pd-katalysierte Arylierungen<br />
Br<br />
OMe<br />
Pd(PPh 3 ) 4<br />
HO<br />
B<br />
OH<br />
L<br />
Pd 0 L<br />
OMe<br />
Suzuki<br />
Br<br />
OMe Pd(PPh 3 ) 4<br />
OMe<br />
Heck<br />
Br<br />
OMe Pd(PPh 3 ) 4<br />
CuI, R 2 NH<br />
OMe<br />
Sonogashira<br />
Br<br />
H 2 N<br />
OMe<br />
Pd(OAc) 2 P(tBu) 3<br />
NaOtBu<br />
H<br />
N<br />
OMe<br />
Buchwald-Hartwig
7. Oxidationen u. Dehydrierungen<br />
7.1. Allg.: Def. Oxidation: Zufuhr von Sauerstoff oder Entzug von Elektronen bzw. Wasserstoff<br />
Oxidation<br />
(Zahl der Heteroatome nimmt zu)<br />
Reduktion<br />
H<br />
H<br />
OH<br />
OH<br />
OH<br />
H<br />
C<br />
H<br />
H<br />
C<br />
OH<br />
H<br />
C<br />
OH<br />
HO<br />
C<br />
OH<br />
HO<br />
C<br />
OH<br />
H<br />
H<br />
H<br />
H<br />
OH<br />
O<br />
O<br />
O<br />
O<br />
H<br />
H<br />
H<br />
OH<br />
C<br />
O<br />
Cl<br />
C<br />
Cl<br />
O<br />
H<br />
O<br />
H<br />
OMe<br />
H OMe N C N<br />
OMe<br />
N<br />
N C H<br />
O<br />
C<br />
H<br />
Formale Oxidationszahlen:<br />
H (+1), =O (-2), -OH (-1), Hal (-1), C-C, C=C, C=C (0)<br />
formale<br />
Oxidationszahl C:<br />
CH 4<br />
CH 3 CH 3 OH H 3 C CH 2 OH H 2 C=O H 3 C C<br />
O<br />
H<br />
H<br />
C<br />
O<br />
OH<br />
H 3 C C<br />
-4 -3 -2 -1 0 +1 +2 +3 +4<br />
O<br />
OH<br />
CO 2
mögliche Einzelschritte bei der Oxidation (Reduktion) organischer Verbindungen<br />
a) Elektronenübertragung (+ e - )<br />
b) Wasserstoffübertragung (+ H . )<br />
c) Übertragung von Hydrid (+ H - )<br />
d) Übertragung von Sauerstoff (+ O)<br />
e) Oxidative Addition an Übergangsmetallkomplexe (+ M)<br />
Oxidierbarkeit durch Elektronenentzug: nimmt meist mit erhöhter Nukleophilie zu (energiereicherem HOMO)<br />
n,! -Orbitale energiereicher (leichter zu oxidieren) als "-Orbitale<br />
R H < R OH < R NH 2<br />
R 3 C CR 3 < RC CR < R 2 C CR 2<br />
< R SH<br />
Oxidierbarkeit. durch<br />
Elektronenentzug<br />
Oxidierbarkeit durch radikalische H-Abstraktion hängt von Stabilität des entstehenden Radikals ab<br />
R CH 2 H < R CH H <<br />
R<br />
R C H<br />
Oxidierbarkeit. durch<br />
rad. H-Abstraktion<br />
H<br />
!<br />
stabil gegen Radikale<br />
R<br />
H<br />
< R CH 2 O-H < R CH-OH<br />
R<br />
H<br />
< R<br />
O<br />
H<br />
!<br />
H<br />
H
7.2. Oxidation von Methyl- u. Methylengruppen<br />
a) Technische Oxidationen mit<br />
O 2 und Metallsalzen (radikalisch)<br />
O 2 , 165°C<br />
Co-Kat<br />
O<br />
O<br />
O<br />
+ +<br />
OH<br />
O Et(Me)<br />
1 15 3<br />
O 2 , 350-400°C<br />
O 2 , 200-500°C<br />
Cu-Kat<br />
CHO<br />
Acrolein<br />
Mo-Kat<br />
COOH<br />
Acrylsäure<br />
Andrussow-Verfahren (Me → CN)<br />
R CH 3<br />
O 2 , 400-450°C<br />
Bi 2 O 3 -MoO 3 -Kat<br />
R<br />
CHO<br />
NH 3<br />
R C<br />
-H 2 O<br />
NH<br />
H<br />
O 2<br />
-H 2 O<br />
R C N<br />
CH 4<br />
O 2 , NH 3<br />
Kat.<br />
HCN<br />
O 2 , NH 3<br />
Kat.<br />
CN<br />
Acrylnitril<br />
O 2 , NH 3<br />
Kat.<br />
CN<br />
CN<br />
Phthalonitril<br />
O 2 , NH 3<br />
Kat.<br />
CN<br />
Methacrylnitril
) Oxidationen von Alkylaromaten (Einelektronenübertragung-SET)<br />
H<br />
CH 3 M n+ -H +<br />
M n+<br />
-M (n-1)+<br />
-M (n-1)+<br />
Nu (H 2 O)<br />
-H + OH<br />
OH<br />
-M (n-1)+ H<br />
OH<br />
-H +<br />
OH<br />
-M (n-1)+ OH<br />
-H + O<br />
N<br />
2 KMnO 4<br />
N<br />
M n+ M n+ + CO 2<br />
COOH<br />
+ 2 MnO 2<br />
4 KMnO 4 COOH<br />
+ 2 KOH<br />
+ 4 MnO 2<br />
+ 4 KOH<br />
β-Picolin<br />
Nicotinsäure<br />
SO 2 NH 2<br />
2 KMnO 4 COOH<br />
SO 2 NH 2<br />
-H 2 O<br />
O<br />
S<br />
N<br />
H<br />
NaOH<br />
O<br />
S<br />
N<br />
Na<br />
o-Toluolsulfonsäureamid<br />
O O<br />
Saccharin<br />
O<br />
O<br />
selektive Oxidationen zu aromat. Aldehyden mit<br />
Cerammoniumnitrat (CAN) 4[NH 4 ] 2 [Ce IV (NO 3 ) 6 ]<br />
CHO<br />
p-Xylol<br />
H 2 O, AcOH<br />
- 4Ce <strong>II</strong>I<br />
p-Tolylaldehyd (68%)
c) Oxidation von enolisierbaren Ketonen u. Aldehyden<br />
O<br />
O<br />
O<br />
O<br />
O<br />
SeO O<br />
2<br />
O<br />
SeO 2<br />
OH<br />
O<br />
Phenylglyoxal<br />
Phenylglyoxylsäure<br />
Cyclohexan-1,2-dion<br />
Mech:<br />
R<br />
O<br />
R<br />
O H<br />
Enol<br />
O<br />
Se<br />
O<br />
R<br />
O<br />
OH<br />
Se<br />
O<br />
-H 2 O<br />
R<br />
O<br />
Se<br />
O<br />
H 2 O<br />
-Se, -H 2 O<br />
R<br />
O<br />
O<br />
Alternative für toxisches Selendioxid:<br />
I OAc<br />
OAc<br />
Diacetoxyiodobenzol<br />
7.3. Oxidation von Alkoholen<br />
a) Oxidation mit Chrom VI -Verbindungen<br />
sek. Alkohol<br />
OH<br />
Na 2 Cr 2 O 7<br />
verd. H 2 SO 4<br />
O<br />
prim. Alkohol<br />
OH<br />
Na 2 Cr 2 O 7<br />
verd. H 2 SO 4<br />
H 2 O<br />
O<br />
OH<br />
Na 2 Cr 2 O 7<br />
OH<br />
Aldehyde nur unter wasserfreien Bedingungen isolierbar:<br />
K 2 Cr 2 O 7 / Eisessig (Jones Oxidation);<br />
CrO 3 x 2Pyridin (Collins Oxidation); Pyridiniumdichromat<br />
OH<br />
Aldehydhydrat<br />
OH<br />
verd. H 2 SO 4<br />
CrO 3 x 2<br />
N<br />
O<br />
O
O<br />
Mech:<br />
OH<br />
+<br />
HO<br />
O<br />
+VI<br />
Cr O<br />
OH<br />
(H )<br />
- H 2 O<br />
O<br />
O<br />
Cr O<br />
OH<br />
Chromsäureester<br />
H Cr O<br />
H<br />
O<br />
OH<br />
H<br />
Base: H 2 O; Pyridin<br />
analog E2-Elim<br />
O<br />
+IV<br />
O Cr OH<br />
OH<br />
b) selektive Oxidationen zu Aldehyden mit DMSO+Oxalylchlorid (Swern-Oxidation)<br />
S<br />
O<br />
O<br />
Cl<br />
O<br />
Cl<br />
-60°C<br />
S<br />
O<br />
O<br />
O<br />
Cl<br />
S<br />
Cl<br />
+CO 2 +CO<br />
S<br />
Cl<br />
HO<br />
R<br />
-60°C<br />
-HCl<br />
S<br />
O<br />
H<br />
R<br />
RT<br />
S O<br />
H 2 C<br />
H<br />
S-Ylid:<br />
R<br />
-60°C<br />
Et 3 N<br />
Cl - S O<br />
H<br />
Cl -<br />
R<br />
S<br />
S-Ylid:<br />
c) Dess-Martin Periodinan (DMP)<br />
(toleriert viele funktionelle Gruppen)<br />
O<br />
R<br />
R<br />
OH<br />
H<br />
O<br />
O<br />
I<br />
OAc<br />
AcO OAc<br />
DMP<br />
R<br />
R<br />
O<br />
H<br />
O<br />
I<br />
OAc<br />
OAc OH<br />
O<br />
R<br />
R<br />
O +<br />
O<br />
O<br />
I<br />
OAc<br />
+ 2 AcOH
d) Katalytische Dehydrierung von Alkoholen in der Technik<br />
Techn. Synthese für:<br />
OH<br />
ΔT (Kat.)<br />
Kat: Cu, Ag, CuO, ZnO<br />
O<br />
H<br />
+ H 2<br />
Dehydrierung endotherm:<br />
hohe Temperaturen (350°C)<br />
schnelles Abkühlen der Produkte<br />
H<br />
O<br />
H<br />
O<br />
H<br />
O<br />
O<br />
e) Oxidation von primären Alkoholen u. Aldehyden zu Carbonsäuren<br />
KMnO 4<br />
OH COOH Aldehyde (Hydrate) oxidieren leichter als Alkohole<br />
oder<br />
daher Aldehyd meist nicht isolierbar<br />
Na 2 Cr 2 O 7<br />
verd. H 2 SO 4<br />
HO<br />
HO<br />
OH<br />
O<br />
OH<br />
O<br />
H<br />
OH<br />
HO<br />
HO<br />
OH<br />
O<br />
OH<br />
O<br />
I<br />
I<br />
HO<br />
HO<br />
OH<br />
O<br />
HO<br />
H<br />
O<br />
I<br />
OH<br />
-H 2 O, -I<br />
OH<br />
HO<br />
HO<br />
O<br />
HO O<br />
H 2 O<br />
D-Gluconsäurelacton<br />
COOH<br />
OH<br />
HO<br />
OH<br />
OH<br />
CH 2 OH<br />
D-Gluconsäure<br />
Oxidation von Glucose (Nachweis) mit:<br />
Ag 2 O-NH 4 OH<br />
(Tollens Reagenz)<br />
oder<br />
Glc<br />
Ag (Spiegel)<br />
+ Gluconsäure<br />
Cu(<strong>II</strong>)-Tartratkomplex<br />
(Fehling'sche Lösung)<br />
Glc<br />
Cu 2 O (rot)<br />
+ Gluconsäure
7.4. Oxidation von Aromaten zu Chinonen<br />
O<br />
O<br />
O<br />
O<br />
O<br />
a) Chinone aus aromatischen Kohlenwasserstoffen<br />
o-Benzochinon<br />
rot<br />
O<br />
p-Benzochinon<br />
gelb<br />
O<br />
kein m-Chinon<br />
O<br />
Oxidationsmittel: H 2 CrO 4 , H 2 O 2 , O 2 /V 2 O 5 , Anodische Oxidation (-e - )<br />
OH<br />
M n+ H<br />
M n+<br />
-M (n-1)+ Nu (H 2 O)<br />
-H + -M (n-1)+<br />
OH<br />
H -H+ OH<br />
OH M n+ OH -H + O -e - O O<br />
OH<br />
Nu (H 2 O)<br />
-M (n-1)+<br />
-H + H<br />
HO<br />
HO<br />
Phenol leichter<br />
Hydrochinon<br />
oxidierbar<br />
als Benzol -2 e -<br />
-2H +<br />
Beisp:<br />
Ag 2 O 2<br />
O<br />
H 2 CrO 4<br />
O<br />
O<br />
schwer<br />
O<br />
(20 %)<br />
O<br />
Naphthochinon<br />
O<br />
p-Benzochinon
O<br />
leicht<br />
H 2 CrO 4<br />
H 2 CrO 4<br />
O<br />
Anthracen<br />
O<br />
(90%)<br />
Anthrachinon<br />
Phenanthren<br />
O<br />
(37%)<br />
Phenanthrenchinon<br />
COOH<br />
COOH<br />
Diphensäure<br />
b) Chinone aus substitiuierten Aromaten (Phenole, Aniline)<br />
OH<br />
O O<br />
O<br />
+ H 2 O 2<br />
NH 2<br />
1/2 Br 2<br />
-Br<br />
NH 2<br />
NH 2<br />
NH 2<br />
1/2 Br 2<br />
-Br<br />
NH<br />
2 H 2 O<br />
-NH 3<br />
O<br />
OH<br />
O<br />
N<br />
N<br />
N<br />
N<br />
-H<br />
N<br />
-Me 2 NH<br />
O<br />
Hydrochinon<br />
p-Dimethylaminoanilin<br />
Wursters Rot<br />
Semichinon<br />
(stabiles Radikalkation)<br />
Chinonimmoniumsalz<br />
c) Chinonimine durch oxidative Kupplung<br />
N NH 2<br />
Ox.<br />
-e - N NH 2<br />
elektrophiles<br />
Radikalkation<br />
N<br />
S E Ar, -2H + , -e -<br />
N<br />
H<br />
N<br />
N<br />
-H , -2e -<br />
N N N<br />
Bindschedlers Grün<br />
Chinondiimin
Anwendung in der Farbphotographie<br />
N NH 2<br />
OH<br />
OH dirigiert para<br />
R<br />
4 Ag I Br* (*belichtet=<br />
stärkeres Oxidationsmittel<br />
durch Ag-Keime als Kat.)<br />
-4Ag 0 , -4HBr<br />
N<br />
N<br />
R<br />
O<br />
oxidatives Kupplungsprodukt<br />
in blaugrüner Farbschicht<br />
7.5. Oxidation von C-C Mehrfachbindungen: Oxidationsmittel KMnO 4 , HNO 3 , O 3 ,<br />
KMnO 4 , HO<br />
Kälte<br />
(Dihydroxylierung)<br />
KMnO 4 , H<br />
OH<br />
OH<br />
COOH<br />
COOH<br />
HIO 4<br />
(Glycolspaltung)<br />
(Periodatspaltung)<br />
CHO<br />
CHO<br />
e - -reicher<br />
KMnO 4 , HO<br />
N<br />
Chinolin<br />
N<br />
COOH<br />
COOH<br />
Ölsäure (9 Z)<br />
COOH<br />
HNO 3<br />
Nonansäure<br />
COOH<br />
+<br />
HOOC<br />
COOH<br />
Azelainsäure<br />
7.6. Glycolspaltung<br />
O<br />
OH<br />
OH<br />
"Glycol"<br />
(1,2-Diol)<br />
HI V<strong>II</strong> O 4<br />
oder Pb(OAc) 4<br />
O<br />
O<br />
Mech:<br />
OH<br />
OH<br />
O<br />
I OH<br />
O<br />
-H 2 O<br />
O<br />
O<br />
O<br />
I<br />
O<br />
OH<br />
H<br />
O<br />
O<br />
O<br />
I<br />
O<br />
V<br />
OH<br />
keine<br />
Überreaktion
Anwendung der Glycolspaltung: a) Synthese von Aldehyden u. Ketonen aus Olefinen u. Diolen<br />
kat. OsO 4<br />
HIO 4 , H 2 O<br />
b) historisch: Bestimmung der Ringgröße von Glycosiden<br />
Pyranoside:<br />
OH<br />
OH<br />
HIO O<br />
4 O<br />
HO<br />
O<br />
OMe<br />
HO<br />
OMe<br />
H O<br />
OH<br />
O<br />
OH<br />
Methyl-ß-D-glucopyranosid<br />
HCOOH<br />
HO<br />
OH<br />
O + O<br />
Furanoside:<br />
CH 2 OH<br />
HO OMe<br />
O HIO 4<br />
OH<br />
OH<br />
Methyl-ß-D-glucofuranosid<br />
CH 2 O<br />
H<br />
O<br />
H<br />
O<br />
O<br />
O<br />
OMe<br />
O<br />
Nachweis mit<br />
O<br />
O<br />
Dimedon<br />
7.7. Oxidation von Hydroxymethylgruppen u. Halofomabbau<br />
OH<br />
Br 2 , HO<br />
-H 2 O, -Br<br />
H<br />
Br<br />
O<br />
-H 2 O, -Br<br />
O<br />
H<br />
HO<br />
O<br />
Br<br />
Br<br />
- Br<br />
HO<br />
O<br />
H<br />
Br<br />
ω-Bromacetophenon<br />
(CH-acider als Acetophenon)<br />
Br 2<br />
HO<br />
Br 2<br />
HO<br />
O<br />
Br<br />
Br<br />
Br<br />
HO<br />
O<br />
OH<br />
Br<br />
Br<br />
Br<br />
OH<br />
O<br />
+<br />
Br<br />
H +<br />
Br<br />
Br<br />
CHBr 3<br />
Bromoform
7.8. Katalytische Dehydrierung von Kohlenwassserstoffen u. Hydroaromaten<br />
thermisch<br />
katalytisch (Ni, Pt, Pd, CrOx)<br />
≈ 650°C<br />
+ H 2 Dehydrierung<br />
55%<br />
99%<br />
+ CH 4<br />
Crackung<br />
45%<br />
1%<br />
ΔT, Kat.<br />
ΔT, Kat.<br />
ΔT, Kat.<br />
-3 H 2 N<br />
H<br />
-2 H 2 N -3 H<br />
H N 2<br />
H<br />
N<br />
ΔT, Kat.<br />
Pyrrolidin Pyrrol Piperidin<br />
-H 2<br />
Styrol<br />
Hexan-Isomere<br />
C 6 H 14<br />
Pt/Al 2 O 3<br />
-H 2<br />
ΔT,Pt<br />
Cyclisierung<br />
Platforming: Pt-Kat.<br />
-3 H<br />
Reforming: Re-Kat.<br />
2<br />
Dehydrierung<br />
Heptan-Isomere<br />
C 7 H 16<br />
ΔT,Kat.<br />
Cyclisierung<br />
Dehydrierung<br />
- 4 H 2
8. Reaktionen von Carbonylverbindungen<br />
Carbonylverbindungen sind leicht darstellbar<br />
und zeigen hohe Reaktivität. Viele Reaktionen der <strong>Organische</strong>n<br />
<strong>Chemie</strong> und der Biochemie basieren auf der Umsetzung<br />
von Carbonylverbindungen.<br />
R<br />
O<br />
C<br />
R<br />
R<br />
O<br />
C<br />
Addition von Elektrophilen<br />
Addition von Nukleophilen<br />
R<br />
H<br />
H H + -Abstraktion durch Basen<br />
Reaktionen an der Carbonylgruppe<br />
O<br />
a) mit Nu H<br />
b) mit E +<br />
O<br />
O ~H O<br />
sp 2 sp 3 sp 3<br />
sp 2<br />
NuH<br />
C<br />
C<br />
C<br />
C<br />
HNu<br />
Nu<br />
Produkt stabil oder<br />
Folgereaktionen<br />
E<br />
E<br />
O<br />
C<br />
sp 2<br />
NuH<br />
- H O<br />
Nu<br />
C<br />
sp 3<br />
E<br />
Reaktivität bei Carbonylreaktionen ist abhängig von: a) Nukleophilie von NuH; b) Aktivierung der Carbonylgruppe; c) Substituenteneinfluss<br />
1) Einfluß funktioneller Gruppen direkt an der Carbonylgruppe:<br />
Reaktivität<br />
O<br />
O<br />
O<br />
OH<br />
Base<br />
O<br />
NR 2<br />
O<br />
OR<br />
O<br />
CH 3<br />
O<br />
H<br />
O<br />
O<br />
O<br />
O<br />
Cl<br />
+M, +I<br />
+M, -I<br />
(OH)<br />
ohne Base<br />
+I<br />
-I, - M, + M -I
2) Einfluß weiter entfernter funktioneller Gruppen:<br />
a) Elektronische Einflüsse: O<br />
O<br />
OMe OMe<br />
ClH 2 C<br />
O<br />
OMe<br />
Cl 2 HC<br />
O<br />
OMe<br />
V HO<br />
-I(-M) erhöht Elektronenzug<br />
+ Geschwindigkeit der alk. Hydrolyse<br />
~ Säurestärke d. Carbonsäuren<br />
b) Sterische Einflüsse<br />
O<br />
O<br />
O<br />
V R-NH 2<br />
Geschwindigkeit<br />
der Iminbildung<br />
3) Elektrophilie des Katalysators (H + , AlCl 3 ) erhöht Reaktivität am Carbonyl-C,<br />
kann aber Reaktivität des Nukleophils herabsetzen.<br />
H<br />
O<br />
H 2 N<br />
R<br />
Heteroanaloge Carbonylverbindungen: analoge Reaktivität wie C=O<br />
Elektrophilie<br />
Nukleophilie<br />
O X S N-R N<br />
Thiocarbonyl Imin Nitril<br />
O X O S O N O<br />
- O<br />
N +<br />
Sulfoxid Nitroso Nitro<br />
O<br />
O X Y N N<br />
Azo
8.1. Reaktionen von Carbonylverbindungen mit Heteroatomnukleophilen<br />
Aldehyde u. Ketone:<br />
R<br />
NHR<br />
OR<br />
OR<br />
O NR N<br />
R OH<br />
OH<br />
OR<br />
Imin Enamin Halbaminal Halbacetal Acetal<br />
Carbonsäurederivate:<br />
HO<br />
O<br />
RO<br />
O<br />
RHN<br />
O<br />
Hal<br />
O<br />
R<br />
O<br />
O<br />
O<br />
8.1.1. Hydratisierung von<br />
Aldehyden u. Ketonen<br />
O<br />
H 2 O<br />
OH 2<br />
O<br />
~H<br />
OH<br />
OH<br />
Hydrat (gem. Diol)<br />
meist instabil<br />
(Erlenmeyer-Regel)<br />
stabile Hydrate (isolierbar) bei -I, -M Substituenten:<br />
O<br />
OH<br />
OH<br />
OH<br />
F 3 C OH<br />
Cl 3 C<br />
HOOC<br />
OH<br />
OH<br />
OH<br />
F 3 C<br />
OH<br />
O<br />
Chloralhydrat Glyoxylsäurehydrat Ninhydrin Hexafluoracetonhydrat<br />
O<br />
HO OH<br />
HO OH<br />
O<br />
Mesoxalsäurehydrat<br />
8.1.2. Bildung von Halbacetalen u. Acetalen<br />
O<br />
H<br />
O<br />
H<br />
R-OH<br />
-H<br />
OH<br />
OR<br />
H<br />
-H 2 O<br />
O<br />
R<br />
R-OH<br />
OR<br />
OR<br />
+H<br />
Halbacetal<br />
Bildung durch Säure- o. Basenkatalyse<br />
(meist instabil)<br />
Oxocarbeniumion<br />
Acetal<br />
Spaltung nur bei Säurekatalyse<br />
(stabil geg. Basen)
Acetalbildung begünstigt durch Mesomeriestabilisierung des Oxocarbeniumions:<br />
α-Alkoxycarbeniumion<br />
O<br />
Me<br />
O<br />
Me<br />
besser stabilisiert als<br />
Carbeniumion<br />
Aldehyde: leichte Reaktion mit Alkoholen (H )<br />
O<br />
HOEt<br />
OEt<br />
OH<br />
(97% Halbacetal)<br />
Ketone: erschwerte Reaktion (starke Säure, wasserentziehende Mittel: z.B. H 2 SO 4 , Orthoester)<br />
O<br />
EtOH, H<br />
HC(OEt) 3<br />
- HCOOEt<br />
OEt<br />
OEt<br />
OEt<br />
H<br />
H OEt<br />
OEt -HOEt<br />
Orthoameisensäuretriethylester<br />
(Esteracetal)<br />
H<br />
OEt<br />
OEt<br />
H 2 O<br />
-H<br />
OEt<br />
H OH<br />
OEt<br />
Esterhalbacetal<br />
-HOEt<br />
H<br />
O<br />
OEt<br />
Anwendung: a) Acetalisierung als Schutz für Aldehyde, Ketone u. Alkohole<br />
O<br />
COOEt<br />
H<br />
O O<br />
HO OH COOEt<br />
-H 2 O<br />
1. EtMgBr<br />
2. H 3 O<br />
O<br />
Et<br />
OH<br />
Et<br />
b) saure Bildung von Glycosiden (Fischer)<br />
H<br />
HO-Oct<br />
HO<br />
HO<br />
HO<br />
-H 2 O HO<br />
-H<br />
HO O HO O<br />
HO O<br />
HO O<br />
HO<br />
+ HO<br />
HO<br />
OH OH HO<br />
HO O Oct<br />
HO<br />
HO<br />
O Oct<br />
Glc (Halbacetal)<br />
Glucosylkation<br />
Octyl-α-D-Glucosid (Acetal)<br />
(Oxocarbeniumion)<br />
(biolog. abbaubares neutrales Detergens)<br />
(Nebenprod.)<br />
c) Thioacetale HS (H ) - H 2 O<br />
O +<br />
HS<br />
S<br />
S<br />
Dithiolan<br />
leichte Bildung,<br />
hohe Stabilität<br />
(S wenig basisch)<br />
Raney-Ni
8.1.3. Reaktionen von Aldehyden u. Ketonen mit Aminoverbindungen<br />
a) Allgemein: schnell<br />
~H<br />
NH O<br />
HN O<br />
N<br />
OH<br />
Halbaminal<br />
(instabil)<br />
prim. Amin:<br />
sek. Amin:<br />
H<br />
N<br />
R<br />
R<br />
N<br />
R<br />
OH<br />
OH<br />
langsam<br />
(H )-H 2 O<br />
langsam<br />
(H )-H 2 O<br />
H<br />
N<br />
R<br />
R<br />
N<br />
R<br />
H<br />
B (-BH )<br />
B (-BH )<br />
N<br />
R<br />
R<br />
N<br />
R<br />
Imin, Azomethin,<br />
Schiff'sche Base<br />
(Heterocarbonylverb.)<br />
Enamin (Azaenol)<br />
HN<br />
R<br />
Enamintautomer<br />
meist instabil<br />
z.B.:<br />
O NH 2 -H N O<br />
2 O<br />
+ +<br />
NH<br />
-H 2 O<br />
Imin<br />
N<br />
Enamin<br />
Rkt. mit<br />
Hydroxylamin- oder<br />
Hydrazinderivaten<br />
O + H 2 N-OH x HCl<br />
-H 2 O<br />
N<br />
OH<br />
Oxim<br />
+<br />
H 2 N-NH<br />
-H 2 O<br />
HN<br />
N<br />
Phenylhydrazon<br />
+ H 2 N-NH 2<br />
-2H 2 O<br />
N<br />
N<br />
Azin<br />
O<br />
-H 2 O<br />
N<br />
+ H 2 N-NH-CO-NH 2<br />
N NH 2<br />
Semicarbazon
) Reaktionsgeschwindigkeit V mit Aldehyd u. Keton zeigt Optimum bei pH ≈ pKs des Nukleophils<br />
V bestimmt durch:<br />
1.) Additionsschritt<br />
2.) Eliminierungsschritt<br />
Säureeinfluß<br />
Additionsschritt:<br />
H 2 NR + H<br />
H 3 N-R<br />
H<br />
O + H O<br />
desaktiviert Nu<br />
aktiviert CO<br />
V<br />
ca. pK s des Nu.<br />
Beisp:<br />
H<br />
H<br />
O<br />
+ 2<br />
HO<br />
pK s = 9.9<br />
- H 2 O O<br />
V max : pH = 10<br />
O<br />
Formaldehyddiphenylacetal<br />
pH<br />
O<br />
- H 2 O<br />
N<br />
V<br />
O + H 3 N-NH-CO-NH max : pH = 4<br />
2 N NH 2<br />
pK s = 3.6 (H + -Form)<br />
Acetonsemicarbazon<br />
c) Imine CHO<br />
NH 3<br />
- H 2 O<br />
CH=NH<br />
Acetaldimin<br />
HN NH<br />
N<br />
H<br />
Trimethylhexahydrotriazin<br />
N<br />
N N<br />
Triazin<br />
HO<br />
NH 3<br />
HN<br />
3H 2 CO<br />
N<br />
NH 3<br />
H 2 CO<br />
H 2 C=NH<br />
NH<br />
N<br />
- H 2 O<br />
HN<br />
N OH -3H 2 O<br />
Formimin<br />
HO<br />
d) Bildung von Iminen u. Enaminen bei der Synthese von Heterocyclen<br />
1.) 1,2-Diketone<br />
R O H 2 N<br />
- 2 H 2 O R N<br />
+<br />
Chinoxalin<br />
R O H 2 N<br />
R N<br />
N<br />
N<br />
N<br />
N<br />
Urotropin
2.) 1,3-Diketone<br />
R<br />
R<br />
O<br />
O<br />
+<br />
NH 2<br />
NH<br />
R<br />
- H 2 O - H<br />
N<br />
2 O<br />
O NH<br />
R<br />
R<br />
R<br />
N<br />
N<br />
N-Phenylpyrazol<br />
3.) 1,4-Diketone<br />
1. Hydrazon<br />
2. Enamin<br />
(Aromat)<br />
R<br />
O<br />
O<br />
+<br />
R<br />
NH 3<br />
R<br />
O H 2 N<br />
R<br />
OH<br />
R<br />
HO<br />
N<br />
H<br />
R<br />
OH<br />
- 2H 2 O<br />
R R<br />
N<br />
H<br />
subst. Pyrrol<br />
e) Osazone<br />
CHO<br />
OH<br />
R<br />
Zucker<br />
3<br />
H 2 N<br />
H<br />
N<br />
Oxidation an C-2<br />
zum Keton<br />
- NH 3 , - Anilin<br />
- 2H 2 O<br />
R<br />
N<br />
N<br />
H N<br />
H<br />
N<br />
Osazon (krist.)<br />
CHO CHO CH 2 OH<br />
OH HO<br />
O<br />
R<br />
R R<br />
Glucose Mannose Fructose<br />
gleiches Osazon<br />
8.1.4. Synthese von Carbonsäureestern<br />
a) saure Veresterung<br />
(prim. + sek. ROH)<br />
Et OH + R<br />
O<br />
OH<br />
H<br />
R<br />
H<br />
OH<br />
OH<br />
O<br />
Et<br />
~ H<br />
R<br />
OH 2<br />
O<br />
O<br />
Et<br />
H<br />
- H 2 O, - H<br />
R<br />
O<br />
OEt
ei tert. ROH anderer Mech.:<br />
OH<br />
H , - H 2 O<br />
Verschiebung des Gleichgewichts<br />
bei saurer Veresterung notwendig:<br />
HO<br />
O<br />
S N 1<br />
R<br />
Überschuss ROH oder RCOOH<br />
Entfernung von H 2 O (H 2 SO 4 oder Wasserabscheider)<br />
Entfernung des Esters (Extraktion oder Destillation)<br />
H<br />
O<br />
O<br />
R<br />
-H<br />
O<br />
R<br />
O<br />
tert. Ester säurelabil<br />
b) Ester aus aktivierten Carbonsäurederivaten:<br />
O<br />
1) aus Säurechloriden: R<br />
Cl<br />
R' OH<br />
langsam - HCl<br />
O<br />
R<br />
O-R'<br />
2) aus Anhydriden:<br />
O<br />
R O<br />
c) Alkylierung von Carboxylaten:<br />
O<br />
N<br />
R<br />
O<br />
N<br />
R<br />
Cl<br />
Acylpyridiniumsalz<br />
(stark aktiviert)<br />
Pyridin als Kat.<br />
H<br />
N<br />
oder<br />
HO-R'<br />
R<br />
O<br />
R<br />
O<br />
H<br />
O<br />
N<br />
O<br />
O<br />
Cl<br />
N<br />
R<br />
R<br />
R-COO<br />
OR'<br />
H<br />
+ R'-OH<br />
O<br />
R<br />
O R'<br />
+<br />
N<br />
Cl<br />
H<br />
O<br />
R<br />
O R'<br />
+ RCOOH<br />
R<br />
O<br />
O<br />
R'<br />
Cs<br />
Br<br />
S N<br />
- CsBr<br />
R<br />
O<br />
O<br />
R'<br />
R<br />
Nu<br />
O<br />
O<br />
+ R'OH<br />
Nu
8.1.5. Synthese von Carbonsäureamiden<br />
a) Synthese:<br />
direkte Umsetzung<br />
ungünstig<br />
wg. Salzbildung:<br />
R<br />
O<br />
OH<br />
+ NH 3 R<br />
O<br />
O<br />
NH 4<br />
ΔT<br />
R<br />
O<br />
NH 2<br />
+ H 2 O<br />
Beisp.:<br />
besser:<br />
R<br />
O<br />
Cl<br />
R<br />
O<br />
O<br />
O<br />
R<br />
+ H 2 N-R<br />
- H-X<br />
R<br />
O<br />
NH 2<br />
hohe Ausbeute, da<br />
keine Gleichgewichtsreaktion<br />
Cl<br />
NH 3 (konz.)<br />
NH 3<br />
NH 3<br />
NH 2<br />
O<br />
H 2 O<br />
O<br />
Cl<br />
O<br />
-Cl NH 3<br />
O<br />
- NH 4<br />
O<br />
Cl<br />
+<br />
HN<br />
N<br />
O<br />
N<br />
+<br />
N Cl<br />
H<br />
O<br />
O<br />
O<br />
H 2 NEt<br />
O<br />
NH 2 Et<br />
O<br />
O<br />
O O O<br />
~H NHEt O<br />
OH<br />
-AcOH<br />
O<br />
O<br />
NHEt<br />
O<br />
O<br />
O<br />
gem. Anhydrid<br />
-AcOH<br />
O<br />
N Et<br />
O<br />
N-Ethylphthalimid<br />
b) Struktur von Amiden: planar (Amidmesomerie)<br />
H<br />
O<br />
N<br />
H<br />
O<br />
N<br />
H<br />
O<br />
N<br />
CH 3<br />
CH 3<br />
N-Methylacetamid:<br />
O<br />
N<br />
H<br />
Z-Konformer<br />
O<br />
E<br />
N H
c) Synthese von Peptiden:<br />
H 2 N<br />
O<br />
H<br />
N<br />
O<br />
OH<br />
Dipeptid:<br />
L-Alanyl-L-phenylalanin<br />
(H-Ala-Phe-OH)<br />
Schutzgruppen notwendig für eindeutige Amidbildung<br />
selektiv geschützte<br />
Aminosäurebausteine:<br />
O<br />
O N<br />
H<br />
O<br />
Z-Ala-OH<br />
(Urethanschutzgruppe)<br />
OH<br />
+<br />
H 2 N<br />
O<br />
OtBu<br />
H-Phe-OtBu<br />
(Esterschutzgruppe)<br />
Zweiphasenreaktion<br />
Toluol / verd. NaOH<br />
-HCl<br />
-H<br />
O<br />
O<br />
Cl<br />
H 2 N<br />
O<br />
O<br />
H 3 N<br />
O<br />
OH<br />
Chlorameisensäurebenzylester<br />
(Z-Cl nach Zervas)<br />
OH<br />
- H 2 O<br />
H (H 2 SO 4 )<br />
O<br />
H 3 N<br />
O<br />
H 3 N<br />
O<br />
H-Ala-OH<br />
(Betainform)<br />
O<br />
H-Phe-OH<br />
(Betainform)
Peptidkopplung u. Entschützung<br />
Bzl-O<br />
O<br />
N<br />
H<br />
O<br />
OH<br />
N<br />
C<br />
N<br />
Bzl-O<br />
O<br />
N<br />
H<br />
O<br />
O<br />
H<br />
N<br />
C<br />
N<br />
Diisopropylcarbodiimid<br />
(DIC)<br />
HO<br />
Bzl-O<br />
O<br />
N<br />
H<br />
1. Aktivierung<br />
der Aminosäure<br />
O<br />
Aminosäure-OBt-ester<br />
(Aktivester)<br />
O<br />
N<br />
N<br />
N<br />
-<br />
N<br />
N<br />
N<br />
N-Hydroxybenzotriazol<br />
(HOBt)<br />
N<br />
H<br />
O<br />
N<br />
H<br />
Diisopropylharnstoff<br />
(schwerlösl.)<br />
Bzl-O<br />
O<br />
N<br />
H<br />
O<br />
O<br />
analog gem.<br />
Anhydrid<br />
N<br />
NH<br />
O<br />
2. Kopplung<br />
O<br />
N<br />
H<br />
H 2 N<br />
O<br />
geschütztes Dipeptid<br />
H<br />
N<br />
O<br />
O<br />
OtBu<br />
OtBu<br />
H<br />
N<br />
H 3 N<br />
CF 3 COO<br />
O<br />
entschütztes Dipeptid<br />
3. Entschützung<br />
b) Trifluoressigsäure -<br />
O<br />
H<br />
a) Pd-H 2 N<br />
H 2 N<br />
OtBu<br />
-<br />
- CO 2<br />
O<br />
O<br />
OH
d) Synthese von heterocyclischen Amiden:<br />
Barbiturate:<br />
O<br />
NH 2<br />
NH 2<br />
OEt<br />
- EtOH<br />
O<br />
NH<br />
NH 2<br />
+<br />
O<br />
O<br />
OEt<br />
Ph<br />
Et<br />
OEt<br />
-EtO<br />
O<br />
H 2 N<br />
H<br />
N<br />
O<br />
O<br />
Ph<br />
Et<br />
OEt<br />
OEt<br />
-EtOH<br />
O<br />
HN<br />
O<br />
Ph<br />
HN Et<br />
O<br />
Phenobarbital<br />
(Schlafmittel)<br />
Pyrazolone:<br />
EtO<br />
O<br />
O<br />
+<br />
NH 2<br />
NH<br />
-H 2 O<br />
EtO<br />
N<br />
O<br />
NH<br />
-EtOH<br />
O<br />
N<br />
N<br />
8.1.6. Hydrolyse von Carbonsäurederivaten<br />
3-Methyl-1-phenyl-pyrazol-5-on<br />
a) basische Hydrolyse von Estern u. Amiden<br />
R'<br />
O<br />
OMe<br />
+ OH<br />
HO O<br />
R' OMe<br />
tetraedr. Intermediat<br />
R<br />
O<br />
+ MeO<br />
OH<br />
pK s = 4.7<br />
irreversibel<br />
O<br />
R + MeOH<br />
O<br />
pK s =16<br />
Carboxylat<br />
gut löslich in H 2 O<br />
Verseifungsgeschwindigkeit korreliert mit:<br />
1.) Säurestärke<br />
2.) Verzweigung im<br />
Säure- u. Alkoholteil<br />
H 3 C<br />
O<br />
OMe<br />
O<br />
OMe<br />
Grenzfälle:<br />
O<br />
MeO<br />
O<br />
OMe<br />
H 2 O, RT<br />
O O<br />
HO OH<br />
pK s = 1.3<br />
+ 2 MeOH<br />
O<br />
O<br />
CH 3<br />
CH 3<br />
CH 3<br />
OH<br />
b) saure Hydrolyse: langsamer als alk. Hydrolyse. Außerdem Ester u. Säure oft wenig lösl. in H 2 O.<br />
tert. Alkylester:<br />
leicht sauer spaltbar<br />
(CF 3 COOH)<br />
(basenstabil)<br />
O<br />
OtBu<br />
c) Umesterungen: Ester + Alkohol + kat. Säure o. Base<br />
H<br />
H<br />
O<br />
O<br />
H<br />
O<br />
O<br />
OH<br />
O<br />
+<br />
-H<br />
Nu<br />
Nu<br />
Triacylglycerid<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
kat. MeO in MeOH<br />
OH<br />
OH<br />
OH<br />
+ 3<br />
MeO<br />
O<br />
Fettsäuremethylester (Biodiesel)<br />
d) Alk. Hydrolyse von subst. Malonsäure- u. ß-Ketoestern<br />
R<br />
COOEt<br />
COOEt<br />
OH , H 2 O<br />
-EtOH<br />
schnell<br />
R<br />
COO<br />
COOEt<br />
OH , H 2 O<br />
langsam<br />
R<br />
COO<br />
COO<br />
Δ<br />
O<br />
R<br />
H<br />
O<br />
H<br />
O<br />
OH<br />
R<br />
CO 2<br />
COOH<br />
subst.<br />
Essigsäure<br />
H<br />
H<br />
COOEt<br />
O<br />
1. 2 NaOEt, 2 MeI<br />
2. OH , H 2 O<br />
3. Δ, -CO 2<br />
O<br />
Methylisopropylketon
8.1.7. Acidolyse von Carbonsäurederivaten<br />
a) Bildung von<br />
Carbonsäureanhydriden<br />
O<br />
OH<br />
HO 700°C<br />
O<br />
oder<br />
P 2 O 5<br />
O<br />
O<br />
O<br />
+ H 2 O<br />
O<br />
O<br />
OH<br />
OH<br />
180°C<br />
-H 2 O<br />
O<br />
O<br />
O<br />
b) Umesterungen von Estern mit Carbonsäuren<br />
O<br />
OMe<br />
+ HCOOH<br />
kat. H 2 SO 4<br />
O<br />
O<br />
O<br />
H<br />
+ HOMe<br />
H<br />
O<br />
O-Me<br />
+<br />
O<br />
OH<br />
c) Bildung gemischter Anhydride<br />
Ester der stärkeren Säure<br />
R'<br />
O<br />
OH<br />
R<br />
O<br />
O<br />
O<br />
R<br />
R'<br />
O<br />
O<br />
O<br />
R<br />
+<br />
R<br />
O<br />
OH<br />
R<br />
O<br />
O<br />
NHEt 3<br />
O<br />
Cl<br />
- NEt 3 x HCl<br />
R<br />
O<br />
O<br />
O<br />
H 2 N-R'<br />
R<br />
O<br />
NHR<br />
8.1.8. Additionen an Nitrile (weniger reaktiv als Amide, drastischere Reaktionsbedingungen)<br />
a) Addition von Wasser<br />
H O H<br />
R C N<br />
H<br />
R<br />
NH<br />
OH 2<br />
- H<br />
NH<br />
Tautom.<br />
NH 2<br />
Hydrolyse<br />
OH<br />
H O<br />
R C N<br />
R<br />
N<br />
OH<br />
R<br />
OH<br />
+ H Imidsäure<br />
(Tautomer eines<br />
Carbonsäureamids)<br />
R<br />
Amid<br />
O<br />
- NH 3<br />
R<br />
O
) Addition von Alkoholen u. Aminen unter sauren Bedingungen<br />
R C N<br />
R'<br />
O<br />
H<br />
H Cl<br />
R<br />
NH<br />
O<br />
R'<br />
H<br />
Cl<br />
2 R'-OH<br />
-NH 3<br />
R<br />
NH 2<br />
OR'<br />
Imidoesterhydrochlorid<br />
Cl<br />
H 2 O<br />
R<br />
2 H 2 N-R''<br />
-NH 3, -R'OH,<br />
H<br />
2.<br />
O<br />
H<br />
NH 2<br />
3.<br />
OR'<br />
1.<br />
analog Halbaminal<br />
- NH 3<br />
- H<br />
R<br />
Ester<br />
O<br />
OR'<br />
OR'<br />
N<br />
R''<br />
R<br />
OR'<br />
OR'<br />
Orthoester<br />
R<br />
HN<br />
R''<br />
Amidin<br />
8.1.9. Additionen an spez. Carbonylverbindungen<br />
a) Phosgen<br />
Cl<br />
O<br />
Cl<br />
HO<br />
Bzl<br />
- HCl<br />
Cl<br />
O<br />
O-Bzl<br />
+ HO-Bzl<br />
- HCl<br />
BzlO<br />
O<br />
O<br />
Chlorameisensäurebenzylester<br />
(Z-Cl)<br />
Dibenzylcarbonat<br />
(Kohlensäureester)<br />
Cl<br />
O<br />
Cl<br />
H 2 N<br />
R<br />
O<br />
- HCl - HCl<br />
Cl<br />
NHR<br />
Carbamoylchlorid<br />
(Carbaminsäurechlorid)<br />
O<br />
C<br />
N<br />
R<br />
Isocyanat<br />
H 2 N<br />
R<br />
HO-R'<br />
RHN<br />
R'O<br />
O<br />
O<br />
NHR<br />
NHR<br />
Harnstoffderivat<br />
Urethan (Carbaminsäureester,<br />
Carbamat)
) CO 2 , CS 2<br />
O<br />
O<br />
C<br />
O<br />
NH 3<br />
H 2 N<br />
HO<br />
Carbamidsäure<br />
(Carbaminsäure)<br />
NH 3<br />
H 2 N<br />
H 3 O<br />
H 2 N<br />
O<br />
O<br />
CO 2 + NH 3<br />
O NH<br />
HO<br />
4<br />
Ammoniumcarbamat<br />
Carbamidsäure<br />
(im Sauren instabil)<br />
O<br />
C<br />
O<br />
NaOMe<br />
MeO<br />
O<br />
O<br />
Na<br />
O<br />
Cl OR<br />
- NaCl<br />
O O<br />
MeO O OR<br />
Pyrokohlensäureester<br />
S<br />
C<br />
S<br />
NaOMe<br />
MeO<br />
S<br />
S<br />
Na<br />
Xanthogenat<br />
H 3 O<br />
MeO<br />
HO<br />
O<br />
Kohlensäuremethylester<br />
(im Sauren instabil)<br />
CO 2 + MeOH<br />
8.2.Reaktionen von Carbonylverbindungen mit C-Nukleophilen (C-C-Verknüpfungen)<br />
typische C-Nukleophile:<br />
a) Organometallverb. R-Mg-X, R-Li<br />
b) Cyanide, Acetylide: CN , R-C = C<br />
c) Ylide<br />
d) Enolate<br />
e) Enole, Enolether, Enamine<br />
aus C-H aciden Verb.
8.2.1. Addition von Blausäure<br />
Beisp.:<br />
OH<br />
O<br />
O H<br />
OH<br />
CN<br />
CN<br />
HCN CN + R<br />
R<br />
R<br />
NH<br />
O<br />
NH<br />
NH<br />
2<br />
NH 3<br />
CN - H<br />
CN<br />
CN<br />
R<br />
R<br />
R<br />
R<br />
pK s =9.2<br />
H<br />
H<br />
H<br />
Cyanhydrin<br />
(basenlabil)<br />
Strecker-Synthese:<br />
H - H 2 O H<br />
H<br />
H<br />
Aminonitril<br />
H 3 O<br />
H 3 O<br />
OH<br />
COOH<br />
R<br />
H<br />
α-Hydroxysäure<br />
NH 2<br />
R<br />
COOH<br />
H<br />
α-Aminosäure<br />
O<br />
1. HCN<br />
2. H 3 O<br />
COOH<br />
Methacrylsäure<br />
O<br />
H<br />
1. HCN<br />
2. H 3 O<br />
OH<br />
COOH<br />
Mandelsäure (rac.)<br />
H<br />
O<br />
Phenylacetaldehyd<br />
1. HCN, NH 3<br />
2. H 3 O<br />
NH 2<br />
COOH<br />
Phenylalanin (rac.)<br />
8.2.2. Addition von Acetyliden (Ethinylierung)<br />
H C C H<br />
NaNH 2<br />
pK s =26<br />
O<br />
NH<br />
fl. NH 3<br />
3<br />
1.<br />
OH<br />
Na C C H<br />
2. H<br />
pK s =36<br />
2 O<br />
pK s =18<br />
H 2<br />
Lindlar-Kat<br />
OH<br />
H 3 O<br />
-H 2 O<br />
Isopren<br />
(Naturkautschuk)<br />
O<br />
1. NaCCH<br />
2. H 2 O<br />
OH<br />
HO<br />
Östron<br />
HO<br />
17-Ethinylöstradiol<br />
(östrogene Komp. der "Pille")
8.2.3. Aldolreaktion<br />
Basische Katalyse:<br />
a) enolisierbare<br />
Aldehyde<br />
H<br />
O<br />
OH<br />
H<br />
pK s = 20<br />
H<br />
O<br />
+ H 2 O<br />
Enolat<br />
pK s = 15.7<br />
O<br />
H<br />
O O<br />
H<br />
Alkoholat<br />
pK s = 18<br />
+ H 2 O<br />
H<br />
O<br />
OH<br />
Acetaldol(50%)<br />
ß-Hydroxyalkohol<br />
+ OH<br />
b) Ketone<br />
O<br />
O Ba(OH) 2 (kat.) O<br />
O O<br />
Retro-Aldol bevorzugt<br />
H<br />
O<br />
OH<br />
Diacetonalkohol<br />
hohe Ausbeuten nur bei<br />
Entfernen des Produkts vom<br />
basischen Katalysator<br />
c) bei erhöhter Temperatur u. Basenkonzentration: Eliminierung<br />
H<br />
O<br />
OH<br />
+ OH<br />
- H 2 O<br />
H<br />
O<br />
OH<br />
H<br />
O<br />
OH<br />
E1cB<br />
H<br />
O<br />
+OH<br />
α,β-ungesättigte<br />
Carbonylverbindung<br />
Saure Katalyse:<br />
O<br />
H<br />
O<br />
H<br />
O<br />
H -H<br />
O<br />
H<br />
O<br />
H<br />
O<br />
H<br />
OH<br />
-H<br />
O<br />
OH<br />
H<br />
Enol<br />
Folgereaktion:<br />
O OH H O OH 2<br />
-H 2 O O<br />
-H<br />
O<br />
Mesityloxid
Gekreuzte Aldolreaktion:<br />
H<br />
O<br />
H<br />
H<br />
H<br />
+ OH<br />
3 acide H<br />
(Methylenkomponente)<br />
H<br />
O<br />
+HOH<br />
H<br />
O<br />
H<br />
O<br />
2<br />
OH O H H HO O<br />
H<br />
H<br />
HO<br />
+ OH + OH<br />
HO<br />
O<br />
H<br />
+<br />
O<br />
OH<br />
OH O Aldehyd langsam zutropfen<br />
sonst Selbstaldolisierung v. Acetaldehyd (Produktgemisch)<br />
bei unsymmetrischen Ketonen<br />
mehrere Reaktionsmöglichkeiten<br />
O<br />
H<br />
OH<br />
CHO<br />
O<br />
H<br />
- H 2 O<br />
O<br />
verzweigtes Produkt<br />
bei Säurekatalyse<br />
stabileres Enol<br />
OH<br />
O<br />
CHO<br />
OH<br />
O OH - H 2 O O<br />
unverzweigtes Produkt<br />
bei Basenkatalyse<br />
O<br />
OH<br />
kinetisch bev. Enolat<br />
E1cB<br />
OH<br />
O<br />
CHO<br />
H<br />
O<br />
-OH<br />
O<br />
stabileres Enolat<br />
OH<br />
langsam<br />
(Rückreaktion<br />
bevorzugt)
O<br />
OH<br />
HCl<br />
O<br />
+<br />
CHO<br />
+<br />
O<br />
Nachweis der<br />
gekoppelten<br />
Gleichgewichte<br />
durch Umsetzung der<br />
isolierten Intermediate:<br />
unverzweigtes Aldol<br />
O<br />
NaOH<br />
HCl<br />
O<br />
O<br />
+ CHO +<br />
+ CHO +<br />
O<br />
O<br />
OH<br />
verzweigtes Aldol<br />
NaOH<br />
CHO<br />
+<br />
O<br />
8.2.4. Addition weiterer C-H acider Verbindungen<br />
a) Perkin-Synthese (mit aromatischen Aldehyden)<br />
H<br />
O<br />
O<br />
O<br />
- H<br />
Base<br />
(Pyridin,<br />
AcONa)<br />
O<br />
O<br />
O<br />
- AcO<br />
CHO<br />
OH<br />
O<br />
O<br />
O<br />
Ac 2 O<br />
- AcOH<br />
H<br />
B<br />
OAc<br />
O<br />
OAc<br />
- BH<br />
- AcOH<br />
O<br />
OAc<br />
H 2 O, - AcOH<br />
O<br />
b) Nitrile als CH-acide Komponente<br />
KOH<br />
H 3 C CN<br />
pK s = 25 - H 2 O<br />
H 2 C<br />
CN<br />
CHO<br />
OH<br />
CN<br />
OH<br />
- H 2 O<br />
CN<br />
Zimtsäurenitril<br />
OH<br />
Zimtsäure
c) Glycidester nach Darzens<br />
Cl O<br />
H OEt<br />
NaOEt<br />
Cl<br />
O<br />
OEt<br />
CHO<br />
Cl<br />
O<br />
COOEt<br />
-Cl<br />
O<br />
Glycidester<br />
COOEt<br />
d) Picoline u. Cyclopentadien als CH-acide Komponenten<br />
N<br />
α-Picolin<br />
H<br />
HO<br />
N<br />
CH 3 CHO<br />
N<br />
OH<br />
HO<br />
- H 2 O<br />
N<br />
4 H 2<br />
Pd<br />
N<br />
H<br />
Coniin (R,S)<br />
O<br />
KOH<br />
-HO<br />
H H<br />
pK s = 16<br />
H<br />
H<br />
O<br />
OH<br />
Fulven<br />
e) Synthese von Chloramphenicol (Antibiotikum) durch Nitroaldolreaktion:<br />
O<br />
O<br />
N +<br />
H<br />
OH<br />
OH<br />
O<br />
O<br />
N +<br />
OH<br />
CHO<br />
O 2 N<br />
OH<br />
OH<br />
Pd/H 2<br />
H 2 N<br />
OH<br />
OH<br />
2-Hydroxynitroethan<br />
pK s = 10<br />
Nitronat<br />
(analog Enolat)<br />
Cl 2 HC<br />
1. Ac 2 O, H<br />
AcHN OAc<br />
2. NO 2<br />
O 2 N<br />
OAc<br />
OH<br />
O 2 N<br />
H 2 N<br />
OH<br />
OH<br />
O<br />
MeO CHCl 2<br />
- MeOH<br />
O 2 N<br />
O<br />
HN<br />
OH<br />
OH<br />
Chloramphenicol
8.2.5. Knoevenagel-Kondensation (ß-Dicarbonylverb. + Aldehyd o. Keton):<br />
EtOOC<br />
EtOOC<br />
pK s = 13<br />
H<br />
H<br />
Kat.<br />
- H<br />
EtO<br />
EtOOC<br />
O<br />
Esterenolat<br />
O<br />
EtOOC<br />
H<br />
EtOOC<br />
Kat. = Amin (Piperidin, Pyridin, NH 3 ) + Carbonsäure<br />
O<br />
EtOOC<br />
EtOOC<br />
OH<br />
-OH<br />
EtOOC<br />
EtOOC<br />
Isopropylidenmalonsäurediethylester<br />
NC<br />
H<br />
H<br />
NC<br />
Malononitril<br />
pK s = 11.2<br />
+<br />
O<br />
Ammoniumacetat<br />
- H 2 O<br />
NC<br />
NC<br />
Isopropylidenmalononitril<br />
(90 %)<br />
CHO<br />
+<br />
COOH<br />
COOH<br />
Pyridin,<br />
Piperidin<br />
- H 2 O<br />
COOH<br />
COOH<br />
ΔT<br />
-CO 2<br />
Zimtsäure<br />
COOH<br />
8.2.6. Mannich-Reaktion<br />
(Amin + Aldehyd + Keton + H ):<br />
Me 2 NH x HCl<br />
+<br />
H 2 CO<br />
+<br />
O<br />
H<br />
HCl x Me 2 N<br />
H<br />
H<br />
O<br />
Mechanismus:<br />
+ H Iminiumion<br />
H<br />
H OH - H 2 O H<br />
H<br />
O + NHMe 2 N<br />
H NMe H<br />
2<br />
H<br />
H H O<br />
H H<br />
-H<br />
O<br />
O<br />
+<br />
OH<br />
Enol<br />
Me 2 N<br />
Me 2 N<br />
x HCl<br />
Salz der Mannich-Base
O<br />
+ H 2 CO<br />
+ Me 2 NH x HCl<br />
H<br />
-H 2 O<br />
OH<br />
H<br />
H<br />
N<br />
O<br />
O<br />
O<br />
Base, #T<br />
H<br />
E1cB<br />
H H<br />
H H<br />
x HCl<br />
NHMe<br />
H<br />
2<br />
Enon<br />
+ Me 2 NH x HCl<br />
CHO<br />
N<br />
H<br />
CHO<br />
-H 2 O<br />
N<br />
OH<br />
H -H<br />
N<br />
CHO<br />
Indol<br />
NMe 2<br />
N<br />
H<br />
H 2 CO<br />
H<br />
NMe<br />
N<br />
2<br />
H<br />
x HCl<br />
Me 2 NH x HCl N<br />
H<br />
Gramin<br />
8.2.7. Acyloinkondensation + Umpolung<br />
O<br />
H<br />
Carbonyl-C<br />
elektrophil<br />
CN<br />
O<br />
H<br />
CN<br />
OH<br />
OH<br />
C<br />
C<br />
N<br />
N<br />
Carbanion<br />
nukleophil<br />
"umgepolter Benzaldehyd"<br />
H<br />
O<br />
N<br />
C<br />
O<br />
H<br />
O<br />
Cyanhydrin<br />
(basenlabil)<br />
- CN<br />
O<br />
Benzoin<br />
OH<br />
(Acyloin)<br />
8.2.8. Olefinierungen nach Horner-Wadsworth-Emmons (HWE) und nach Wittig<br />
a) HWE<br />
P(OEt) 3<br />
R<br />
X<br />
-Et-X<br />
(Michaelis-<br />
Arbuzov)<br />
H O<br />
OEt<br />
P<br />
R OEt<br />
Phosphonat<br />
NaH<br />
O<br />
P<br />
-H 2 R<br />
OEt<br />
OEt<br />
R<br />
O<br />
P OEt<br />
OEt<br />
Phosphonatcarbanion<br />
(nukleophiler als analoges<br />
Wittig-Reagenz)
Mech:<br />
O<br />
EtO OEt<br />
P O<br />
H<br />
O<br />
EtO OEt<br />
P O<br />
O<br />
EtO<br />
OEt<br />
P O<br />
[2+2 CR]<br />
+<br />
O<br />
OEt<br />
P OEt<br />
O<br />
Stilben (trans)<br />
Diethylphosphat<br />
b) Wittig<br />
R X H Ph<br />
PPh P Ph<br />
3<br />
R<br />
Ph<br />
X -<br />
Ph-Li<br />
(NaH)<br />
- Ph-H<br />
(- H 2 )<br />
R<br />
Ph<br />
P<br />
Ph<br />
Ylid<br />
Ph<br />
R<br />
Ph<br />
P Ph<br />
Ph<br />
Ylen<br />
Wittig-Reagenz<br />
Mech:<br />
O<br />
Ph<br />
Ph<br />
P<br />
Ph<br />
[2+2 CA]<br />
O<br />
Ph<br />
P<br />
Ph<br />
Ph<br />
[2+2 CR]<br />
+<br />
O<br />
Ph<br />
P Ph<br />
Ph<br />
α-Methylstyrol<br />
Triphenylphosphinoxid<br />
PPh 3<br />
Na-H<br />
O<br />
- H 2 PPh 3<br />
OAc<br />
1<br />
11<br />
OR<br />
5<br />
R = H Vitamin A 1 Retinol<br />
R = Ac<br />
R = H<br />
OH
8.2.9.Esterkondensation (Claisen-Kondensation)<br />
O<br />
OEt<br />
+<br />
O<br />
25 OEt<br />
EtO ΔT O O<br />
OEt<br />
Acetessigester<br />
+ EtOH<br />
O<br />
OEt<br />
+<br />
20<br />
O EtO ΔT O O<br />
Acetylaceton<br />
+ EtOH<br />
O<br />
OEt<br />
+<br />
25<br />
N<br />
EtO ΔT<br />
O<br />
N<br />
+ EtOH<br />
Mechanismus:<br />
+ EtOH<br />
EtO<br />
H<br />
25<br />
O<br />
OEt<br />
+ EtOH 18<br />
O<br />
OEt<br />
O<br />
OEt<br />
+ EtOH<br />
O O<br />
OEt<br />
OEt<br />
O<br />
+ EtO<br />
11<br />
H<br />
O<br />
OEt<br />
Na<br />
O<br />
Na<br />
O<br />
OEt<br />
Reaktionsprodukt<br />
energieärmer als Edukt<br />
H<br />
(Aufarb.)<br />
O<br />
O<br />
OEt<br />
keine Claisen-Kondensation ohne Enolatbildung im Produkt:<br />
O<br />
O O<br />
EtO<br />
2<br />
OEt<br />
25 OEt<br />
+ EtOH 18<br />
Gleichgewichtsbedingungen<br />
Trick: stärkere Base<br />
O Na-H<br />
-H 2<br />
25 OEt<br />
O<br />
OEt<br />
quant.<br />
Enolatbildung<br />
O<br />
OEt<br />
O<br />
O<br />
+ EtO<br />
OEt
Beisp.:<br />
25<br />
O<br />
OEt<br />
+<br />
O 1. EtO O O<br />
- EtOH<br />
20<br />
2. H<br />
EtO<br />
O<br />
OEt<br />
+<br />
O<br />
OEt<br />
1. EtO<br />
- EtOH<br />
2. H<br />
EtO<br />
O<br />
O<br />
OEt<br />
(86 %)<br />
Benzoylaceton<br />
(50 %)<br />
Phenylmalonsäurediethylester<br />
O<br />
EtO<br />
O<br />
OEt<br />
+<br />
O<br />
OEt<br />
1. EtO<br />
- EtOH<br />
2. H<br />
EtO<br />
O<br />
O<br />
COOEt<br />
(85 %)<br />
ΔT<br />
- CO<br />
EtO<br />
O<br />
O<br />
OEt<br />
(67 %)<br />
H<br />
H<br />
Phenylmalonsäurediethylester<br />
H<br />
O<br />
OEt<br />
+<br />
O<br />
1. EtO<br />
- EtOH<br />
2. H<br />
O<br />
O<br />
Formyltautomer (
Biosynthese von Fettsäuren:<br />
Acetyl-CoA<br />
HOOC<br />
Malonyl-CoA<br />
O<br />
O<br />
S-CoA<br />
S-CoA<br />
HS<br />
HS<br />
(Multienzymkomplex)<br />
- 2 HS-CoA<br />
O<br />
O<br />
O<br />
O<br />
S<br />
S<br />
Red.<br />
O<br />
HO<br />
O<br />
O<br />
HS<br />
S<br />
S<br />
O S O<br />
S<br />
Red.<br />
Red.2<br />
Elim.<br />
8.2.10. Alkylierung u. Acylierung von β-Dicarbonylverbindungen<br />
Elim.<br />
Red.2<br />
a) Alkylierung<br />
O<br />
O<br />
1. NaOEt<br />
O<br />
Na<br />
O<br />
2. Et-Br O O<br />
3. NaOEt<br />
- EtOH<br />
O<br />
O<br />
OEt<br />
-EtOH<br />
OEt<br />
- NaBr<br />
OEt<br />
4. MeI<br />
- NaI<br />
OEt<br />
O COOEt O Pr<br />
COOEt<br />
NaOEt<br />
EtOOC<br />
2 NaOEt<br />
EtOOC<br />
NC<br />
NaOEt<br />
Et-Br<br />
NC<br />
Et<br />
Pr-Br<br />
EtOOC<br />
EtOOC<br />
(85 %) Br Br<br />
(45 %)<br />
b) C-Acylierung<br />
O O<br />
OEt<br />
1. Mg(OEt) 2<br />
- EtOH<br />
O<br />
OEt<br />
Mg<br />
O<br />
2.<br />
OEt<br />
3. H<br />
O<br />
Cl<br />
O<br />
O<br />
O<br />
OEt<br />
O<br />
O<br />
mit Pyridin als Base<br />
O-Acylierung<br />
O<br />
OEt
8.2.11. Esterspaltung (Retro-Claisen)<br />
Claisen-Kondensation reversibel: β-Ketoesterspaltung mit Alkoholat<br />
(sehr leicht bei α,α-disubst. ß-Dicarbonylverb)<br />
O<br />
O<br />
EtOH, ΔT<br />
EtO<br />
O<br />
O<br />
O<br />
EtOH<br />
O<br />
O<br />
OEt<br />
OEt<br />
OEt<br />
+<br />
OEt<br />
OEt<br />
EtO<br />
EtO<br />
O EtOH, ΔT O OEt<br />
COOEt H COOEt<br />
EtOH, ΔT<br />
EtOOC<br />
O<br />
H<br />
EtOOC<br />
O<br />
bildet kein stab. Enolat<br />
Esterspaltung<br />
+ EtO<br />
Dieckmann<br />
stab. Enolat<br />
O<br />
O<br />
OEt<br />
NaOH, EtOH<br />
O<br />
O<br />
OEt<br />
EtO<br />
O<br />
OEt<br />
+<br />
O<br />
OEt<br />
+ EtO<br />
O<br />
OH<br />
größerer Rest<br />
enolisiert bevorzugt<br />
O<br />
(70 %)<br />
Benzoylessigsäureethylester<br />
8.2.12. Säurespaltung von β-Diketonen (Säure wird gebildet)<br />
O<br />
O<br />
HO<br />
HO<br />
O<br />
O<br />
HOOC<br />
O<br />
H<br />
HOOC<br />
O<br />
analog<br />
Retro-Aldol<br />
(50%)
8.2.13. Direkte Alkylierung von Esterenolaten<br />
H<br />
O<br />
25<br />
OEt<br />
Li<br />
N<br />
(LDA)<br />
-78°C<br />
(quant.)<br />
+<br />
O-Li<br />
OEt<br />
HN<br />
35<br />
H 3 C<br />
I<br />
O<br />
OEt<br />
H 3 C<br />
(87 %)<br />
Pivalinsäuremethylester<br />
a) Keine Claisen-Kondensation,da Ester zur Base gegeben wird<br />
(quant. Enolatbildung wg. starker Base)<br />
b) Keine Amidbildung des Esters wg. sterisch anspruchsvollem Amin<br />
c) Produkt nicht über Malonestersynthese zugänglich<br />
8.2.14. Aldolreaktion mit Esterenolaten<br />
ÜZ der E-Enolatbildung<br />
O<br />
OEt<br />
LDA<br />
-78°C<br />
(quant.)<br />
O-Li<br />
OEt<br />
E-Enolat<br />
CH 3 CHO<br />
OH<br />
O<br />
OEt<br />
OEt<br />
Li<br />
N H O CH 3<br />
H
8.3. Reaktionen von Carbonylverb. mit Organometallverbindungen<br />
8.3.1. Grignard-Verbindungen<br />
1. Darstellung<br />
Et<br />
Et Br<br />
Et 2 O Et Br<br />
Mg Mg Mg-Br<br />
Et 2 O OEt 2<br />
Mg<br />
Et Br<br />
(lösl. in Ether)<br />
(Oberfläche)<br />
Iodide reaktiver als Bromide > Chloride<br />
2. Komplexierung in Lösung und im Kristall durch Lösungsmittel<br />
R<br />
R<br />
O<br />
Et<br />
Mg<br />
Br<br />
O<br />
R<br />
R<br />
a) EtMgBr[O(Et) 2 ] 2 (monomer) b) EtMgBr[O(i-Pr) 2 ] 2 (dimer)<br />
ROR = THF, Diethylether,<br />
Diisopropylether<br />
X L<br />
L<br />
R Mg Mg<br />
X R<br />
Dimer<br />
L = Donorlösungsmittel<br />
2<br />
R Mg X<br />
R Mg R + MgX 2<br />
Monomer<br />
Dialkylmagnesium<br />
Schlenk-Gleichgewicht<br />
Ether, THF<br />
Dioxan, Et 3 N<br />
X L<br />
R<br />
R Mg Mg<br />
X L
3. Grignard-Verbindungen (Mg = Lewis-Säure; R - = Base + Nukleophil) reagieren mit:<br />
a) acidem Wasserstoff (H 2 O, Alkohole, Phenole, Thiole, Amine, Amide, Säuren etc.)<br />
Et-O-H Ph-Mg-Br<br />
Ph-H + MgBr(OEt)<br />
18<br />
37<br />
H 3 C H H 3 C-Mg-Br H 3 C Mg-Br + H 3 C-H<br />
25 48<br />
Quantitative Best. von aktivem Wasserstoff<br />
nach Zerevitinov (volumetrisch)<br />
b) Metallsalzen (Transmetallierung zum edleren Metall)<br />
2 Ph-Mg-Br + CdCl 2 CdPh 2 + 2 MgClBr<br />
2 Et-Mg-Br + ZnCl 2 ZnEt 2 + 2 MgClBr<br />
L<br />
Br<br />
Mg<br />
R<br />
Cl<br />
M<br />
Cl<br />
L<br />
c) Elektrophilen: Alkylhalogenide, Epoxide etc.<br />
3<br />
+<br />
Cl<br />
Cl<br />
H<br />
Cl<br />
MgBr<br />
Br<br />
S N 2 S<br />
Br<br />
N 2<br />
H<br />
+<br />
MgBr<br />
Br<br />
MgBr<br />
+<br />
Ph<br />
Mg<br />
O<br />
Br<br />
S N 2<br />
O-MgBr<br />
+<br />
Mg<br />
Br<br />
Ph<br />
OH<br />
MgBr<br />
Et<br />
+<br />
F<br />
O<br />
N<br />
F<br />
2 x S N Ar<br />
Et<br />
O<br />
N<br />
Et<br />
+ 2 MgBrF
d) Carbonylverbindungen<br />
X<br />
Mg<br />
R<br />
O R O MgX<br />
ternärer Mech.:<br />
C<br />
O<br />
R X<br />
Mg<br />
X<br />
Mg<br />
C<br />
O<br />
R<br />
Mg<br />
+MgX 2<br />
R<br />
H 2 O C +MgX 2<br />
OH<br />
+Mg(X)OH<br />
R(X)<br />
R(X)<br />
MgBr<br />
H<br />
O<br />
H<br />
CH 2 OH<br />
prim. ROH<br />
MgBr<br />
O<br />
H<br />
OH<br />
sek. ROH<br />
Et<br />
MgBr<br />
+<br />
O<br />
OH<br />
tert. ROH<br />
Me<br />
MgBr<br />
O<br />
OEt<br />
O<br />
Me<br />
MgBr<br />
OH<br />
tert. ROH<br />
MgBr<br />
+ CO 2<br />
COOH<br />
Carbonsäure<br />
MgBr<br />
+<br />
OMe<br />
N<br />
N MgBr<br />
OMe<br />
H 3 O<br />
O<br />
OMe<br />
MgBr<br />
H-C(OEt) 3<br />
Pent<br />
Br<br />
Mg<br />
OEt<br />
H<br />
OEt<br />
OEt<br />
OEt<br />
OEt<br />
H 3 O<br />
CHO
Bei Estern:<br />
Weiterreaktion<br />
zum Alkohol<br />
EtO<br />
C<br />
O<br />
R<br />
Mg<br />
R<br />
Mg<br />
X<br />
X<br />
+R-MgX<br />
R<br />
C<br />
EtO<br />
O<br />
Mg<br />
X<br />
C<br />
O<br />
R<br />
Keton reaktiver<br />
als Ester<br />
+R-MgX<br />
+EtO-MgX<br />
R<br />
C<br />
OH<br />
R<br />
Alkohol<br />
(Endprodukt)<br />
8.3.2. Organolithiumverbindungen (reaktiver als R-Mg-X, besser zur Umsetzung v. unreaktiven Substraten)<br />
Darstellung R-X + 2 Li R-Li + LiX<br />
Br<br />
2 Li<br />
Li<br />
+ LiBr<br />
R'-X + R-Li<br />
R'-Li + R-X<br />
Br<br />
Bu-Li<br />
Li<br />
+ Bu-Br<br />
R'-H + R-Li<br />
R'-Li + RH<br />
H<br />
Bu-Li<br />
Li<br />
+ H-Bu<br />
Rkt. mit Carbonsäuren zu Ketonen<br />
COOH<br />
Me-Li<br />
-CH 4<br />
O<br />
OLi<br />
Me-Li<br />
OLi<br />
OLi<br />
H 2 O<br />
O<br />
Reaktivitätserhöhung von Li-Organylen durch TMEDA (N,N,N',N'-Tetramethylethylendiamin):<br />
(n-Bu-Li) 6<br />
(n-Bu-Li) 6 NMe 2<br />
+ 6<br />
NMe 2<br />
(TMEDA)<br />
3<br />
n-Bu<br />
Li<br />
N<br />
N<br />
2<br />
6<br />
37<br />
H<br />
N<br />
3<br />
Li<br />
N<br />
+ 6 n-Bu H 48<br />
2
8.3.3. Organokupferverbindungen<br />
Darstellung:<br />
R-Li + Cu I -X<br />
- LiX<br />
R-Li<br />
R-Cu R Cu R Li R Cu R<br />
Kupferorganyl<br />
Lithiumdialkylcuprat<br />
Li<br />
Reaktionen:<br />
HO<br />
H 2 O<br />
BrMgO<br />
Me-MgBr<br />
(Me-Li)<br />
1 O<br />
Me 2 CuLi<br />
OLi<br />
H 2 O<br />
O<br />
1,2-Addition<br />
4<br />
1,4-Addition<br />
(konjugate Addition)<br />
O<br />
Cl<br />
+<br />
Me 2 CuLi<br />
-78 °C<br />
O<br />
(81 %)<br />
+ LiCl + CuMe<br />
Li (1%Na)<br />
CuI, -78°C<br />
Oct-I<br />
(90 %)<br />
Cl<br />
Li<br />
2<br />
CuLi<br />
Oct<br />
8.3.4. Organozinkverbindungen<br />
2 Et-I + 2 Zn<br />
- ZnI 2<br />
Et<br />
Zn<br />
Et<br />
H<br />
O<br />
HO<br />
Reformatsky-Synthese<br />
Br<br />
COOEt<br />
Zn<br />
THF<br />
Br<br />
EtO<br />
O<br />
Zn<br />
Zn<br />
O<br />
OEt<br />
Br<br />
THF<br />
O<br />
HO<br />
COOEt
8.4. Reduktionen von Carbonylverbindungen<br />
8.4.1. Reduktion mit komplexen B- und Al-Hydriden: Hydridüberträger.: LiAlH 4 , NaBH 4 , H-Al(iBu) 2 = DIBAL-H<br />
H<br />
Li H Al H<br />
O H O<br />
H<br />
+ AlH 3 + Li<br />
H OAlH 3<br />
Li<br />
Gesamtreaktion:<br />
LiAlH 4<br />
+ 4 O<br />
Li Al O H<br />
4<br />
2 H 2 O<br />
4 HO H + LiAlO 2<br />
Hydrid (LiAlH 4 ) reagiert primär<br />
mit acidem H zu H 2<br />
H 2 O, HOR, RCOOH, R-CO-CH 2 -CO-R, R-CO-NH 2<br />
Li-AlH 4 + 4 H-OR Li-Al(OR) 4 + 4 H-H LiAlH 4 in abs. LM<br />
NaBH 4 reduziert<br />
Aldehyde u. Ketone in H 2 O:<br />
OH<br />
HO O<br />
HO<br />
OH<br />
OH<br />
Glucose-(Halbacetal)<br />
HO<br />
HO<br />
OH<br />
OH<br />
OH<br />
O<br />
NaBH 4<br />
H 2 O<br />
OH<br />
HO OH<br />
HO<br />
OH<br />
OH<br />
Sorbitol (Süßstoff)<br />
Stöchiometrie der<br />
LiAlH 4 -Reduktion<br />
O<br />
R R<br />
O<br />
R OR'<br />
O<br />
R OH<br />
O<br />
R NH 2<br />
LiAlH 4<br />
R<br />
OH<br />
R<br />
H<br />
R CH 2<br />
OH<br />
0.25<br />
0.5<br />
R CH 2 NH 2 1.0<br />
R CH 2 OH 0.75<br />
Verbrauch LiAlH 4<br />
(mol/ 1 mol Carbonylverb.)
Ester<br />
Amide<br />
O AlH 3<br />
R H<br />
OR'<br />
Li<br />
O<br />
AlH 3<br />
R H<br />
N H - H-H<br />
R'<br />
Li<br />
R<br />
R<br />
O<br />
N<br />
R'<br />
AlH 3<br />
O<br />
H<br />
OR'<br />
AlH 2<br />
H<br />
R<br />
R'<br />
R<br />
O<br />
N<br />
R'O<br />
AlH 2<br />
O<br />
H<br />
H<br />
AlH 2<br />
H<br />
Li<br />
H 2 O<br />
R<br />
R'<br />
N<br />
R CH 2 OH<br />
Li<br />
O<br />
H<br />
AlH<br />
H<br />
H 2 O<br />
R CH 2 NHR'<br />
H<br />
N<br />
LiAlH 4<br />
H<br />
N<br />
LiAlH 4<br />
NH 2<br />
O<br />
CN<br />
Chemoselektivität<br />
O<br />
O<br />
NaBH 4 OH O<br />
NaBH 4<br />
OH<br />
OEt<br />
schnell<br />
OEt<br />
langsam<br />
OH<br />
O<br />
O<br />
NaBH 4<br />
OH O<br />
NHEt<br />
NHEt<br />
MeO<br />
MeO<br />
N<br />
Et<br />
COOEt<br />
H<br />
Al<br />
iBu<br />
iBu<br />
(DIBALH)<br />
Toluol<br />
-60°C<br />
MeO<br />
MeO<br />
iBu<br />
iBu<br />
Al<br />
N<br />
O<br />
Et<br />
H<br />
OEt<br />
H 2 O<br />
MeO<br />
MeO<br />
N<br />
Et<br />
CHO<br />
stabil in unpolaren LM + bei tiefen Temp.
Stereoselektivität bei Reduktion von α-chiralen Carbonylverbindungen:<br />
Grund: Felkin-Anh-Modell<br />
H<br />
CH 3<br />
H CH 3<br />
LiAlH 4<br />
H<br />
CH 3<br />
H 3 C<br />
CH3<br />
H<br />
H<br />
CH 3<br />
O<br />
H OH<br />
HO<br />
74 % 26 %<br />
8.4.2. Katalytische Hydrierung von Carbonylverbindungen<br />
H<br />
O<br />
H<br />
ungünstig<br />
H 3 C<br />
O<br />
günstiger<br />
Übergangszustand<br />
N<br />
Ra-Ni,<br />
H 2 N<br />
N<br />
H 2 , 100 atm<br />
90°C<br />
NH 2<br />
O<br />
O<br />
OEt<br />
Ra-Ni, OH O<br />
H 2 , 100 atm<br />
90°C<br />
OEt<br />
Ester, Amide, Carbonsäuren<br />
inert<br />
Reduktive Aminierung<br />
O<br />
- H 2 O<br />
+ MeNH 2 N<br />
(Überschuß)<br />
Me<br />
Ra-Ni,<br />
H 2 , 100 atm<br />
90°C<br />
N<br />
Me<br />
H<br />
8.4.3. C-Hydrid-Reduktionen<br />
Cannizzaro-Rkt.:<br />
(Disproportionierung von<br />
nicht enolisierbaren Aldehyden)<br />
2 CHO<br />
OH<br />
CH 2 OH<br />
+<br />
COO
Mech.:<br />
H<br />
C<br />
O<br />
H<br />
C<br />
O<br />
Na<br />
OH<br />
H<br />
H<br />
HOOC<br />
+<br />
ONa<br />
CH 2 OH<br />
NaOOC<br />
+<br />
gekreuzte Cannizzaro:<br />
MeO CHO + CH 2 O MeO CH 2 OH<br />
OH<br />
+ HCOOH<br />
3 CH 2 O +<br />
H<br />
H<br />
H<br />
O<br />
H<br />
OH<br />
3x Aldol<br />
HO<br />
HO<br />
OH<br />
O<br />
H<br />
kein α-H<br />
CH 2 O, OH<br />
Cannizz.<br />
HO<br />
HO<br />
OH<br />
OH<br />
Pentaerythritol<br />
+ HCOOH<br />
Leuckart-Wallach:<br />
O<br />
R'-NH 2<br />
+<br />
+ HCOOH<br />
(Reduktionsmittel)<br />
R<br />
HN R' + CO 2<br />
R<br />
Mech.:<br />
O<br />
NH 2<br />
Bu<br />
HCOOH, H<br />
-H 2 O<br />
H<br />
C<br />
N O<br />
Bu H<br />
H<br />
O<br />
Bu<br />
H<br />
NH<br />
+ CO 2 + H<br />
Bu NH 2 + H 2 CO<br />
HCOOH<br />
-CO 2<br />
Bu N<br />
H<br />
Me<br />
HCOOH, H 2 CO<br />
-CO 2<br />
Bu N<br />
Me<br />
Me
8.4.4. Wolff-Kizner Reduktion<br />
O<br />
H 2 N-NH 2<br />
OH , ΔT<br />
R<br />
R'<br />
-N 2<br />
R<br />
R'<br />
8.4.5. Reduktion durch unedle Metalle<br />
a. Clemmensen-Reduktion<br />
O<br />
Zn (Hg)<br />
OH<br />
O<br />
Zn (Hg)<br />
OH<br />
R<br />
R'<br />
HCl<br />
R<br />
R'<br />
HCl<br />
b. Pinakolsynthese<br />
2<br />
O<br />
Mg<br />
OH<br />
OH<br />
1,2-Diol<br />
Mech.:<br />
2<br />
O<br />
R'<br />
R<br />
Mg<br />
R<br />
O<br />
R'<br />
Mg<br />
R<br />
O<br />
R'<br />
R<br />
Mg<br />
O O<br />
R' R<br />
R'<br />
H 2 O<br />
- Mg (OH) 2<br />
R<br />
OH<br />
R'<br />
OH<br />
R<br />
R'<br />
Ketylradikal<br />
c. Bouveault-Blanc-Reduktion (Ester + Na + unreaktiver Alkohol)<br />
R<br />
O<br />
OR'<br />
2 Na<br />
O ROH<br />
R OR'<br />
Dianion<br />
R<br />
O<br />
H<br />
OR'<br />
- R'O<br />
R<br />
O<br />
H<br />
2 Na<br />
R<br />
O<br />
H<br />
ROH<br />
R<br />
H<br />
H<br />
OH
Beisp.:<br />
COOEt<br />
CH 2 OH<br />
(70 %)<br />
Na-Suspension in Xylol, i-Propanol<br />
8.5. Reaktionen vinyloger Carbonylverbindungen<br />
Vinylogie:<br />
nu<br />
nu<br />
O O O O<br />
el<br />
el<br />
Weitergabe der Polarität (C=O, OR, NR 2 ) über konjugiertes System (Olefin, Aromat)<br />
a) 1,4-Addition von Heteroatomnukleophilen an α,β-ungesättigte Carbonylverbindungen<br />
Reaktivität: O O<br />
><br />
> > O > O<br />
N<br />
OR<br />
NHR<br />
1,2-Addition meist reversibel (Carbonylreaktion) u. kinetisch bevorzugt<br />
Me-NH 2<br />
O<br />
schnell<br />
NH 2 Me<br />
O<br />
R<br />
R<br />
1,4-Addition meist irreversibel (Eliminierung nur mit starker Base) u. thermodynamisch bevorzugt<br />
H H O<br />
H H<br />
langsam<br />
Me-NH O<br />
N O<br />
N<br />
2<br />
O<br />
pK s = 20<br />
N<br />
COMe<br />
COMe
Me-SH<br />
+<br />
O<br />
S<br />
O<br />
1. NH 3 , HCN/KCN<br />
2. H 3 O<br />
S<br />
Strecker<br />
NH 2<br />
COOH<br />
Methionin<br />
H<br />
Br<br />
+<br />
N<br />
Br<br />
N<br />
Anti-Markovnikov-Addition<br />
Skraup'sche Chinolinsynthese<br />
NH 2<br />
(H )<br />
O<br />
O<br />
N<br />
H<br />
OH<br />
(H )<br />
(H ), - H 2 O<br />
Ox.<br />
S E Ar N Elim.<br />
N ( - H 2 )<br />
H<br />
H<br />
N<br />
Chinolin<br />
b) 1,4-Addition von C-H aciden Verbindungen an α,β-ungesättigte Carbonylverbindungen (Michael-Addition)<br />
EtOOC<br />
EtOOC<br />
EtO -<br />
- EtOH<br />
O<br />
O<br />
OEt<br />
OEt<br />
CN<br />
+ H<br />
EtOOC<br />
EtOOC<br />
CN<br />
CN<br />
(RO )<br />
EtOOC<br />
EtOOC<br />
CN<br />
CN<br />
Beisp.: Synthese von Dimedon<br />
EtOOC<br />
EtOOC<br />
+<br />
O<br />
Mesityloxid<br />
(aus Aceton)<br />
OEt<br />
H<br />
EtO O<br />
O<br />
EtOOC<br />
O<br />
+<br />
OEt<br />
- EtOH O<br />
Michael-<br />
OEt<br />
Addition EtOOC<br />
- EtOH
EtO<br />
O<br />
O<br />
OEt<br />
O<br />
-EtO -<br />
Claisen-<br />
Kondensation<br />
O<br />
EtOOC<br />
O<br />
(HO )<br />
- EtOH<br />
H<br />
O<br />
O<br />
O<br />
O<br />
ΔT<br />
-CO 2<br />
O<br />
O<br />
Dimedon<br />
Nachweis von Aldehyden mit Dimedon<br />
O<br />
O<br />
O<br />
O<br />
H<br />
H<br />
(OH ), -H 2 O<br />
Knoevenagel-<br />
Kondensation<br />
O<br />
O<br />
CH 2<br />
O<br />
Michael-<br />
Addition<br />
+ H<br />
O<br />
O<br />
CH 2<br />
O<br />
O<br />
krist.<br />
Robinson Anellierung<br />
O<br />
OH<br />
-H 2 O<br />
O<br />
thermodyn. stabileres<br />
Enolat<br />
O<br />
Michael-<br />
Addition<br />
+ H<br />
O<br />
O<br />
(OH )<br />
-H 2 O<br />
Aldol-<br />
Kondensation<br />
O<br />
A<br />
B<br />
C<br />
D<br />
Addition von Amiden<br />
24<br />
NH<br />
17<br />
O<br />
OH , -H 2 O<br />
N<br />
O<br />
CN<br />
Michael-<br />
Addition<br />
+ H<br />
N<br />
O<br />
CN Pd-H 2<br />
H<br />
-H 2 O<br />
N<br />
O<br />
NH2<br />
N<br />
N<br />
DBU<br />
(Amidin)
Dihydropyridine nach Hantzsch<br />
EtOOC<br />
R<br />
CHO<br />
O O<br />
NH 3<br />
COOEt<br />
-3H 2 O<br />
EtOOC<br />
R<br />
N<br />
H<br />
COOEt<br />
-2H 2 O<br />
EtOOC<br />
R<br />
N<br />
OH H OH<br />
COOEt<br />
Mech.:<br />
NH 3<br />
2<br />
EtOOC<br />
-H 2 O, - H<br />
OHC R EtOOC<br />
O<br />
Knoevenagel-<br />
Kondensation<br />
R<br />
O<br />
O<br />
O<br />
OEt<br />
Michael-<br />
Addition<br />
EtOOC<br />
O<br />
R<br />
O<br />
COOEt<br />
+ H<br />
c) Substitutionen von vinylogen Carbonylverbindungen<br />
H<br />
O<br />
H<br />
Me NH 2<br />
O - HCl<br />
O<br />
Me NH 2<br />
Cl<br />
Cl<br />
Me<br />
NH<br />
vinyloges Säurechlorid<br />
H<br />
O<br />
H 2 N NH 2<br />
H<br />
O<br />
-H 2 O<br />
Cl<br />
-HCl<br />
H 2 N<br />
NH<br />
N<br />
NH<br />
Pyrazol
8.6. Reaktionen von vinylogen Elektronendonorverbindungen<br />
NR 2 NHR 2<br />
Reaktivität (Nukleophilie)<br />
OH OR OSiR<br />
≈<br />
≈<br />
3<br />
NR<br />
< 2<br />
<<br />
O<br />
a) Silylenolether<br />
O<br />
Base (Et 3 N)<br />
O<br />
Me 3 Si-Cl<br />
SiMe 3<br />
O<br />
R-Cl<br />
TiCl 4<br />
O<br />
R<br />
+ TMS-Cl<br />
- Cl<br />
Silylenolether<br />
(stabil)<br />
R<br />
O<br />
H<br />
TiCl 4<br />
O OH<br />
+ TMS-Cl<br />
R<br />
Mukaiyama Aldol-Rkt.<br />
b) saure Monohalogenierung von Enolen (Carbonylverb.)<br />
Aldehyde + Ketone<br />
O<br />
H<br />
H<br />
H<br />
O -H OH Cl Cl O - H<br />
O<br />
- Cl<br />
Cl<br />
Cl<br />
im Basischen Perhalogenierung (z.B. Haloformreaktion)<br />
Carbonsäuren<br />
H 3 C<br />
O<br />
P rot + Br 2 (PBr 3 )<br />
H<br />
H 3 C O H H 3 C O Br Br H 3 C O<br />
H 2 O<br />
H 3 C<br />
O<br />
OH<br />
Br<br />
Br<br />
- HBr<br />
Br<br />
Br<br />
- HBr<br />
Br<br />
OH<br />
(70 %)
c) Acylierung u. Alkylierung von Enaminen<br />
O<br />
O<br />
N<br />
Cl<br />
O<br />
O<br />
N<br />
Cl<br />
O<br />
O<br />
N<br />
O<br />
Cl<br />
N O<br />
-HCl H 3 O O O<br />
O +<br />
N<br />
O<br />
Monoalkylierung mit reaktiven Elektrophilen<br />
O<br />
N<br />
CH 3<br />
O<br />
O<br />
N<br />
- H<br />
O<br />
N<br />
+<br />
O<br />
N<br />
CH 3<br />
H 3 O<br />
O<br />
O<br />
O<br />
O<br />
CH 3<br />
O<br />
N CH 2<br />
SO 2 OMe<br />
N<br />
CH 3<br />
N<br />
H<br />
H<br />
H<br />
N<br />
keine Enamin-Mesomerie<br />
H 3 C<br />
O<br />
N<br />
N<br />
N<br />
O<br />
O<br />
Enamin-Mesomerie (Orbitalüberlappung) möglich
9. Reaktionen von Heterocarbonylverbindungen<br />
9.1. Allgemeines<br />
Heterocarbonylaktivität wird durch Mesomerie bestimmt<br />
R<br />
O<br />
O<br />
O<br />
> R N + > R ><br />
R<br />
O<br />
S<br />
O<br />
R'<br />
O -<br />
OH<br />
OH<br />
α-CH-Acidität wird durch induktiven Effekt bestimmt<br />
O<br />
O<br />
O<br />
R CH 2 N > R CH N + 2<br />
> R CH 2<br />
> R CH 2<br />
O<br />
S<br />
O<br />
> R CH 2<br />
O<br />
O -<br />
R'<br />
OH<br />
OR'<br />
Nitrosoverbindungen<br />
tautomerisieren leicht<br />
zu Oximen:<br />
O<br />
OH<br />
R CH 2 N<br />
R CH N<br />
Nitrosoverb.<br />
Isonitrosoverb. (Oxim)<br />
9.2. Reduktion von Nitro- u. Nitrosoverbindungen<br />
R<br />
N + O<br />
O -<br />
(2 e ) (z.B. Fe, Sn, Zn)<br />
H<br />
, - H 2 O<br />
R<br />
N<br />
O<br />
2 e<br />
OH 2 e<br />
R NH<br />
H , - H 2 O H , - H 2 O<br />
R NH 2<br />
R<br />
N + O<br />
O -<br />
M<br />
R<br />
N<br />
O -<br />
O -<br />
H<br />
R<br />
N<br />
OH<br />
O -<br />
M<br />
H<br />
R<br />
N<br />
OH<br />
OH<br />
- H 2 O<br />
R<br />
N<br />
O<br />
+ 2 e , + 2 H<br />
R<br />
NH<br />
OH + 2 e , + 2 H<br />
R NH 2<br />
- H 2 O
4<br />
NO 2<br />
+ 9 Fe + 4 H 2 O<br />
HCl NH 2<br />
4<br />
+ 3 Fe 3 O 4<br />
NO 2<br />
Raney-Ni<br />
H 2<br />
NH 2<br />
O<br />
NO 2<br />
O<br />
Raney-Ni<br />
Hydrazin (H-Quelle) NH 2<br />
Cl<br />
Cl<br />
9.3. Reaktionen der salpetrigen Säure mit Aminoverbindungen u. Alkoholen<br />
O<br />
H + HO N<br />
H 2 O + N O<br />
Nitrosylkation<br />
- H<br />
R NH 2 N O R<br />
H<br />
N N O R N N OH<br />
+ H<br />
R N N<br />
+ H 2 O<br />
Diazohydroxid<br />
Diazoniumverb.<br />
a) aliphatische Amine<br />
NH 2<br />
NO<br />
- H 2 O<br />
N<br />
N<br />
aliphat. Diazoniumverb.<br />
(instabil)<br />
- N 2<br />
- H<br />
+ H 2 O OH<br />
+ H 2 O<br />
OH<br />
b) Amide<br />
O<br />
NO<br />
O<br />
+ H 2 O (-H )<br />
O<br />
R<br />
NH 2<br />
- H 2 O<br />
R<br />
N 2<br />
- N 2<br />
R<br />
OH
c) α-Aminosäuren u. α-Aminoketone<br />
H 2 N<br />
O<br />
OEt<br />
NO<br />
- H 2 O<br />
N 2<br />
O<br />
OEt<br />
- H<br />
N 2<br />
O<br />
OEt<br />
N<br />
N<br />
O<br />
OEt<br />
Diazoessigester<br />
H 2 N<br />
O<br />
NO<br />
- H 2 O<br />
N 2<br />
O<br />
- H<br />
N 2<br />
O<br />
N<br />
N<br />
O<br />
Diazomethylmethylketon<br />
d) aromatische Amine<br />
NH 2<br />
NO<br />
N<br />
N<br />
N<br />
N<br />
- H 2 O<br />
e) sekundäre Amine<br />
mesomeriestab. Diazoniumsalz<br />
NH<br />
NO<br />
- H<br />
N<br />
N<br />
O<br />
N,N-Dimethylnitrosamin (cancerogen)<br />
(Dimethylamid der salpetrigen Säure)<br />
f) tert. Amine: keine Reaktion bei Raumtemperatur; bei erhöhter Temperatur Nitrosamine<br />
g) Alkohole<br />
OH<br />
Isoamylalkohol<br />
O<br />
HO N<br />
- H 2 O<br />
O<br />
Isoamylnitrit<br />
N<br />
O<br />
Ersatz für HNO 2<br />
erweitert periphere Blutgefäße
9.4. Reaktionen der salpetrigen Säure mit CH-aciden Verbindungen<br />
O H + OH N O O<br />
H<br />
- H O<br />
O<br />
H 3 O<br />
O<br />
NO<br />
NO<br />
NOH<br />
- H 2 NOH<br />
O<br />
Diacetyl<br />
9.5. Reaktionen der Diazoniumsalze<br />
a) Verkochung<br />
N<br />
N<br />
Δ T (hν) H 2 O OH<br />
- N 2<br />
- H<br />
BF 4<br />
MeOH<br />
F<br />
OMe<br />
+BF 3<br />
+ H<br />
b) Reduktion<br />
N N Cl<br />
Benzoldiazoniumchlorid<br />
H 3 PO 2 + H 2 O<br />
( NaBH 4 )<br />
H<br />
+ H 3 PO 3 + N 2 + H<br />
Radikalmechanismus (H 2 PO 2 Kettenüberträger)<br />
Na 2 SO 3 +H 2 SO 3 + 2 H 2 O<br />
N N Cl<br />
NH NH 2<br />
+ NaHSO 4 + H 2 SO 4 + NaCl<br />
Benzoldiazoniumchlorid<br />
Phenylhydrazin
c) Sandmeyer Reaktion<br />
N<br />
N<br />
Cu I Cl 2<br />
N N + Cu <strong>II</strong> Cl 2 Cl + Cu I Cl<br />
Benzoldiazonium<br />
CuCl<br />
N<br />
N<br />
Cl<br />
CuBr<br />
Br<br />
I<br />
I<br />
(Radikal I wird gebildet)<br />
CuCN<br />
CN<br />
d) Azokupplung<br />
Aromat. Diazoniumionen sind schwache Elektrophile<br />
Reaktion nur mit reaktiven Aromaten (Amine, Phenole) in p-Stellung<br />
N<br />
S E Ar<br />
N N N N<br />
N<br />
- N 2<br />
- H<br />
H<br />
N<br />
N<br />
N<br />
"Buttergelb" (canc.)<br />
N<br />
N NH 2<br />
HO 3 S<br />
N<br />
N<br />
N<br />
Anilingelb<br />
Methylorange
Nebenreaktionen der Azokupplung:<br />
Diazotatbildung (zu alkalisch)<br />
N<br />
N<br />
OH<br />
N<br />
N<br />
OH<br />
OH<br />
N<br />
N<br />
O<br />
+ H 2 O<br />
langsam<br />
Diazohydroxid<br />
schnell<br />
Diazotat<br />
Triazenbildung bei unvollständiger Diazotierung<br />
- H<br />
N N H 2 N N<br />
N<br />
H N<br />
N,N'-Diphenyltriazen<br />
Diazoaminobenzol<br />
Baumwollfärbung<br />
O<br />
OH<br />
N<br />
H<br />
Naphthol AS (farblos, zieht<br />
in alk. Lösung auf BW auf)<br />
N<br />
N<br />
NO 2<br />
N<br />
N<br />
O<br />
OH<br />
N<br />
H<br />
Pararot<br />
(Entwicklungsfarbstoff)<br />
e) Kupplung mit CH-aciden Verbindungen<br />
O 2 N<br />
O<br />
O<br />
OEt<br />
O<br />
N<br />
O<br />
N<br />
OEt<br />
O<br />
N<br />
O<br />
NH<br />
OEt<br />
N<br />
N<br />
Phenylhydrazon
9.5. Aliphatische Diazoverbindungen<br />
N 2<br />
Alkyl<br />
N<br />
N<br />
Alkyl<br />
N 2<br />
Alkyl<br />
a) Darstellung von Diazomethan:<br />
Diazoalkan<br />
Diazoniumverb.<br />
O<br />
H 2 N NH 2<br />
H 2 N-Me O<br />
HNO 2 O<br />
- NH<br />
H 2 N N H 2 N<br />
3 - H H 2 O<br />
N<br />
NO<br />
OH<br />
- NH 3<br />
-CO 2<br />
N<br />
NO<br />
O<br />
N<br />
N<br />
HO<br />
N<br />
N<br />
-OH<br />
CH 2<br />
N<br />
N<br />
Nitrosomethylharnstoff<br />
Diazomethan<br />
"Diazald"<br />
O<br />
O<br />
S<br />
N<br />
NO<br />
OH<br />
O O<br />
S<br />
O<br />
N<br />
N<br />
H<br />
OH<br />
- H 2 O<br />
- pTosO<br />
N N CH 2<br />
N N CH 2<br />
Diazomethan<br />
b) Reaktionen von Diazomethan mit Protonensäuren<br />
R<br />
O<br />
OH<br />
H 2 C N N<br />
R<br />
O<br />
O<br />
N<br />
N<br />
CH 3<br />
- N 2<br />
R<br />
O<br />
OMe<br />
H 3 C N N<br />
OH<br />
CH 2 N 2<br />
CH 2 N 2 / BF 3<br />
- N 2<br />
OMe<br />
R OH R OBF<br />
- N 3<br />
2<br />
R<br />
OMe
9.6. Reaktionen der Sulfonsäurederivate<br />
H S H<br />
Ox<br />
O<br />
HO S<br />
OH<br />
Ox<br />
O O<br />
HO S<br />
OH<br />
Ox<br />
Ox<br />
O<br />
Ox<br />
O<br />
O<br />
R S H<br />
R S OH<br />
R S OH<br />
R S OH<br />
Thiol<br />
Sulfensäure<br />
Sulfinsäure<br />
Sulfonsäure<br />
Ox<br />
Red.<br />
(leicht)<br />
R S S R<br />
Disulfid<br />
Ox<br />
O<br />
Ox<br />
O<br />
O<br />
R S R<br />
Sulfid<br />
R S R<br />
Sulfoxid<br />
R S R<br />
Sulfon<br />
Cl<br />
SO 2 Cl<br />
p-Chlorbenzolsulfochlorid<br />
Prot + I 2 (kat.)<br />
AcOH<br />
Cl<br />
p-Chlorthiophenol<br />
SH SH O2 (Luft)<br />
2<br />
oder:<br />
H 2 O 2<br />
OH , I 2<br />
S<br />
S<br />
Diphenyldisulfid<br />
Butanthiol<br />
SH<br />
HNO 3 (konz.)<br />
SO 3 H<br />
Butansulfonsäure<br />
2<br />
H 3 N COO -<br />
SH<br />
Cystein<br />
O 2 (Luft)<br />
H 3 N<br />
COO OOC<br />
S S<br />
Cystin<br />
NH 3
10. Umlagerungen<br />
Elektronenbesetzung im ÜZ<br />
[1,2]-Umlagerungen<br />
Y<br />
A B<br />
Beisp. Me<br />
Me<br />
Me<br />
A<br />
Y<br />
ÜZ<br />
Me<br />
H<br />
B<br />
A<br />
Me<br />
Me<br />
Y<br />
B<br />
Me<br />
H<br />
Me<br />
antibindend<br />
MO<br />
bindend<br />
B B B<br />
nukleophile<br />
Umlagerung<br />
(Y - wandert)<br />
radikalische<br />
Umlagerung<br />
(Y )<br />
elektrophile<br />
Umlagerung<br />
(Y + )<br />
häufig selten selten<br />
[1,3-H]-Umlagerungen<br />
Allylumlagerung<br />
O<br />
OH<br />
Keto-Enol-Umlagerung<br />
N<br />
H<br />
N<br />
Imin-Enamin-Umlagerung<br />
N N N<br />
H<br />
N<br />
Azo-Hydrazon-Umlagerung<br />
sigmatrope (konzertierte) [3,3]-Umlagerungen<br />
Cope-Umlagerung<br />
O<br />
O<br />
Claisen-Umlagerung
10.1. [1.2]-Umlagerungen am Kohlenstoffatom<br />
Reaktionsmöglichkeiten<br />
für prim. Carbeniumion<br />
R<br />
R<br />
E1<br />
R<br />
R<br />
H<br />
S N 1<br />
-H<br />
Y<br />
H<br />
H<br />
~H<br />
~R<br />
R<br />
R<br />
R<br />
CH 3<br />
-H<br />
+ Y<br />
-H<br />
R<br />
R<br />
R<br />
R<br />
R<br />
Y<br />
CH 3<br />
R<br />
R<br />
H<br />
Y<br />
H<br />
R<br />
+ Y<br />
H<br />
H<br />
R<br />
Y<br />
R<br />
R<br />
Wanderungstendenz: ≈ Nukleophile des wandernden Rests<br />
subst. Phenylreste:<br />
H < CH 3 < Et < iPr < tBu < Ph<br />
p-NO 2 -Ph < p-Cl-Ph < Ph < p-Ph-Ph < p-Me-Ph < p-OMe-Ph<br />
a) Wagner-Meerwein-Umlagerung<br />
Cl<br />
(83%)<br />
H Cl<br />
Cl<br />
~ CH 3<br />
(17%)<br />
CH 3<br />
Cl - Cl<br />
S N 1
Br<br />
AlBr 3<br />
H<br />
Br<br />
~ H<br />
-AlBr 3<br />
AlBr 4<br />
AlBr 4<br />
quant.<br />
H + , - H 2 O<br />
~ R<br />
- H<br />
OH<br />
Borneol<br />
Camphen<br />
OH<br />
H , - H 2 O<br />
~ R<br />
- H<br />
3<br />
O<br />
Tetrahydrofurfurylalkohol<br />
O<br />
O O O<br />
3,4-Dihydro-2Hpyran<br />
b) Pinakolonumlagerung:<br />
H<br />
H<br />
OH OH H , - H 2 O O O O<br />
~ R<br />
-H<br />
Pinakolon<br />
OH<br />
OH<br />
H , - H 2 O<br />
OH<br />
~ H O H -H O<br />
H<br />
Phenylacetaldehyd
OH<br />
H , - H 2 O<br />
O H<br />
~ R -H<br />
O<br />
OH<br />
OH<br />
c) Tiffeneau-Umlagerung:<br />
O<br />
HCN<br />
N<br />
C<br />
OH<br />
Red.<br />
NH 2<br />
N<br />
H 2 C OH N OH<br />
HNO 2<br />
- N 2<br />
OH<br />
~ R<br />
H 2 C<br />
O<br />
H<br />
H 2 C<br />
O<br />
β-Aminoalkohol<br />
d) Wolff-Umlagerung:<br />
N<br />
O<br />
N<br />
CH<br />
R<br />
α-Diazoketon<br />
ΔT, Ag<br />
O<br />
R<br />
hν<br />
-N 2<br />
synchron<br />
O<br />
R<br />
CH<br />
N<br />
CH<br />
Ketocarben<br />
N<br />
~ R<br />
~ R<br />
O<br />
C<br />
Keten<br />
C<br />
Nu<br />
H<br />
R<br />
HOH<br />
R'-OH<br />
R'-NH 2<br />
HO<br />
HO<br />
C<br />
O<br />
R'-O<br />
O<br />
R'-NH<br />
H<br />
C<br />
R<br />
CH 2<br />
CH 2<br />
R<br />
R<br />
O<br />
HO<br />
CH 2<br />
R<br />
R<br />
O<br />
Cl<br />
H 2 C<br />
N<br />
N<br />
R<br />
O<br />
Cl<br />
N<br />
H<br />
N<br />
- HCl<br />
N<br />
O<br />
N<br />
CH<br />
R<br />
α-Diazoketon<br />
hν<br />
oder<br />
ΔT, Ag<br />
- N 2<br />
R<br />
H<br />
C<br />
C<br />
O<br />
H 2 O<br />
R<br />
CH 2<br />
O<br />
OH
Ringerweiterung von cyclischen Ketonen<br />
O<br />
N O N N O<br />
O<br />
O CH 2<br />
O<br />
H 2 C<br />
N<br />
CH 2<br />
+<br />
+<br />
10.2. [1.2]-Umlagerungen am Stickstoffatom<br />
Hauptprodukt<br />
Nebenprodukt<br />
Nebenprodukt<br />
(doppelte<br />
Ringerweiterung)<br />
Hofmann<br />
Lossen<br />
Curtius<br />
R<br />
O<br />
N<br />
X<br />
- N 2<br />
- X<br />
~ R<br />
O C N<br />
Isocyanat<br />
R<br />
NuH<br />
Schmidt<br />
Beckmann<br />
R'<br />
R<br />
N<br />
X<br />
~ R R' C N R H 2 O<br />
- X<br />
R' C N R<br />
R'<br />
O<br />
NH<br />
R<br />
a) Hofmann-Umlagerung<br />
Alkenylkation<br />
C,N = sp hybridisiert<br />
24<br />
O<br />
O OH O<br />
O<br />
O<br />
O OH<br />
Br Br<br />
OH<br />
~ CH 3 H 2 O<br />
C<br />
NH 2<br />
- H 2 O NH<br />
NH - H 2 O N Br - Br N<br />
NH -CO 2<br />
Me<br />
pK s 17<br />
Br<br />
NH 2
NH 2<br />
O<br />
Phenylacetamid<br />
NaOH<br />
Br 2<br />
-CO 2<br />
NH 2<br />
Benzylamin<br />
O<br />
NH<br />
O<br />
Phthalimid<br />
OH<br />
O<br />
O<br />
OH<br />
NH 2<br />
NaOH<br />
Br 2<br />
-CO 2<br />
O<br />
OH<br />
NH 2<br />
Anthranilsäure<br />
b) Curtius-Umlagerung<br />
R<br />
O<br />
HN NH 2<br />
HNO 2<br />
R<br />
O<br />
N N N<br />
ΔT<br />
R<br />
O<br />
N N N<br />
~ R<br />
- N 2<br />
O C N<br />
Isocyanat<br />
R<br />
Säurehydrazid<br />
Säureazid<br />
hν<br />
-N 2 R<br />
O<br />
N<br />
~ R<br />
O<br />
C<br />
N<br />
R<br />
Acylnitren<br />
O<br />
R<br />
N<br />
Säureazide aus Carbonsäuren<br />
Chlorameisensäureethylester<br />
R<br />
O<br />
OH<br />
Et 3 N<br />
O<br />
Cl<br />
O<br />
R O<br />
- H - Cl<br />
OEt<br />
O O<br />
R O OEt<br />
gem. Anhydrid<br />
NaN 3<br />
R<br />
O<br />
N 3<br />
+<br />
NaO<br />
O<br />
OEt
c) Beckmann-Umlagerung<br />
Alkenylkation<br />
R'<br />
R'<br />
OH 2<br />
- H<br />
R'<br />
Tautom.<br />
R'<br />
R<br />
OH H<br />
N N<br />
R' C N R<br />
R<br />
H 2 O<br />
HO<br />
N<br />
R<br />
O<br />
NH<br />
R<br />
O<br />
H 2 N OH<br />
x HCl<br />
- H 2 O<br />
OH konz. H 2 SO 4<br />
N<br />
NHO<br />
(70 %)<br />
(80 %)<br />
Cyclohexanonoxim<br />
ε-Caprolactam<br />
d) Schmidt-Reaktion (Carbonylverb. + HN 3 + H 2 SO 4 )<br />
H<br />
H<br />
O<br />
N HO N N N<br />
N<br />
N<br />
H<br />
N<br />
N<br />
N<br />
Alkenylkation<br />
N<br />
H 2 O<br />
- H<br />
N<br />
OH<br />
NH<br />
O<br />
ε-Caprolactam<br />
10.3. [1.2]-Umlagerungen am Sauerstoffatom<br />
H<br />
(H 2 SO 4 )<br />
- H 2 O - N 2<br />
- H<br />
a) Hydroperoxid-Umlagerungen<br />
~ Ph ~ H<br />
O<br />
OH<br />
O<br />
OH 2<br />
H 2 O<br />
O<br />
O<br />
OH 2<br />
O<br />
OH<br />
H<br />
OH<br />
O<br />
+<br />
Cumolhydroperoxid<br />
Halbacetal
) Baeyer-Villiger-Oxidation<br />
HO<br />
O O<br />
R<br />
O<br />
Cl<br />
H<br />
O<br />
O<br />
R<br />
O<br />
O<br />
Cl<br />
∗<br />
~ R<br />
- H<br />
O<br />
O<br />
R<br />
Lacton<br />
Konfigurationserhalt<br />
am Stereozentrum<br />
+<br />
O<br />
O<br />
Cl<br />
c) Oxidation von Boranen<br />
R<br />
O-OH<br />
R<br />
~ R<br />
- HO<br />
R<br />
R<br />
O<br />
R<br />
B<br />
R<br />
B<br />
O<br />
B<br />
O<br />
R<br />
B<br />
O<br />
R<br />
H<br />
O<br />
R<br />
R<br />
R<br />
OH<br />
R<br />
O<br />
10.4. Sigmatrope-Umlagerungen<br />
R<br />
Cope-Umlagerung<br />
(1,5-Dien)<br />
Ph 180°C<br />
2h<br />
Ph<br />
(72 %)<br />
Oxy-Cope-Umlagerung<br />
HO 190°C<br />
HO<br />
O<br />
HO<br />
HO<br />
O<br />
Claisen-Umlagerung<br />
Allylvinylether<br />
Oxa-Cope-Umlagerung<br />
(1,5-Dien)<br />
O<br />
ΔT<br />
O<br />
H<br />
OH<br />
(73 %)<br />
Allylphenol