Bleichmittel - Lehrer.at
Bleichmittel - Lehrer.at
Bleichmittel - Lehrer.at
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
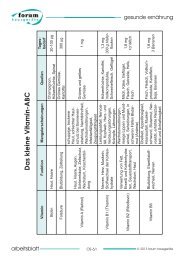
weg mit dem schmutz<br />
BLEICHMITTEL UND BLEICHAKTIVATOREN<br />
Farbverschmutzungen organischen Ursprungs, wie etwa Flecken von Kaffee, Obst, Wein<br />
etc. haften meist sehr fest am Gewebe. Zum Entfernen solcher hartnäckigen Flecken reichen<br />
Tenside alleine nicht aus. Hier müssen <strong>Bleichmittel</strong> eingesetzt werden.<br />
Moderne <strong>Bleichmittel</strong> zerstören den Schmutz durch Oxid<strong>at</strong>ion. Allerdings rücken <strong>Bleichmittel</strong><br />
auch den Textilfarbstoffen zu Leibe. In Feinwaschmitteln sollten daher keine <strong>Bleichmittel</strong> enthalten<br />
sein.<br />
Die Geschichte der Wäschebleichung<br />
Die erste Bleichmethode war die so genannte „Rasenbleiche“: Wäsche wurde auf dem Rasen<br />
ausgebreitet und über einen längeren Zeitraum immer wieder befeuchtet. Durch die<br />
Einwirkung der Sonnenstrahlen und die Freisetzung von Sauerstoff wurden die Farbstoffe<br />
oxid<strong>at</strong>iv zerstört – die Flecken wurden ausgebleicht. Diese Methode ist Grund dafür, warum<br />
sich die Wäschereien bzw. die Wäscher und Waschfrauen in Großstädten wie Wien bis Ende<br />
des 18. Jahrhunderts am Stadtrand angesiedelt haben.<br />
Zu Beginn des 19. Jahrhunderts wurde das <strong>Bleichmittel</strong> N<strong>at</strong>riumperbor<strong>at</strong> entwickelt, das bis<br />
heute zu den wichtigsten seiner Art zählt. Der Bleichprozess war ab diesem Zeitpunkt integr<strong>at</strong>iver<br />
Bestandteil des Waschvorgangs.<br />
Das moderne <strong>Bleichmittel</strong><br />
Atomarer Sauerstoff [O] in gebundener Form ist der wichtigste Bestandteil von <strong>Bleichmittel</strong>n.<br />
Konjugierte Doppelbindungen, die für die Farbgebung verantwortlich sind, werden gespalten<br />
und hydroxyliert. Der Farbstoff verliert damit seine Faserhaftung, die Wasserlöslichkeit wird<br />
erhöht. Gleichzeitig leisten einige <strong>Bleichmittel</strong> aufgrund ihrer stark oxidierenden Wirkung<br />
auch noch einen wesentlichen Beitrag zur Keimabtötung.<br />
Percarbon<strong>at</strong><br />
Bei Temper<strong>at</strong>uren ab 60 °C reagiert das abgespaltene H 2<br />
O 2<br />
der Percarbon<strong>at</strong>, indem es<br />
aktiven Sauerstoff freisetzt. Dabei entsteht Wasserstoffperoxid, das in der alkalischen<br />
Waschlauge unter Bildung von aktivem Sauerstoff zerfällt.<br />
H 2<br />
O 2<br />
+ OH - ↔ H 2<br />
O + HO 2<br />
-<br />
HO 2<br />
-<br />
OH - + [O]<br />
arbeitsbl<strong>at</strong>t<br />
OS-7/1<br />
© 2004 haushalt aktiv
weg mit dem schmutz<br />
Die Wirkung von N<strong>at</strong>riumpercarbon<strong>at</strong><br />
N<strong>at</strong>riumpercarbon<strong>at</strong> ist eine Anlagerungsverbindung von Wasserstoffperoxid (H 2<br />
O 2<br />
) an<br />
N<strong>at</strong>riumcarbon<strong>at</strong> (Soda: Na 2<br />
CO 3<br />
):<br />
2 Na 2<br />
CO 3 . 3 H 2<br />
O 2<br />
Ab einer Wärmeeinwirkung von 50°C wird das Wasserstoffperoxid wieder abgespalten<br />
und zerfällt zu Wasser und aktivem Sauerstoff. Je höher die Temper<strong>at</strong>ur, umso stärker<br />
die Reaktion.<br />
Beim Waschvorgang in der Waschmaschine setzt N<strong>at</strong>riumpercarbon<strong>at</strong> ab einer Temper<strong>at</strong>ur<br />
von 60 °C Sauerstoff frei. Der frei werdende Sauerstoff wirkt bei bleichbaren Flecken<br />
wie Grasflecken, Obstflecken, Tee- oder Rotweinflecken. Durch Oxid<strong>at</strong>ion werden<br />
die Farbstoffe farblos. Teilweise werden auch fleckenbildende Substanzen in wasserlösliche<br />
überführt und können so mit der Waschlauge ausgeschwemmt werden.<br />
<strong>Bleichmittel</strong>aktiv<strong>at</strong>oren<br />
Bei einer Temper<strong>at</strong>ur von 80-90 °C wird mit Percarbon<strong>at</strong> eine optimale Bleichwirkung erzielt.<br />
Nachdem mit den heutigen Waschmitteln nur mehr Waschtemper<strong>at</strong>uren bis max. 60 °C notwendig<br />
sind, um ein optimales Waschergebnis zu erzielen, musste ein Weg gefunden werden,<br />
um diese Temper<strong>at</strong>ur herabzusetzen.<br />
Bleichaktiv<strong>at</strong>oren haben genau diese Aufgabe: Sie ermöglichen den Bleichprozess bereits<br />
bei niedrigeren Temper<strong>at</strong>uren.<br />
Aktiv<strong>at</strong>oren wie etwa TAED (Tetraacetylendiamin), der wichtigste Vertreter dieser Waschmittelinhaltsstoffgruppe,<br />
bilden in der alkalischen Waschlauge durch Reaktion mit dem Percarbon<strong>at</strong><br />
bereits bei niedrigeren Temper<strong>at</strong>uren bleichaktive Verbindungen: Peroxoessigsäure.<br />
H 3<br />
C<br />
H C<br />
O<br />
3 C<br />
3<br />
C<br />
O<br />
N CH 2<br />
CH 2<br />
N C<br />
C<br />
CH 3<br />
CH 3<br />
O<br />
O<br />
TAED<br />
Na + B B Na +<br />
2 -<br />
OH O O OH<br />
OH O O OH<br />
H<br />
H 3<br />
C C<br />
O<br />
O<br />
N CH 2<br />
CH 2<br />
N C<br />
H<br />
Diacetylethylendiamin<br />
CH 3<br />
O<br />
+ 2 H 3 C<br />
C OOH<br />
Peressigsäure<br />
Dadurch wird bereits bei einer Waschtemper<strong>at</strong>ur von 40 °C ein optimales Bleichergebnis<br />
erzielt.<br />
arbeitsbl<strong>at</strong>t<br />
OS-7/2<br />
© 2004 haushalt aktiv