Solubilisierung stark lipophiler Arzneistoffe in lipidhaltige ...
Solubilisierung stark lipophiler Arzneistoffe in lipidhaltige ...
Solubilisierung stark lipophiler Arzneistoffe in lipidhaltige ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Kapitel III Experimenteller Teil<br />
und wird dort dicht befestigt. So entstehen zwei Kompartimente (Donatorkompartiment<br />
DK und Akzeptorkompartiment AK) mit aktiver Permeationsfläche von 5 cm² bei e<strong>in</strong>em<br />
Lösungsvolumen von jeweils 5 ml (<strong>in</strong>stitutseigene Herstellung).<br />
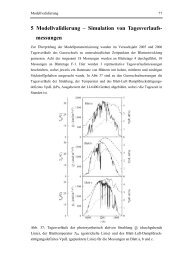
Abb. 14 Aufbau e<strong>in</strong>er Permeationszelle des Modells nach Fürst und Neubert<br />
Die treibende Kraft für den Wirkstofftransport bei diesem Modell ist das Konzentrationsgefälle<br />
zwischen den verschiedenen Phasen (Donator, Lipidmembran und Akzeptor). Für<br />
die Beschreibung des Permeationsprozesses wird Gl. II.8-1 <strong>in</strong> der Regel e<strong>in</strong>gesetzt.<br />
Die Herstellung der Dodecanol-Collodium-Membranen erfolgte wie im folgenden<br />
beschrieben: 4 g Dodecanol-Octanol-Gemisch (10% W/W Octanol) wurde auf 100 g<br />
durch e<strong>in</strong>em Ether-EtOH-Gemisch (8,5 VT+1,5 VT) ergänzt und schließlich mit 100 g<br />
4%-iger Collodiumlösung (DAC 1986, Caesar & Loretz GmbH, Hilden, Deutschland)<br />
vermischt. Davon wurden anschließend 110 ml auf die plangeschliffene Glasplatte e<strong>in</strong>es<br />
Filmziehgerätes (<strong>in</strong>stitutseigene Herstellung) gegeben und weiter wie bei Fritzsch<br />
beschrieben [235] vorbereitet und aufbewahrt.<br />
Nach Temperierung der Vorrichtung und der Lösungen auf 37 °C wurde das untersuchte<br />
wirkstoffhaltige mizellare System <strong>in</strong> das DK und e<strong>in</strong>e gleiche aber wirkstofffreie Lösung<br />
<strong>in</strong> das AK e<strong>in</strong>gefüllt. Danach erfolgten die 200-µl-Probenahmen <strong>in</strong> Probezeiten von 0,<br />
20, 40, 60, 90, 120 und 180 m<strong>in</strong>. Das entnommene Volumen wurde sofort entsprechend<br />
durch wirkstofffreie Lösung auf beiden Seiten ersetzt. Die Konzentrationsbestimmungen<br />
erfolgten nach der Methode HPLC-1 ( III.5.1). Durch Probenahmen auf den<br />
beiden Membranseiten kam es zu e<strong>in</strong>er Verr<strong>in</strong>gerung der vorliegenden Wirkstoffkonzentrationen.<br />
Dies wurde durch e<strong>in</strong>e Korrektur um die entsprechenden Mengen gemäß<br />
Gl. III.8-1 ausgeglichen.<br />
Ctn ( −1)<br />
(korr) ⋅ VProbe<br />
Ctn ( )<br />
(korr) = Ctn<br />
( ) + Gl. III.8-1<br />
V<br />
Akzeptor<br />
C t(n) (korr) ist die korrigierte Konzentration zum Zeitpunkt t(n), C t(n) die zu korrigierende<br />
Konzentration, C t(n-1) (korr) die korrigierte Konzentration zum Zeitpunkt t(n-1), V Probe Probevolumen<br />
und V Akzeptor Akzeptorvolumen.<br />
Jeder Versuch wurde mittels drei parallelen Wiederholungen <strong>in</strong> drei Zellen und der<br />
Ermittlung der Mittelwerte durchgeführt.<br />
Die Membranen wurden nach Ablauf des Versuches vorsichtig aus den Zellen entfernt<br />
und je drei mal mit 5 ml bidestilliertem Wasser ausgeschüttelt, dann zwischen Filterpapier<br />
getrocknet und schließlich <strong>in</strong> mit Schliffhals versehene Reagenzgläser überführt.<br />
Nach Zugabe von je 2 ml EtOH wurden die Reagenzgläser mit e<strong>in</strong>em Glasstopfen dicht<br />
verschlossen und 3 h bei 30 °C im Ultraschallbad extrahiert. Von den ethanolischen<br />
51