Zustandsgleichung: Isochore Zustandsänderung (V = const) Ideales ...
Zustandsgleichung: Isochore Zustandsänderung (V = const) Ideales ...
Zustandsgleichung: Isochore Zustandsänderung (V = const) Ideales ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
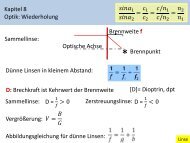
Kapitel 3: Kalorimetrie<br />
<strong>Ideales</strong> Gas<br />
<strong>Zustandsgleichung</strong>:<br />
Isotherme <strong>Zustandsänderung</strong> (T = <strong>const</strong>)<br />
<strong>Isochore</strong> <strong>Zustandsänderung</strong> (V = <strong>const</strong>)<br />
Isobare <strong>Zustandsänderung</strong> (p = <strong>const</strong>)<br />
N<br />
Volumen<br />
Druck [bar]
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
• große Anzahl gleichartiger Atome oder Moleküle (Teilchen), die sich<br />
sehr schnell bewegen (T Raumtemp.: v > 100 m/s)<br />
• Abstand der Moleküle voneinander groß gegen ihren Durchmesser<br />
• keine Wechselwirkung zwischen Teilchen außer beim Zusammenstoß<br />
• Stöße verlaufen sehr schnell und elastisch Impulserhaltung<br />
• Gravitation vernachlässigbar, Anzahl Teilchen oben u. unten im<br />
Behälter nahezu gleich
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
• Druck, den ein Gas auf Wände ausübt, resultiert aus den<br />
Stößen der Teilchen mit den Wänden
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
Nur die Hälfte der Teilchen<br />
bewegt sich Richtung Wand<br />
x<br />
Teilchendichte Volumen
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
Totaler Impulsübertrag:<br />
x
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
Totaler Impulsübertrag:<br />
Druck, den die Teilchen<br />
auf die Wand ausüben:<br />
x
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
Druck, den Teilchen auf Wand ausüben<br />
<strong>Zustandsgleichung</strong> ideales Gas:<br />
Mittlere kinetische Energie in Richtung x- Achse ist:<br />
x
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
Druck, den Teilchen auf Wand ausüben<br />
<strong>Zustandsgleichung</strong> ideales Gas:<br />
Mittlere kinetische Energie in Richtung x- Achse ist:<br />
x
Kapitel 3: Kalorimetrie<br />
Kinetische Gastheorie<br />
mittlere kinetische Energie<br />
eines Gasteilchens.<br />
N = n N A<br />
x
Kapitel 3: Kalorimetrie<br />
Thermische Molekularbewegung<br />
<strong>Ideales</strong> Gas: f = 3 da Bewegung in 3 Raumrichtungen<br />
f: Anzahl Freiheitsgrade<br />
N: Anzahl Teilchen<br />
k B: Boltzmann Konstante<br />
10<br />
10<br />
Milch
Kapitel 3: Kalorimetrie<br />
f: Anzahl Freiheitsgrade<br />
3- Translationsfreiheitsgrade<br />
2, 3- Rotationsfreiheitsgrade<br />
Schwingungsfreiheitsgrade<br />
…..<br />
H 2-Moleküle<br />
f: Anzahl Freiheitsgrade<br />
N: Anzahl Teilchen<br />
k B: Boltzmann Konstante<br />
11<br />
11<br />
Milch
Kapitel 3: Kalorimetrie<br />
<strong>Ideales</strong> Gas<br />
Thermische Molekularbewegung<br />
f: Anzahl Freiheitsgrade<br />
k B: Boltzmann Konstante<br />
R: allg. Gaskonstante
Kapitel 3: Kalorimetrie<br />
Energie/Wärme pro Teilchen<br />
H 2-Moleküle<br />
f: Anzahl Freiheitsgrade (meist 3)<br />
k B: Boltzmann Konstante<br />
m: Masse<br />
v: Geschwindigkeit<br />
13<br />
13<br />
Milch
Kapitel 3: Kalorimetrie<br />
- Teilchen bewegen sich geradlinig zwischen Stößen<br />
- Teilchen ändern ihre Richtung nach Zusammenstoß (Impulserhaltung)<br />
⇒ Diese Bewegung nennt man Brownsche Molekularbewegung<br />
- Teilchen haben nicht alle gleiche Geschwindigkeit<br />
=> Geschwindigkeitsverteilung<br />
Maxwell-Boltzmann<br />
Verteilung<br />
Abstand zwischen Stößen :<br />
Mittlere freie Weglänge
Kapitel 3: Kalorimetrie<br />
Wärme<br />
Wärme ist eine Form der Energie<br />
Reaktionswärme<br />
(Chemie)<br />
Latente<br />
Wärme<br />
Thermische Molekularbewegung<br />
(Physik)<br />
15
Kapitel 3: Kalorimetrie<br />
Reaktionswärme<br />
Reaktionswärme (Chemie)<br />
Desmodur + Desmophen ----> Polyurethan<br />
(Diisocyanant) (Diol)<br />
Polyaddition (Umlagerung eines H-Atoms)<br />
(Diisocyanant) (Diol)<br />
Aufschäumen (Kohlendioxid entsteht bei Reaktion von H 2O mit Isocyanat)<br />
O=C=N-R 1 -N=C=O + H 2O -> H 2N –R 1 -N=C=O + CO 2
Kapitel 3: Kalorimetrie<br />
Reaktionswärme<br />
Reaktionswärme (Chemie)<br />
Desmodur + Desmophen ----> Polyurethan<br />
Schaum: geschlossen<br />
Häuser: Wärmedämmung<br />
Lunge (Tenside)<br />
N nimmt zu,<br />
Temperatur steigt!
Kapitel 3: Kalorimetrie<br />
Wärme<br />
Wie messe ich Wärme?
Kapitel 3: Kalorimetrie<br />
Wärme ist ist die mit der thermischen Molekularbewegung<br />
verbundene Energie<br />
Energieübertrag fließt immer in Richtung der niedrigeren<br />
Temperatur<br />
Einheit:<br />
[Q] = 1J<br />
Vorzeichen: Wärme, die dem System zugeführt wird<br />
Wärme, die dem System abgeführt wird<br />
+ -
Kapitel 3: Kalorimetrie<br />
∆Q = C ∆T<br />
Wärme<br />
Wie kann ich Wärme zuführen?<br />
z.B. Tauchsieder (Leistung mal Zeit, P ∆t)<br />
∆Q: zugeführte Wärmemenge<br />
∆T: Temperatursteigerung<br />
C: Wärmekapazität<br />
m: Masse des Stoffs<br />
20
Kapitel 3: Kalorimetrie<br />
∆Q = C ∆T<br />
Wärme<br />
Spezifische Wärmekapazität<br />
∆Q: zugeführte Wärmemenge<br />
∆T: Temperatursteigerung<br />
C: Wärmekapazität<br />
m: Masse des Stoffs<br />
21
Kapitel 3: Kalorimetrie<br />
Spezifische Wärmekapazität<br />
Molare Wärmekapazität<br />
1 Mol eines Stoffes enthält 6.02 10 23 Teilchen<br />
n: Stoffmenge<br />
=> Wärmekapazität ist abhängig vom Stoff!<br />
22<br />
22<br />
Bleikugel
Kapitel 3: Kalorimetrie<br />
Spezifische Wärmekapazität<br />
Beispiel:<br />
Al Cu Pb<br />
Paraffin Block<br />
R = 15 mm<br />
V = 14 cm 3<br />
23<br />
23<br />
Kugel
Kapitel 3: Kalorimetrie<br />
Spezifische Wärmekapazität<br />
Beispiel:<br />
Al<br />
Cu<br />
Paraffin Block<br />
Für Festkörper<br />
Dulong-Petit-Gesetz<br />
c molar ≈25 J/(mol K) = 3R<br />
Pb<br />
R = 15 mm<br />
V = 14 cm 3<br />
24<br />
24<br />
Kugel
Kapitel 3: Kalorimetrie<br />
Spezifische Wärmekapazität<br />
Beispiel:<br />
Al<br />
Cu<br />
Paraffin Block<br />
Material A: Atommasse<br />
[g/mol]<br />
Pb<br />
ρ: Dichte<br />
[g/cm3]<br />
Für Festkörper<br />
Dulong-Petit-Gesetz<br />
ρ/Α<br />
[mol/cm 3 ]<br />
C<br />
J/gK<br />
Al 26.98 2,70 0.10 0.89<br />
Cu 63.54 8,96 0.14 0.38<br />
Pb 207.19 11,4 0.055 0.18<br />
H 2O 4.18<br />
c molar ≈25 J/(mol K) = 3R<br />
R = 15 mm<br />
V = 14 cm 3<br />
25<br />
25<br />
Kugel
Kapitel 3: Kalorimetrie<br />
Spezifische Wärmekapazität läßt sich messen<br />
Beispiel: spezifische Wärme von Kupfer, c Cu ? ∆Q = C ∆T<br />
Wasser<br />
100 °C<br />
Kupferkugel<br />
T 1 Cu = 100°C<br />
m Cu = 581g<br />
100<br />
°C<br />
Wasser<br />
T 1 w=18 °C<br />
(Anfangstemperatur)<br />
m W = 100 g<br />
26<br />
26<br />
Cu-Kugel
Kapitel 3: Kalorimetrie<br />
Beispiel: spezifische Wärme von Kupfer?<br />
Wasser<br />
100 °C<br />
T1 w=18 °C<br />
mW = 100g<br />
T 1 Cu = 100°C<br />
m Cu = 581g<br />
T Mischz40°C<br />
Cu-Kugel
Kapitel 3: Kalorimetrie<br />
Beispiel: spezifische Wärme von Kupfer?<br />
Wasser<br />
Tw = 18 °C<br />
mW = 500g<br />
TCu = 100°C<br />
mCu = 581g<br />
T Mischz40°C
Kapitel 3: Kalorimetrie<br />
Beispiel: spezifische Wärme von Kupfer?<br />
Temperaturwerte<br />
nur als Beispiel
Kapitel 3: Kalorimetrie<br />
Im Allgemeinen muss Gefäß berücksichtigt werden<br />
Mit:<br />
Γ K : Wärmekapazität<br />
des Kalorimeters