Kinder-Rheumatologie - Rheuma Schweiz
Kinder-Rheumatologie - Rheuma Schweiz
Kinder-Rheumatologie - Rheuma Schweiz
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
www.rheuma-schweiz.ch<br />
Inhalt<br />
Editorial<br />
Impressum<br />
Gastkolumne<br />
<strong>Kinder</strong>-<strong><strong>Rheuma</strong>tologie</strong> –<br />
das junge Spezialgebiet leidet<br />
besonders unter dem Spardruck<br />
Kasuistik<br />
Eine dicke Wade mit<br />
seltener Ursache<br />
State of the Art<br />
10<br />
Polymyositis und Dermatomyositis –<br />
Manifestationsformen und<br />
aktuelle Behandlungsmöglichkeiten<br />
Spezial<br />
Physikalische Medizin und<br />
muskulo-skelettale<br />
Rehabilitation – Neuigkeiten<br />
im Jahr 2009<br />
Kongress<br />
ACR 2009<br />
Persönlich<br />
Publikationen<br />
Fort- und Weiterbildung<br />
<strong>Rheuma</strong>klinik und Institut für Physikalische Medizin<br />
51<br />
XXXXX<br />
2<br />
2<br />
3<br />
5<br />
16<br />
19<br />
25<br />
26<br />
28<br />
UniversitätsSpital Zürich<br />
rheuma<br />
NACHRICHTEN<br />
Gastkolumne –<br />
<strong>Kinder</strong>-<strong><strong>Rheuma</strong>tologie</strong><br />
Seite 3<br />
41–2006
2<br />
editorial<br />
STEFFEN GAY<br />
Liebe Kolleginnen, liebe Kollegen<br />
Die Anzahl und Geschwindigkeit von neuen Informationen, die<br />
uns zur Verfügung stehen, werden immer grösser und schneller.<br />
So war der Kongress des American College of <strong>Rheuma</strong>tology<br />
(ACR), in Philadelphia, PA, wieder angefüllt mit neuen Fakten aus<br />
der Forschung. Es ist so auch umso erfreulicher, dass die Research<br />
Fellows der <strong>Rheuma</strong>klinik neue Ergebnisse vor einem breiten<br />
Publikum vorstellen konnten, wie in diesem Heft nachzulesen ist.<br />
Es ist uns auch eine grosse Freude, dass wir PD Dr.Traudel<br />
Saurenmann für die Gastkolumne zum Thema «<strong>Kinder</strong>-<br />
<strong><strong>Rheuma</strong>tologie</strong>» gewinnen konnten und die Dres. med. Matthias<br />
Kirrstetter und Oliver Distler in einem «State of the Art» uns einen<br />
Update zur Polymyositis und Dermatomyositis geben. PD Dr.<br />
Daniel Uebelhart berichtet uns weiter über die wichtigsten<br />
Neuigkeiten im vergangenen Jahr in der Physikalischen Medizin<br />
und Rehabilitation.<br />
So finden Sie auch in dieser Auflage wieder eine breite Palette<br />
interessanter Neuigkeiten aus der Forschung, Klinik und<br />
Rehabilitation, die Ihnen von Nutzen sein können.<br />
Mit herzlichen Grüssen und guten Wünschen zum Neuen Jahr<br />
Steffen Gay<br />
Impressum<br />
<strong>Rheuma</strong>-Nachrichten<br />
❙ 17. Jahrgang – Ausgabe Nr. 51<br />
❙ Auflage: 1000<br />
❙ Erscheint dreimal pro Jahr<br />
❙ Erscheinungsdatum: Dezember 2009<br />
Redaktion<br />
❙ Beat A. Michel (Klinikdirektor)<br />
❙ Pius Brühlmann (Klinik)<br />
❙ Steffen Gay (Basisforschung)<br />
❙ Daniel Uebelhart (Physik. Medizin)<br />
Autoren dieser Ausgabe<br />
❙ Oliver Distler<br />
PD Dr. med., Leitender Arzt<br />
❙ Steffen Gay<br />
Prof. Dr. med., Leitender Arzt<br />
Experimentelle <strong><strong>Rheuma</strong>tologie</strong><br />
❙ Matthias Kirrstetter<br />
Dr. med., Assistenzarzt<br />
❙ Traudel Saurenmann<br />
PD Dr. med., Leitende Ärztin<br />
<strong><strong>Rheuma</strong>tologie</strong>, <strong>Kinder</strong>spital Zürich<br />
❙ Andrea Stärkle-Bär<br />
Dr. med., Oberärztin<br />
❙ Daniel Uebelhart<br />
PD Dr. med., Leitender Arzt<br />
Gestaltung und Druck<br />
Pomcany’s Kommunikationsagentur<br />
Aargauerstrasse 250, 8048 Zürich<br />
Telefon 044 496 10 10<br />
Regula Keller, Gestaltung<br />
Fotos<br />
<strong>Rheuma</strong>klinik und Institut<br />
für Physikalische Medizin<br />
Sponsoring<br />
IBSA Institut Biochimique SA<br />
Via del Piano, P.O. Box 261<br />
6915 Pambio-Noranco<br />
MSD<br />
Schaffhauserstrasse 136<br />
8152 Opfikon–Glattbrugg<br />
GRÜNENTHAL Pharma AG<br />
8756 Mitlödi<br />
DROSSAPHARM AG<br />
4144 Arlesheim<br />
Roche Pharma (<strong>Schweiz</strong>) AG<br />
4153 Reinach<br />
Abonnemente<br />
Die <strong>Rheuma</strong>-Nachrichten können kostenlos<br />
abonniert werden bei:<br />
UniversitätsSpital Zürich, <strong>Rheuma</strong>klinik und<br />
Institut für Physikalische Medizin<br />
Gloriastrasse 25, 8091 Zürich<br />
Telefon 044 255 29 96<br />
Telefax 044 255 89 78<br />
e-Mail maya.michel@usz.ch<br />
Internet<br />
www.rheuma-schweiz.ch<br />
Nächste Ausgabe: April 2010
TRAUDEL SAURENMANN<br />
<strong>Kinder</strong>-<strong><strong>Rheuma</strong>tologie</strong> – das junge Spezialgebiet<br />
leidet besonders unter dem Spardruck<br />
Dank der Biologika hat sich auch die Prognose von <strong>Kinder</strong>n und Jugendlichen mit rheumatischen Krankheiten grundlegend<br />
verändert. Das Behandlungsziel heisst komplette Remission der Erkrankung, und die Rate früher, schwerwiegender Folgeschäden<br />
fällt in sich zusammen. Die intensive und komplexe Behandlung muss zunehmend durch spezialisierte Ärzte erfolgen.<br />
Seit diesem Jahr gibt es den neuen Weiterbildungstitel «Pädiatrische <strong><strong>Rheuma</strong>tologie</strong>». Der Anspruch zwischen hochstehender<br />
Behandlungsqualität und dem Sparen wird zur Zerreissprobe.<br />
Seit 2009 ist die «Pädiatrische <strong><strong>Rheuma</strong>tologie</strong>» als Spezialgebiet<br />
der Pädiatrie mit einem eigenen Weiterbildungsprogramm offiziell<br />
von der FMH anerkannt. Noch vor gut zehn Jahren, bei der<br />
Gründung der <strong>Schweiz</strong>erischen Arbeitsgemeinschaft für<br />
«Pädiatrische <strong><strong>Rheuma</strong>tologie</strong>», hätten wir alle uns nicht träumen<br />
lassen, dass diese Entwicklung so rasant verlaufen würde.<br />
Dem Tarmed und der Spezialitätenliste sei (für einmal) Dank,<br />
denn in diesen Regelwerken sind die Pädiater als Grundversorger<br />
eingestuft und damit von bestimmten spezialärztlichen Leistungen<br />
und Indikationsstellungen ausgeschlossen. Die Schaffung<br />
des Titels erhielt dadurch besondere Dringlichkeit, weil<br />
andernfalls <strong>Kinder</strong>ärzte, die erst nach Einführung von Tarmed<br />
im Jahre 2004 eine rheumatologische Ausbildung begonnen<br />
haben bezüglich Abrechnung von erbrachten Leistungen aber<br />
auch bezüglich Verschreibung bestimmter Medikamente (Biologika),<br />
benachteiligt worden wären. Für den Titel «Pädiatrische<br />
<strong><strong>Rheuma</strong>tologie</strong>» muss an die Weiterbildung in Pädiatrie noch<br />
drei Jahre rheumatologische Spezialausbildung folgen, wovon<br />
höchstens ein Jahr bereits während der Pädiatrie-Ausbildung<br />
absolviert werden kann.<br />
In diesem Zusammenhang ist es mir wichtig, etwas klar<br />
zu stellen: Wie die meisten pädiatrischen Spezialgebiete (Ausnahme<br />
Neonatologie, Entwicklungspädiatrie) hat sich auch die<br />
<strong>Kinder</strong>-<strong><strong>Rheuma</strong>tologie</strong> aus dem «Erwachsenen»-Spezialgebiet<br />
heraus entwickelt, das heisst, die Pioniere auf diesem Gebiet<br />
hatten meistens keine pädiatrische Grundausbildung. Mit der<br />
neuen Weiterbildungsregelung sollen aber keinesfalls die Leistungen<br />
dieser Pioniere und Vorbilder geschmälert werden, noch<br />
sollen «Erwachsenen»-<strong>Rheuma</strong>tologen, die aus Freude und<br />
Interesse auch <strong>Kinder</strong> behandeln und damit oftmals auch eine<br />
regionale Versorgungslücke schliessen, davon abgehalten werden,<br />
dies auch in Zukunft zu tun. Das Weiterbildungsprogramm<br />
definiert einzig, wie in Zukunft die Weiterbildung für jemanden<br />
sein soll, der sich als Spezialist hauptsächlich oder ausschliesslich<br />
der pädiatrischen <strong><strong>Rheuma</strong>tologie</strong> widmen will.<br />
Die <strong>Kinder</strong>-Reumatologie hat sich – nicht nur in der<br />
<strong>Schweiz</strong>, sondern in allen westlichen Ländern – seit den 90er-<br />
Jahren enorm entwickelt. Ein wesentlicher Grund sind die grossen<br />
Fortschritte bezüglich Verständnis pathophysiologischer<br />
Mechanismen der Entzündung und die daraus resultierenden<br />
Therapiemöglichkeiten. Anders als früher, als der Entzündungsprozess<br />
bestenfalls verlangsamt werden konnte und eine möglichst<br />
lange Erhaltung der Funktion im Alltag im Vordergrund<br />
des therapeutischen Bemühens stand, gilt heute als Therapieziel<br />
das Erreichen einer frühzeitigen, vollständigen Remission. Die<br />
Dieses siebenjährige Kind hatte während mehrerer Jahre eine<br />
unkontrollierte Arthritis im linken Handgelenk. Man kann<br />
den Grössenunterschied der beiden Hände sofort erkennen.<br />
Im Röntgenbild wird zudem die beschleunigte Knochenreifung<br />
links, verglichen mit der normalen rechten Seite,<br />
deutlich.<br />
dafür notwendigen medikamentösen Therapien erfordern fundierte<br />
Kenntnisse und regelmässige spezialärztliche Kontrollen<br />
zur Steuerung und Überwachung der Behandlung. Der Erfolg,<br />
insbesondere seit die TNFα-Blocker auch für <strong>Kinder</strong> verfügbar<br />
sind, rechtfertigt die intensivierte Behandlung. Trotz stark steigender<br />
Patientenzahlen sehen wir in unserer Sprechstunde nur<br />
wenige <strong>Kinder</strong>, bei denen noch aktiv entzündete Gelenke<br />
gefunden werden können. Die Verbesserung der Langzeit-Prognose<br />
ist eklatant. Noch bis vor kurzem mussten wir regelmässig<br />
Jugendliche wegen schwerer sekundärer Arthrose für<br />
Gelenkersatzoperationen in orthopädische Kliniken zuweisen.<br />
Bei der neuen Generation der von Anfang an intensiv behandelten<br />
<strong>Kinder</strong> sind solche frühe, schwere Gelenkschäden eine<br />
Rarität. Auch andere Folgeerscheinungen wie Kleinwuchs oder<br />
Erblindung nach assoziierten Augenentzündungen, kennen wir<br />
bald nur noch aus den Lehrbüchern.<br />
51–2009<br />
3<br />
GASTKOLUMNE
4<br />
GASTKOLUMNE<br />
Trotz allem Erfolg ist die Situation der <strong>Kinder</strong>-<strong><strong>Rheuma</strong>tologie</strong><br />
aber bei weitem nicht so rosig, wie es nach Lesen dieser ersten<br />
Abschnitte vielleicht scheinen mag. Als junges Fachgebiet mit<br />
explodierenden Patientenzahlen hatten wir schon vor der Wirtschaftskrise<br />
ständig damit zu kämpfen, dass uns die Ressourcen<br />
für die rasch wachsenden Sprechstunden immer erst nachträglich<br />
bewilligt werden konnten, weil das tatsächliche Wachstum<br />
die gemachten Prognosen regelmässig übertraf.<br />
Hätten wir Patienten abweisen sollen, wie uns das die Verwaltung<br />
regelmässig vorschlägt? Aber wohin sollen wir sie verweisen?<br />
Die nächsten ausgebildeten <strong>Kinder</strong>-<strong>Rheuma</strong>tologen<br />
finden sich in Aarau, Luzern oder St.Gallen, und deren Sprechstunden<br />
sind ebenso voll wie unsere.<br />
Können wir aus den Zuweisungszeugnissen erkennen, wie<br />
hoch die Wahrscheinlichkeit ist, dass das Kind tatsächlich an<br />
einer rheumatischen Krankheit leidet? Die Erfahrung zeigt: Leider<br />
nein! Und wir stehen mit dieser Erfahrung nicht alleine da.<br />
Tatsächlich zeigen verschiedene Studien, dass aus den Zuweisungsschreiben<br />
nur sehr schlecht auf die spätere, bei der Konsultation<br />
gestellte Diagnose geschlossen werden kann. Ein möglicher<br />
Grund dafür ist die mangelnde Ausbildung und Erfahrung<br />
der zuweisenden Ärzte mit der Untersuchung des kindlichen<br />
Bewegungsapparates im Allgemeinen und mit rheumatischen<br />
Erkrankungen im Kindesalter im Speziellen.<br />
Trifft das auch für Zürich zu? Leider ja! Die bis Ende der<br />
90er-Jahre am <strong>Kinder</strong>spital Zürich ausgebildeten Pädiater hatten<br />
keine Gelegenheit, eine rheumatologische Untersuchung, zum<br />
Beispiel im Rahmen einer Rotationsstelle, zu üben. Sie wurden<br />
bestenfalls anlässlich von Notfallkonsultationen oder im (seltenen)<br />
Fall einer Hospitalisation mit rheumatologischen Patienten<br />
konfrontiert. Entsprechend ist das Wissen über die rheumatologischen<br />
Krankheiten bei niedergelassenen Pädiatern sehr unterschiedlich,<br />
abhängig von persönlichen Interessen und besuchten<br />
Fortbildungen, und darf fairerweise nicht generell vorausgesetzt<br />
werden. Die seit der Jahrtausendwende am <strong>Kinder</strong>spital Zürich<br />
ausgebildeten Pädiater profitieren von regelmässigen internen<br />
Fortbildungen und der Tatsache, dass es eine Spezialabteilung für<br />
<strong><strong>Rheuma</strong>tologie</strong> gibt, auch wenn natürlich aus organisatorischen<br />
Gründen weiterhin nur ein kleiner Teil der hier ausgebildeten<br />
Pädiater eine Rotation in der <strong><strong>Rheuma</strong>tologie</strong> absolvieren kann.<br />
Hingegen gibt es seit der Reform des Medizinstudiums 2005, mit<br />
der die allgemeinen Pädiatrie-Vorlesungen abgeschafft wurden,<br />
in Zürich keine Vorlesungen mehr über rheumatische Erkrankungen<br />
im Kindesalter. Mit anderen Worten: Ein Grossteil der<br />
zuweisenden Pädiater oder Hausärzte haben während ihrer Ausund<br />
Weiterbildung wenig bis gar nichts über rheumatische<br />
Erkrankungen im Kindesalter erfahren! Und das, obwohl die<br />
rheumatischen Krankheiten im Kindesalter gar nicht selten sind.<br />
Immerhin ein bis zwei pro 1000 <strong>Kinder</strong> sind davon betroffen, also<br />
2000 bis 3000 <strong>Kinder</strong> in der <strong>Schweiz</strong>. <strong>Rheuma</strong> ist bei <strong>Kinder</strong>n<br />
häufiger als zum Beispiel Krebs oder Diabetes. Und es gibt viele<br />
seltene Erkrankungen, denen im Medizinstudium ein höherer<br />
Stellenwert eingeräumt wird.<br />
Die Konsultationszahlen der <strong><strong>Rheuma</strong>tologie</strong> am <strong>Kinder</strong>spital<br />
Zürich haben sich seit Ende 2005 verdoppelt. In der gleichen<br />
Zeit konnte das Stellenkontingent aber nur um zehn Pro-<br />
Dieses sechsjährige Kind hat aufgrund seiner Arthritis in<br />
Füssen und Kniegelenken bereits erhebliche Kontrakturen<br />
entwickelt. Diese wirken sich auf die gesamte Körperhaltung<br />
aus und verursachen zusätzliche Fehlstellungen auch in nicht<br />
entzündeten Gelenken. Man kann sich unschwer vorstellen,<br />
dass sich eine solche Gelenkstellung beim weiteren Wachstum<br />
fatal auswirkt.<br />
zent erhöht werden. Aufgrund des langwierigen Bewilligungsprozesses<br />
für neue Stellen (der Budget-Antrag für 2010 erfolgte<br />
im Sommer 2009 auf Basis der Zahlen von 2008) ist es bei einer<br />
so rasch wachsenden Sprechstunde praktisch unmöglich, die<br />
tatsächlich benötigten Stellen rechtzeitig zu beantragen,<br />
geschweige denn, sie auch noch bewilligt zu bekommen. Im<br />
Gegenteil müssen wir uns jetzt sogar wehren, damit unsere<br />
bestehenden Stellen nicht noch gekürzt werden. Natürlich treffen<br />
die Sparmassnahmen alle. Die Diskrepanz zwischen den<br />
Ansprüchen der Patienten nach unverzüglicher und qualitativ<br />
hochstehender Behandlung und der Forderung der Gesundheitspolitiker<br />
nach Kostenreduktion ist für alle, ob Spital oder<br />
Praxis, zunehmend belastend. Aber das rasche Wachstum –<br />
früher hätte die Spitalverwaltung ob einer so erfolg- und ertragreichen<br />
Lancierung einer Marktnische jubiliert, aber neuerdings<br />
sollen ja jetzt die ambulanten Spezialsprechstunden für die<br />
Kostenexplosion verantwortlich sein – ohne entsprechende<br />
Ressourcenanpassung führt dazu, dass die Sparmassnahmen die<br />
<strong><strong>Rheuma</strong>tologie</strong>, wie auch andere im Aufbau begriffene Spezialitäten,<br />
in einer anderen Ausgangslage treffen als schon länger<br />
etablierte Spezialgebiete.<br />
Trotz der vielen Erfolge, der deutlich verbessserten Behandlung<br />
und Betreuung der Patienten, der besseren Ausbildung<br />
zukünftiger Pädiater und dem neuen Weiterbildungstitel ist also<br />
das neue Spezialgebiet «Pädiatrische <strong><strong>Rheuma</strong>tologie</strong>» durch die<br />
Wirtschaftskrise und die Sparmassnahmen besonders empfindlich<br />
betroffen. Hoffen wir deshalb, dass die Verantwortlichen<br />
diese spezielle Gefährdung rechtzeitig erkennen und verhindern<br />
können, dass es zu Einbrüchen in der Patientenversorgung<br />
kommt, die unweigerlich zu einer erneuten nicht verantwortbaren<br />
Zunahme der krankheitsbedingten Folgeschäden bei<br />
rheumakranken <strong>Kinder</strong>n führen würden.
Eine dicke Wade mit seltener Ursache<br />
Ein 31-jähriger Patient stellt sich mit einer dicken Wade vor. Eine Venenthrombose ist es nicht.<br />
Eine rupturierte Bakerzyste auch nicht. Was aber ist es dann?<br />
Anamnese<br />
Bei dem 31-jährigen Patienten trat im Frühjahr 2007, nach<br />
einem Tag Skifahren, eine ausgeprägte, schmerzlose Schwellung<br />
des rechten Unterschenkels auf. Eine Krafteinbusse<br />
bestand nicht. Ein Trauma war nicht zu eruieren. Rückblickend<br />
waren dem Patienten bereits zwei Jahre zuvor eine langsam<br />
progrediente Umfangszunahme des rechten Unterschenkels<br />
sowie vereinzelt Muskelfaszikulationen und eine Neigung zu<br />
Muskelkrämpfen aufgefallen. Weitere Beschwerden wie Lähmungen<br />
oder eine Steifigkeit der Beine wurden verneint. Der<br />
Allgemeinzustand war gut.<br />
Aus der persönlichen Anamnese sind eine Operation wegen<br />
eines Osteidosteoms an der linken Fibula im Alter von zehn<br />
Jahren sowie die operative Versorgung einer Kreuzbandruptur<br />
am linken Knie im Jahre 2000 zu erwähnen. Ausserdem bestanden<br />
bei dem Patienten seit vier bis fünf Jahren intermittierende,<br />
leichte bis mässige Beschwerden von Seiten eines lumboradikulären<br />
Schmerzsyndroms der Wurzel S1 rechts mit persistierendem<br />
Taubheitsgefühl am lateralen Fussrand, jedoch ohne<br />
Kraftverminderung. Im Jahr 2005 war mittels MRI eine Nervenwurzel-kompressive<br />
Diskushernie L5/S1 rechts nachgewiesen<br />
worden. Es erfolgte eine konservative Behandlung. Weiter war<br />
seit zehn Jahren eine ätiologisch unklare Polyglobulie bekannt.<br />
Operative Eingriffe am rechten Bein konnten nicht eruiert werden,<br />
die Infekt- und Reise-Anamnese waren negativ, und ein<br />
Zeckenstich war dem Patienten nicht erinnerlich. Die Einnahme<br />
oder Injektion von Medikamenten oder Anabolika wurde<br />
verneint. Der Patient war Raucher.<br />
Klinik<br />
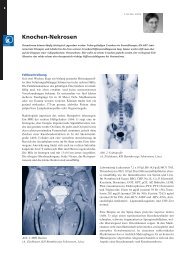
Es imponierte eine ausgeprägte Verdickung der rechten Wade<br />
(Umfangsdifferenz von fünf Zentimeter zugunsten von rechts)<br />
mit gut eindrückbarem Ödem am gesamten rechten Unterschenkel<br />
(Abb. 1). Fussspitzen- und Fersenstand waren auch im<br />
Einbeinstand normal. Es fand sich eine Hyposensibilität im<br />
Dermatom S1 rechts, vorwiegend an der lateralen Fusskante.<br />
Der Achillessehnenreflex war rechts auch mit Bahnung nicht<br />
auslösbar, links normal. Der Patellarsehnenreflex war beidseits<br />
normal, der Tibialis posterior-Reflex beidseits nicht auslösbar.<br />
Der Lasègue und das Babinski-Zeichen waren beidseits negativ.<br />
Im Bereich der verdickten, rechten Wade konnten mehrere<br />
Muskelfaszikulationen beobachtet werden. Der übrige Status<br />
war unauffällig.<br />
ANDREA STÄRKLE-BÄR<br />
Laboruntersuchungen<br />
Es fielen erhöhte Werte für CK total (823 U/l, Norm < 190),<br />
CK-MB (39 U/l, Norm < 24), Myoglobin (117 U/l, Norm 28 -<br />
72), GOT (51 U/l, Norm 10 - 50), GPT (88U/l, Norm < 50) und<br />
LDH (520 U/l, Norm 240 - 420) auf. Blutsenkung und CRP<br />
waren normal. Im Blutbild war die bekannte Polyglobulie mit<br />
einem Hb-Wert von 17.4g/dl (Norm 13.4-17.0) mit normalen<br />
Indices zu erkennen. Leukozyten und Thrombozyten waren<br />
normal. Die immunologischen Untersuchungen ergaben ANA<br />
von 1:80. Anti-native DNA, anti-PL7, anti-Ku, anti-PL12, anti-<br />
Mi2, anti-Jo und anti-PM Scl-AK waren negativ, die HCV- und<br />
HIV-Serologien waren unauffällig, es lag ein Impfstatus gegen<br />
Hepatitis B vor. Die Borrelien-Serologie war negativ.<br />
Bildgebung<br />
Eine tiefe Venenthrombose des rechten Unterschenkels wurde<br />
duplexsonographisch ausgeschlossen. Die Mikrolymphographie<br />
ergab ein Lymphödem. Mittels Computertomographie konnte<br />
eine intrathorakale oder intraabdominale Raumforderung als<br />
Ursache des Lymphödems ausgeschlossen werden. Es stellten<br />
sich lediglich vereinzelte, unspezifische kleine Lungennoduli<br />
von maximal 3mm Durchmesser sowie ein grenzwertig grosser<br />
Lymphknoten hilär rechts von 10mm Durchmesser dar. Die<br />
Abb. 1: Verdickung der rechten Wade.<br />
51–2009<br />
KASUISTIK<br />
5
6<br />
KASUISTIK<br />
MRI-Untersuchung der Wadenmuskulatur zeigte eine diffuse<br />
Auftreibung des M. soleus und des M. gastrocnemius medialis<br />
mit inhomogener STIR-Alteration und inhomogener Kontrastmittelaufnahme<br />
sowie eine partielle Atrophie des M. gastrocnemius<br />
lateralis (Abb. 2, 3). Differenzialdiagnostisch wurden eine<br />
Myositis und eine diffuse Raumforderung diskutiert.<br />
Histologie<br />
Die Muskelbiopsie ergab Zeichen einer inflammatorischen Myopathie<br />
mit Einzelfasernekrosen und Myophagien sowie ein endomysiales<br />
entzündliches Infiltrat. Es fanden sich Kaliberschwankungen<br />
der Muskelfasern mit atrophen und hypertrophen Fasern<br />
als Zeichen der Denervation. Die pathologische Hochregulation<br />
von MHC-Klasse-I-Molekülen auf den Muskelfasern, die unauffällige<br />
Dichte der Kapillaren und die geringe CD8-positive Entzündungskomponente<br />
sprachen für eine inflammatorische Myopathie<br />
vom Typ einer Polymyositis (Abb. 4, 5).<br />
Auch eine nochmalige klinische Untersuchung ergab keine<br />
Anhaltspunkte für weitere, entzündlich befallene Muskelgruppen.<br />
Auch die ergänzend durchgeführte PET-Untersuchung<br />
zeigte keinen weiteren Myositisbefall, es kam lediglich der<br />
bekannte entzündliche Befall des M. soleus und eines kleinen<br />
Anteiles des M. gastrocnemius medialis rechts zur Darstellung.<br />
Therapie<br />
Mit der Verdachtsdiagnose einer sich unilokulär manifestierenden<br />
Polymyositis mit begleitendem Lymphödem wurde eine<br />
Therapie mit Prednison (1mg/kgKG) eingeleitet, was im Verlauf<br />
zu einer leichten Abnahme des Spannungsgefühls in der Wade,<br />
nicht aber zu einem relevanten Rückgang der Schwellung<br />
führte. Die CK-, Myoglobin- und Transaminasenwerte blieben<br />
Abb. 2: MRI Unterschenkel coronar STIR-Sequenz.<br />
Abb. 3: MRI Unterschenkel rechts axial T1-gewichtet nach<br />
Kontrastmittelgabe.<br />
praktisch unverändert erhöht. Die Therapie wurde deshalb<br />
intensiviert. Es erfolgten einerseits Solumedrolstösse (ein Tag<br />
1000mg i.v., danach zwei Tage 500mg i.v.), und es wurde eine<br />
Methotrexat-Medikation in aufsteigender Dosierung bis zu<br />
einer Dosis von 25mg subkutan pro Woche eingeleitet. Die peroralen<br />
Steroide wurden im Verlauf langsam reduziert. Ein<br />
Rückgang der Wadenschwellung oder ein Rückgang der Laborparameter<br />
waren darunter jedoch weiterhin nicht zu verzeichnen.<br />
Der Patient nahm unter den Steroiden lediglich an<br />
Gewicht zu und musste sich einmalig wegen eines Mundsoors<br />
behandeln lassen.<br />
Verlauf<br />
CT von Thorax und Abdomen wurden nach drei Monaten<br />
wiederholt, die Lungennoduli und der vergrösserte Lymphknoten<br />
hilär rechts waren grössenstationär. Wegen der ätiologisch<br />
unklaren Polyglobulie wurde eine Knochenmarkspunktion<br />
durchgeführt, welche keine wegweisenden Befunde ergab.<br />
Wegen Unwirksamkeit wurde Methotrexat schliesslich wieder<br />
sistiert, dann Prednison nach insgesamt sechs Monaten<br />
Behandlung ausgeschlichen. Klinik und Befunde blieben<br />
unverändert. Eine Verlaufs-MRI-Untersuchung der rechten<br />
Wade, ein Jahr nach dem ersten MRI, zeigte einen unverändert<br />
aufgetriebenen M. soleus und eine partielle Auftreibung des<br />
M. gastrocnemius medialis mit inhomogener STIR-Alteration<br />
und diffuser Kontrastmittelaufnahme bei unverändert partiell<br />
atrophiertem M. gastrocnemius lateralis.<br />
Diskussion<br />
Wir präsentieren einen Fall mit einer isolierten, hypertrophen<br />
Myositis der Soleus- und Gastrocnemius-Muskulatur rechts,<br />
welche histologisch zu einer Polymyositis passte. Erstaunlicher-
Abb. 4: Biopsie der Skelettmuskulatur des M. soleus:<br />
HE-Färbung mit Muskelfaseratrophien (Pfeile).<br />
weise konnte durch die Gabe von Steroiden und Methotrexat<br />
kein Rückgang der CK-Werte beobachtet werden, wie das üblicherweise<br />
bei entzündlichen Myopathien der Fall ist. Inwiefern<br />
die histologisch nachgewiesene Entzündungskomponente auf<br />
die Steroid- und Methotrexat-Medikation reagiert hat, kann<br />
mangels erneuter Muskelbiopsie nicht beurteilt werden.<br />
Die fokale Myositis ist eine seltene Erkrankung. Es handelt<br />
sich um eine umschriebene, mit einer Volumenzunahme einhergehende<br />
Entzündung in einem einzelnen oder in wenigen<br />
Skelettmuskeln. Es sind bevorzugt Muskelgruppen der unteren<br />
Extremitäten betroffen. Die unterschiedlichen klinischen Verläufe<br />
mit gelegentlichem Übergang in eine Polymyositis, mit<br />
chronisch fokalem Verlauf oder rascher spontaner Remission<br />
sprechen dafür, dass die fokale Myositis ätiologisch und pathogenetisch<br />
eine heterogene Krankheitsgruppe darstellt. Die Differenzialdiagnosen<br />
einer fokalen hypertrophen Myositis sind in<br />
Tab. 1 zusammengestellt.<br />
Bei unserem Patienten lag anamnestisch ein lumboradikuläres<br />
Schmerz- und sensorisches Ausfallssyndrom der Wurzel S1<br />
rechts vor. 2005 war mittels MRI eine Nervenwurzel-kompressive<br />
Diskushernie L5/S1 rechts nachgewiesen worden. Die Bilder<br />
lagen uns nicht vor. Eine erneute MRI-Untersuchung der<br />
LWS zeigte eine erstaunlich grosse, partiell sequestrierte Diskushernie<br />
rechts im Segment L5/S1 mit rezessaler und foraminaler<br />
Einengung sowie Kompression der Wurzel S1 (Abb. 6, 7).<br />
Die elektrophysiologische Untersuchung mit Zeichen einer<br />
chronisch-neurogenen Schädigung des M. gastrocnemius rechts<br />
sowie pathologischen Spontanaktivitäten, vor allem in Form<br />
von pseudomyotonen Entladungen und Faszikulationen im<br />
S1-Myotom, passten sehr gut zur klinischen Verdachtsdiagnose<br />
einer chronischen, diskogen-kompressiven S1-Radikulopathie<br />
rechts mit neurogener Hypertrophie der Wadenmuskulatur.<br />
Abb. 5: Biopsie der Skelettmuskulatur des M. soleus:<br />
ATPase bei pH 4.2 mit dunkel angefärbten atrophen<br />
Typ-I-Fasern und hellen hypertrophen Typ-II-Fasern.<br />
Fokale hypertrophe Myositis – Differenzialdiagnosen<br />
Neoplasie<br />
Noduläre fokale Myositis<br />
❙ Umschriebene, pseudotumoröse Veränderung der Skelettmuskulatur<br />
❙ In der Regel normale BSG und CK<br />
❙ Histologisch oft starke Entzündungszeichen, gelegentlich<br />
Denervationszeichen<br />
❙ Häufig gutartiger Verlauf mit spontaner Remission<br />
Proliferative Myositis<br />
❙ Entwicklung rasch im Verlauf von Tagen<br />
❙ Bevorzugter Befall von Muskeln des Kopfes, Halses und<br />
Schultergürtels<br />
❙ Gut abgrenzbare Tumoren von wenigen Zentimetern Grösse<br />
❙ Histologisch starke Proliferation an Fibroblasten, keine Muskelnekrosen,<br />
kein entzündliches Infiltrat<br />
Myositis ossificans<br />
❙ Schnell wachsende, schmerzhafte intramuskuläre<br />
Weichteilschwellungen<br />
❙ Vorwiegend an den Extremitäten<br />
❙ Histologisch Ossifikationen, ausgehend von Bindegewegssepten<br />
Hypertrophe Myositis bei Borreliose<br />
Neurogene Muskelhypertrophien (bei Denervation)<br />
❙ bei lumboradikulären Reizsyndromen<br />
Tab. 1<br />
51–2009<br />
7
8<br />
KASUISTIK<br />
Dass es im Rahmen eines Denervationsprozesses zu einer<br />
Muskelhypertrophie kommt, ist erstaunlich. Neurogene Störungen<br />
wie eine periphere Neuropathie oder eine Radikulopathie<br />
sind in der Regel mit einer Muskelatrophie assoziiert. Der<br />
Pathomechanismus, welcher zu einer neurogenen Muskelhypertrophie<br />
führt, ist unklar.<br />
Mögliche, zur Hypertrophie führende Mechanismen<br />
in partiell denervierter Muskulatur<br />
❙ Geringe Traumen an der denervierten Muskulatur führen zu<br />
pathologischen Reparaturmechanismen in der Muskulatur,<br />
welche in eine Muskelhypertrophie münden<br />
❙ Im unvollständig denervierten Muskel kommt es zu einem<br />
chronischen, falschen Innervationsmuster (chaotisch), was zu<br />
Mikrotraumen an den Muskelfasern und zu einer sekundären<br />
Entzündung führen kann<br />
Tab. 2<br />
In partiell denervierten, hypertrophen Muskeln kann häufig<br />
eine vermehrte spontane Muskelaktivität beobachtet werden.<br />
Da dieses Phänomen allerdings nur in der Hälfte der Fälle von<br />
neurogenen Muskelhypertrophien auftritt, müssen noch andere,<br />
zur Muskelhypertrophie führende Mechanismen zu Grunde<br />
liegen (Gutmann et al., 1993)<br />
Abb. 6: MRI LWS sagittal T2-gewichtet.<br />
Abb. 7: MRI LWS axial Höhe L5/S1 T2-gewichtet.<br />
Erstaunlich ist, dass wir es bei unserem Patienten nicht nur mit<br />
einer neurogenen Muskelhypertrophie, sondern auch mit einer<br />
Entzündungsreaktion im Sinne einer auto-immunen Myositis<br />
zu tun hatten. Der Mechanismus, welcher in einem denervierten<br />
Muskel zu einer entzündlichen Reaktion führen kann, ist<br />
unklar. Experimentell konnte gezeigt werden, dass denervierte<br />
Mäusemuskeln mit einer mononukleären, entzündlichen Reaktion<br />
mit CD8+-Lymphozyten und einer verstärkten Expression<br />
von MHC-Klasse-I-Molekülen reagieren. Die massive Apoptose<br />
der denervierten Muskelzellen und die daraus resultierende<br />
Antigenpräsentation werden als Trigger für die entzündliche<br />
Reaktion angesehen (Kampman et al.). Auch in der Muskelbiopsie<br />
unseres Patienten fanden sich eine mononukleäre entzündliche<br />
Reaktion mit leichter Dominanz von CD8+-Lymphozyten<br />
und eine Überexpression von MHC-Klasse-I-Molekülen.<br />
Der klinische Verlauf einer neurogenen Muskelhypertrophie<br />
ist in der Regel langsam fortschreitend und scheint sich im Verlauf<br />
zu stabilisieren oder über mehrere Monate zurückzubilden.<br />
Ein Übergang in eine diffuse Myositis (Polymyositis oder<br />
Dermatomyositis) kommt nicht vor. Aus therapeutischer Sicht<br />
scheint eine Behandlung mit Kortikosteroiden insgesamt wenig<br />
Effekt zu haben.<br />
Aufgrund dieser Erkenntnisse haben wir bei unserem Patienten<br />
von einer weiteren immunsuppressiven Therapie abgesehen.<br />
Wegen der nur geringen lumboradikulären Schmerzen<br />
bestand bis anhin keine Indikation für eine operative Sanierung<br />
der Diskushernie. Ob mit der operativen Entlastung der<br />
Nervenwurzel ein Benefit bezüglich störender Wadenhypertrophie<br />
erzielt werden könnte, ist unklar. In der Literatur konnten<br />
wir keine Hinweise dafür finden. Vielmehr gibt es mehrere<br />
Fallberichte, wo es erst nach operativer und erfolgreicher<br />
Sanierung einer neurokompressiv wirksamen Diskushernie zu
einer Wadenhypertrophie gekommen ist (J. Costa et al.). Einige<br />
Daten weisen auf eine gute Wirksamkeit von fraktionierten<br />
Botulinus-Toxin-Injektionen in die hypertrophe Wadenmuskulatur<br />
hin. In einem partiell denervierten Muskel soll damit die<br />
neuromuskuläre Impulsübertragung an den noch innervierten<br />
Muskelfasern unterbrochen werden mit dem Ziel, eine Muskelatrophie<br />
zu begünstigen (Chemodenervation) (J. Costa et al.).<br />
Unser Patient weist bis heute einen stabilen Verlauf bezüglich<br />
der Muskelhypertrophie auf. Von Seiten des lumboradikulären<br />
Reizsyndroms der Wurzel S1 ist er weitgehend beschwerdefrei.<br />
Wir werden nun bald ein Verlaufs-MRI der Wade und allenfalls<br />
eine erneute Muskelbiopsie durchführen. Danach werden wir<br />
mit dem Patienten entscheiden, ob Botox-Injektionen durchgeführt<br />
werden sollen. Auf den weiteren Verlauf sind wir<br />
gespannt.<br />
Literatur<br />
1 Charlot-Lamprecht I, Brochot P, Noblet H, Vaorquier<br />
C, Eschard J-P: Neurogentic muscle hypertrophy. Joint,<br />
Bone, Spine 76:401-403, 2009.<br />
2 Costa J, Graça P, Evangelista T, de Carvalho M: Pain<br />
and calf hypertrophy associated with spontanous<br />
repetitive discharges treated with botulinum toxin.<br />
Clin Neurophys 116:2847-2852, 2005.<br />
3 Finger DR, Dennis GJ: Focal myositis. J <strong>Rheuma</strong>tol<br />
22:188-189, 1995.<br />
4 Flaisler F, Blin D, Asecio G; Focal myositis: a localized<br />
form of polymyositis? J <strong>Rheuma</strong>tol 32:1101-1104, 1993.<br />
5 Gaeta M, Mazziotti S, Minutoli F, Genitori A, Toscano<br />
A, Rodolico C, Blandino A: MRI imaging findings of<br />
focal myositis: a pseudotumor that may mimic muscle<br />
neoplasm. Skeletal Radiology 38:571-578, 2009.<br />
6 Gross R, Degive C, Dermis E, Plat M Dubourg O,<br />
Puéchal X: Semin Arthritis Rheum 38:20-27, 2008.<br />
7 Gutmann E, Schiaffino S, Hanzlikova V: Mechanism of<br />
compensatory hypertrophy in skeletal muscle of the<br />
rat. Experimental Neurol 31:451-464 1971.<br />
8 Gutmann L: AAEM Minimonograph 46: Neurogenic<br />
muscle hypertrophy. Muscle Nerve 19:811-818, 1996.<br />
9 Gutmann LA, Gutmann L, Schochett SS: Spontaneous<br />
repetitive discharge and muscle hypertrophy. Muscle<br />
Nerve 16:1093, 1993.<br />
10 Heffner RR Jr, Barron SA: Denervating changes in<br />
focal myositis, a benign inflammatory pseudotumor.<br />
Arch Pathol Lab Med 104:261-264, 1980.<br />
11 Holmgren AR, Matterson E L: Lyme Myositis.<br />
Arthritis and <strong>Rheuma</strong>tism 54:2697-2700, 2006.<br />
12 Kampman M, Lafond Benestad S, Fladby T, Maehlen<br />
J: Denervation enhances spontaneous inflammatory<br />
myopathy in SJL mice. Muscel Nerve 22:883-888, 1999.<br />
13 Kocanaogullari H, Ozdemir E, Keser G, Tuncbay T,<br />
Gumusdis G, Doganavsargil E: Focal myositis. Clinical<br />
<strong>Rheuma</strong>tology 17:65-76, 1998.<br />
14 Kransdorf MJ, Temple ThE, Sweet DE. Focal myositis:<br />
Skeletal Radiology 27:283-287, 1998.<br />
15 Naughtan M, Jessop JD, Williams BD: Idiopathic<br />
recurrent non-suppurativ focal myositis: a report of<br />
two cases. Br J <strong>Rheuma</strong>tol 32:1101-1104, 1993.<br />
16 Schmutzhard E, Willeit J, Gerstenband F:<br />
Meningopolyneuritis Bannwarth with focal nodular<br />
myositis. A new aspect in Lyme borreliosis. Klin<br />
Wochenschr 64:1204-1208, 1996.<br />
17 Streichenberger N, Meyronet D, Fiere V, Pellissier J-F,<br />
Petiot Ph: Focal myositis associated with S1 radiculopathy:<br />
report of two cases. Muscle Nerve 29:443-446,<br />
2004.<br />
18 Vercelli-Retta J, Ardao G, De Cabrera M: Focal<br />
Myositis and its differential diagnosis. A case report<br />
and review of the literature. Ann Pathol 8:54-56,1988.<br />
19 Zwick M, Teng L, Mu X, Springer JE, Davis BM:<br />
Overexpression of GDNF induces and maintains<br />
hyperinnervation of muscle fibers and multiple endplate<br />
formation. Experimental Neurology 171:342-350,<br />
2001.<br />
51–2009<br />
9
10<br />
STATE OF THE ART<br />
Polymyositis und Dermatomyositis –<br />
Manifestationsformen und aktuelle Behandlungsmöglichkeiten<br />
Klinische Manifestationsformen<br />
Konstitutionelle Symptome<br />
Allgemeinsymptome wie Abgeschlagenheit, Fieber und<br />
Gewichtsverlust sind insbesondere bei der Erstmanifestation<br />
häufig. Bei anhaltender schwerer Allgemeinsymptomatik ist<br />
auch an das Vorliegen einer assoziierten malignen Erkrankung<br />
zu denken.<br />
Muskuläre Manifestationen<br />
Muskelschwäche ist das wichtigste Symptom der entzündlichen<br />
Myopathien. Zumeist ist die proximale Muskulatur in symmetrischer<br />
Weise betroffen. Der Beginn ist oft schleichend über<br />
mehrere Monate (Tab. 1). Typischerweise haben Myositispatienten<br />
Probleme beim Aufstehen aus dem Sitzen und beim Aufwärtsgehen<br />
oder Treppensteigen. In schwereren Fällen kann<br />
auch die Pharynxmuskulatur betroffen sein, was zu Schluckstörungen,<br />
Aspirationsgefahr und auch zu Artikulationsproblemen<br />
führen kann. Ein Befall der Atemmuskulatur kann zur respiratorischen<br />
Globalinsuffizienz führen. Myalgien und muskuläre<br />
Druckdolenzen sind ebenfalls Teil der klinischen Präsentation,<br />
kommen aber nur in weniger als der Hälfte der Fälle vor. Die<br />
Schmerzen sind meist eher gering ausgeprägt und treten vor<br />
allem bei Belastung auf. Muskelatrophien sind meist bei längerem<br />
und schwerem Verlauf als Spätschäden zu beobachten 1,2 .<br />
Ein Befall der Herzmuskulatur kommt nicht selten vor, ist<br />
jedoch häufig subklinisch und meist prognostisch nicht relevant<br />
3 .<br />
Hautmanifestationen<br />
Verschiedene, meist erythematös bis violett gefärbte Hautbefunde<br />
sind charakteristisch für die Dermatomyositis. Pathognomonisch<br />
sind Gottron-Papeln erythematöse bis violette, oft<br />
schuppende Papeln an den Streckseiten der Fingergelenke, seltener<br />
auch an anderen Gelenken (Abbildung). Sind diese<br />
Befunde nicht erhaben, sondern makulös, spricht man vom<br />
Gottron-Zeichen. An den Händen findet man als Gefässmanifestation<br />
häufig ein Raynaud-Syndrom. Die Dermatomyositis<br />
MATTHIAS KIRRSTETTER, OLIVER DISTLER<br />
Polymyositis und Dermatomyositis gehören zur Gruppe der entzündlichen Bindegewebserkrankungen (Kollagenosen).<br />
Gemeinsames klinisches Leitsymptom ist eine oft schleichend auftretende symmetrische Schwäche der proximalen Muskulatur.<br />
Bei der Dermatomyositis liegen zusätzlich charakteristische Hautmanifestationen vor. Bei beiden Erkrankungen können<br />
weitere Organe, insbesondere die Lungen, von entzündlichen Manifestationen betroffen sein. Einige Antikörperbefunde sind<br />
hierbei mit spezifischen klinischen Manifestationen assoziiert. Ein Muskelbefall kann auch bei anderen entzündlichen<br />
Bindegewebserkrankungen wie dem systemischen Lupus erythematodes, der anti-U1-RNP-positiven Mischkollagenose (MCTD,<br />
ehemals Sharp-Syndrom) und der systemischen Sklerose auftreten und ist dann im Regelfall als Teil der jeweiligen Kollagenose<br />
zu interpretieren. Der folgende Artikel konzentriert sich auf die primäre Poly- und Dermatomyositis.<br />
weist zudem typische Kapillarmikroskopie-Veränderungen mit<br />
Riesenkapillaren, Mikroblutungen und Umbauten der Kapillararchitektur<br />
auf. Des Weiteren können periunguale Rötungen<br />
auftreten. Das heliotrope Exanthem (benannt nach Heliotropium<br />
arborescens, der violett blühenden Vanilleblume) ist ein<br />
violettes bis erythematöses, häufig mit einem Ödem vergesellschaftetes<br />
Exanthem der Augenlider. Erytheme treten auch an<br />
anderen, häufig an den UV-exponierten Hautpartien auf.<br />
Gottron-Papeln bei einem Patienten mit Dermatomyositis.<br />
Charakteristika des Muskelbefalls bei Myositiden<br />
❙ Leitsymptom: Muskelschwäche<br />
❙ Seltener Muskelschmerzen<br />
❙ Symmetrisch, bilateral<br />
❙ Proximale Muskeln<br />
❙ Beginn: Tage bis Monate<br />
❙ Langjähriger, schwerer Verlauf: Muskelatrophie<br />
Tab. 1
Je nach Lokalisation spricht man dann beispielsweise vom<br />
V-Zeichen (Ausschnitt) oder Schal-Zeichen. Ein häufiger<br />
Befund bei der juvenilen Dermatomyositis ist eine oft ausgeprägte<br />
Calcinosis cutis, vor allem an mechanisch belasteten<br />
Hautpartien. Möglich ist bei der Dermatomyositis auch ein isolierter<br />
Hautbefall ohne muskuläre Manifestation, die sogenannte<br />
amyopathische Dermatomyositis oder Dermatomyositis<br />
sine Myositis. «Mechanikerhände», radial betonte Hyperkeratosen<br />
mit Schuppung und Fissuren, sind häufig mit dem<br />
Vorkommen von Jo-1-Antikörpern assoziiert 1,2 .<br />
Lungenmanifestationen<br />
Interstitielle Lungenerkrankungen sind die häufigste extramuskuläre<br />
Manifestation der Polymyositis und Dermatomyositis<br />
(Tab. 2) und für die Prognose bestimmend. Es kommen<br />
dabei verschiedene histopathologische Formen vor. Die klinischen<br />
Verläufe sind extrem variabel. Zur Diagnostik werden<br />
vor allem die Dünnschicht-Computertomographie und die<br />
Lungenfunktionsuntersuchung, einschliesslich Messung der<br />
CO-Diffusionskapazität, eingesetzt. Ziel ist die frühzeitige<br />
Identifizierung von klinisch rasch progredienten Verläufen, die<br />
dann einer immunsuppressiven Therapie, meist mit Cyclophosphamid,<br />
zugeführt oder in entsprechende Therapiestudien eingeschlossen<br />
werden sollten. Neben den eigentlichen pulmonalen<br />
Pathologien können auch die Myositis der Atemmuskulatur<br />
und Aspirationspneumonien den pulmonalen Gasaustausch<br />
behindern 4 .<br />
Extramuskuläre Manifestationen der Polymyositis<br />
❙ Haut (Dermatomyositis)<br />
❙ Allgemeinsymptome (Abgeschlagenheit, Fieber, Gewichtsverlust)<br />
❙ Raynaud-Symptomatik<br />
❙ Interstitielle Lungenerkrankung<br />
❙ Arthralgien /Arthritiden<br />
Tab. 2<br />
Gelenkmanifestationen<br />
Arthralgien und Arthritiden sind häufig, jedoch meist eher<br />
gering ausgeprägt. Sie ähneln in ihrem Verteilungsmuster der<br />
rheumatoiden Arthritis, sind aber meist nicht erosiv. Eine Ausnahme<br />
stellt die anti-Jo-1-Antikörper-assoziierte Myositis dar,<br />
bei der die Gelenkmanifestationen prominent sein können und<br />
dann mit einer zum Teil deformierenden, anerosiven Arthropathie<br />
im Sinne einer Jaccoud-Arthritis verbunden sind.<br />
Assoziierte maligne Erkrankungen<br />
Vor allem die Dermatomyositis kann mit malignen Erkrankungen<br />
assoziiert sein. Häufiger tritt die Dermatomyositis in diesen<br />
Fällen parallel zum Tumor auf, oder der Tumor wurde bereits<br />
im Vorfeld diagnostiziert. Die maligne Erkrankung kann sich<br />
jedoch auch nach der Dermatomyositis manifestieren. Das<br />
Krankheitskonstellationen der Dermatomyositis<br />
mit erhöhtem Risiko für assoziierte maligne<br />
Erkrankungen (nach 3 )<br />
❙ Alter bei Diagnose > 52 Jahre<br />
❙ Hautnekrose<br />
❙ Männer<br />
❙ Schnelles klinisches Vollbild<br />
❙ Periunguales Erythem<br />
❙ Niedrige Komplementspiegel<br />
❙ Leukozytoklastische Vaskulitis<br />
❙ Amyopathische Dermatomyositis<br />
Tab. 3<br />
Risiko ist in den ersten drei Jahren nach Diagnosestellung am<br />
grössten, bleibt aber während des gesamten Krankheitsverlaufs<br />
erhöht. Die Dermatomyositis ist mit zahlreichen verschiedenen<br />
Tumoren assoziiert, ohne dass sich eine spezifische Präferenz<br />
identifizieren lässt 5 . Somit stellt sich die Frage nach Art und<br />
Umfang eines Tumor-Screenings bei Diagnosestellung einer<br />
Dermatomyositis. Wir empfehlen ein angepasstes Screening,<br />
entsprechend den jeweiligen individuellen Risikofaktoren,<br />
unter Berücksichtigung von Geschlecht und Alter. Tab. 3 fasst<br />
Krankheitskonstellationen der Dermatomyositis zusammen,<br />
die mit einem höheren Risiko für eine assoziierte maligne<br />
Erkrankung verbunden sind. Bei diesen Patienten kann ein<br />
ausgedehnteres Tumor-Screening lohnend sein.<br />
Diagnostik<br />
Labor<br />
Muskelenzyme werden durch die entzündungsbedingte Schädigung<br />
der Muskelzellen in das Blut freigesetzt. Sie sind ein wichtiger<br />
Parameter für Diagnostik und Verlauf entzündlicher Myopathien.<br />
Bei aktiver Erkrankung ist in den meisten Fällen eine<br />
Erhöhung nachweisbar. Allerdings können, insbesondere im<br />
Spätstadium mit Muskelatrophien, die Muskelenzyme trotz<br />
vorhandener Entzündungsaktivität im Normbereich liegen.<br />
Wichtigste Parameter sind die Kreatinkinase (CK) und das<br />
Myoglobin. Wertvoll sind jedoch ebenfalls LDH, GOT (AST)<br />
und GPT (ALT).<br />
Autoantikörper sind ein wichtiges Hilfsmittel in der Diagnostik<br />
entzündlicher Myopathien. Der häufigste (bis zu 80 Prozent),<br />
jedoch unspezifische Befund ist der Nachweis von antinukleären<br />
Antikörpern (ANA). Wegweisend für die Diagnostik ist<br />
der Nachweis sogenannter Myositis-spezifischer Antikörper<br />
(Tab. 4). Diese sind bei etwa 30 Prozent der Patienten mit Polymyositis<br />
und Dermatomyositis nachweisbar und kommen auch<br />
bei ANA-negativen Patienten vor. Sie zeichnen sich durch eine<br />
hohe Spezifität und eine Assoziation mit spezifischen klinischen<br />
51–2009<br />
11
12<br />
STATE OF THE ART<br />
Myositis-spezifische Autoantikörper. Diese sind<br />
bei zirka 30 Prozent der Patienten mit Polymyositis<br />
oder Dermatomyositis nachweisbar<br />
Acronym Antigen<br />
Anti-Jo-1 Histidyl–tRNA-Synthetase<br />
Anti-PL7 Threonyl-tRNA-Synthetase<br />
Anti-PL12 Alanyl-tRNA-Synthetase<br />
Anti-SRP Signal Recognition Particle<br />
Anti-Mi2 Nukleäre Helikase<br />
Anti-PM-Scl Multiproteinkomplex<br />
Anti-Ku DNA-bindender Komplex<br />
Tab. 4<br />
Verlaufsformen aus. Am häufigsten kommen Antikörper gegen<br />
Aminoacyl-tRNA-Synthetasen (Anti-Synthetase-Antikörper)<br />
vor. Sie verursachen oft ein spezifisches Krankheitsbild, das<br />
Anti-Synthetase-Syndrom, mit interstitieller Lungenerkrankung,<br />
Raynaud-Phänomen, Mechanikerhänden und Arthritiden.<br />
Der häufigste Antikörper aus dieser Kategorie ist der Anti-<br />
Jo-1-Antikörper. Seltenere Anti-Synthetase-Antikörper sind<br />
solche gegen PL-7 und PL-12. Ein weiterer Myositis-spezifischer<br />
Antikörper ist Anti-SRP. Er ist mit schweren therapierefraktären<br />
Verlaufsformen der Polymyositis assoziiert. Anti-Mi-2-<br />
Antikörper hingegen sind mit einer akut einsetzenden Dermatomyositis<br />
und eher gutem Therapieansprechen assoziiert 6 . Anti-<br />
PM-Scl und Anti-Ku sind Myositis-assoziierte Antikörper mit<br />
Bezug zu Overlap-Syndromen mit anderen Kollagenosen.<br />
MRI<br />
In der Magnetresonanztomographie lassen sich vor allem in<br />
den T2-gewichteten und STIR-Sequenzen ödematöse Veränderungen<br />
der Muskeln nachweisen. Diese weisen auf eine Entzündungsaktivität<br />
hin, sind hierfür aber nicht spezifisch. Wertvoll<br />
ist das MRI insbesondere bei geplanter histologischer<br />
Abklärung zur Auswahl einer geeigneten Biopsiestelle.<br />
Elektromyographie<br />
Entzündlich veränderte Muskeln zeigen in der Elektromyographie<br />
ein charakteristisches myopathisches Muster. Dieses ist<br />
jedoch nicht spezifisch für den Befall durch eine Myositis.<br />
Zudem kommen aufgrund des häufig fokalen Myositisbefalls<br />
falsch-negative Befunde vor. Durch die Traumatisierung mit<br />
der Untersuchungsnadel können bei einer folgenden Muskelbiopsie<br />
entzündliche Artefakte entstehen. Aufgrund des meist<br />
symmetrischen Befalls ist es daher sinnvoll, nur einseitig mittels<br />
EMG zu untersuchen und die Biopsie dann an der kontralateralen<br />
Seite durchzuführen.<br />
Histologie<br />
Goldstandard zur Diagnosesicherung bleibt die Muskelbiopsie.<br />
Sinnvoll ist eine Auswahl der geeigneten Lokalisation durch<br />
MRI und/oder EMG (siehe oben). Die histologische Diagnostik<br />
sollte durch ein spezialisiertes Labor mit Erfahrung in der<br />
Muskelpathologie erfolgen. Polymyositis und Dermatomyositis<br />
unterscheiden sich in ihrem typischen histologischen Bild. Bei<br />
der Dermatomyositis zeigen sich entzündliche Infiltrate (vor<br />
allem von CD4-positiven T-Zellen, Makrophagen und B-Zellen)<br />
vorwiegend im Bereich der perimysialen Gefässe. Die<br />
Muskelzellen zeigen vor allem eine perimysiale Atrophie. Zum<br />
Teil kommen auch Thrombosen kleiner Gefässe sowie Muskelinfarkte<br />
vor. Bei der Polymyositis zeigen die Entzündungszellen<br />
(vor allem CD8-positive T-Zellen und Makrophagen) ein<br />
endomysiales Verteilungsmuster.<br />
Einen histologischen und klinischen Sonderfall stellt die<br />
Einschlusskörpermyositis dar. Sie zeigt ein ähnliches histologisches<br />
Bild wie das der Polymyositis, zusätzlich zeigen sich in<br />
den Muskelzellen Vakuolen, die von eosinophilem Material<br />
eingerahmt werden. Es handelt sich hierbei um Amyloidablagerungen.<br />
Klinische Besonderheit der Einschlusskörpermyositis<br />
ist der Befall von distalen Muskelgruppen, ein Ansprechen<br />
auf immunsuppressive Therapie fehlt meist 7 .<br />
Therapie<br />
Aufgrund der niedrigen Inzidenz der Erkrankung sind randomisierte,<br />
kontrollierte Therapiestudien eine Rarität. Dies wird<br />
sich in Zukunft ändern, da derzeit mehrere große Studien, insbesondere<br />
mit den neuen Biologika, durchgeführt werden.<br />
Kortikosteroide sind unverändert die Grundlage der Polymyositis-<br />
und Dermatomyositis-Therapie. Ein festgelegtes<br />
Therapieschema existiert nicht. Man beginnt jedoch üblicherweise<br />
mit einer Dosierung von 0,75–1 mg/kgKG/d Prednison-<br />
Äquivalent (Tab. 5). Diese Dosis wird für mindestens vier<br />
Wochen beibehalten und dann je nach klinischem Ansprechen<br />
reduziert. Bei milderen Verlaufsformen kann auch eine niedrigere<br />
Anfangsdosis gewählt und eine schnellere Dosisreduktion<br />
versucht werden. Eine niedrig-dosierte Erhaltungstherapie ist<br />
üblicherweise für mehr als ein Jahr angezeigt. Aufgrund der<br />
Kortikosteroid-Nebenwirkungen ist immer die niedrigste Dosis<br />
anzustreben, unter der die Krankheit kontrolliert werden kann.<br />
Bei Prednison-Dosen > 20 mg/d sollte eine Pneumocystis-Prophylaxe<br />
rezeptiert werden. Eine DEXA ist empfehlenswert,<br />
eine Vitamin-D-Prophylaxe regelmäßig durchzuführen.<br />
Oft wird parallel zur Prednison-Therapie eine Kortikosteroidsparende<br />
Immunsuppression begonnen. Am häufigsten werden<br />
Methotrexat, Azathioprin und Cyclosporin verwendet. Fallserien<br />
existieren darüber hinaus für Tacrolimus, Mycophenolat-<br />
Mofetil und Chlorambucil, die in der Praxis jedoch selten eingesetzt<br />
werden. Bei einem Versagen der aufgeführten Therapieschemata<br />
muss zunächst die Diagnose überprüft und insbeson-
Richtlinien zur Therapie der Polymyositis<br />
und Dermatomyositis<br />
Kortikosteroide<br />
❙ Beginn mit ca. 0.75 –1mg/kg/KG für ca. 1 Monat<br />
❙ Reduktion je nach Klinik über die nächsten Monate<br />
❙ Erhaltungsdosen oft nötig > 1 Jahr<br />
Andere Immunsuppressiva<br />
❙ Häufig parallel zum Beginn der Steroide<br />
❙ MTX, Azathioprin, Cyclosporin, MMF<br />
Tab. 5<br />
dere Tumor-assoziierte Formen oder eine Einschlusskörpermyositis<br />
ausgeschlossen werden. Anschließend kann eine Kombination<br />
der oben erwähnten Immunsuppressiva versucht werden.<br />
Eine Alternative stellen intravenöse Immunglobuline dar,<br />
die recht regelhaft zu einer Besserung der Muskelenzyme führen,<br />
aber nicht immer mit einer Muskelkraftverbesserung einhergehen.<br />
Zudem sind Rezidive häufig, und die Kosten der<br />
Therapie sind vergleichsweise hoch 8 .<br />
Mehrere der aus der Arthritis-Therapie bekannten neuen Biologika<br />
werden derzeit bei der Polymyositis und Dermatomyositis<br />
getestet. Dies schließt die TNF-α-Inhibitoren sowie Rituximab<br />
ein. Die bisherigen Fallbeschreibungen für diese Substanzen<br />
sind vielversprechend, jedoch teilweise inkonsistent und<br />
lassen keine endgültige Schlussfolgerung zu. Hier sind mit<br />
Spannung die Ergebnisse der randomisierten kontrollierten<br />
Studien abzuwarten. Weitere Therapien, die derzeit untersucht<br />
werden, sind Interferon-β sowie ein anti-Komplement-Antikörper<br />
gegen C5.<br />
Literatur<br />
1 Dalakas MC, Hohlfeld R: Polymyositis and dermatomyositis.<br />
Lancet 362(9388):971-82, 2003.<br />
2 Briani C, Doria A, Sarzi-Puttini P, Dalakas MC. Update<br />
on idiopathic inflammatory myopathies. Autoimmunity<br />
39(3):61-70, 2006.<br />
3 Lundberg IE: The heart in dermatomyositis and<br />
polymyositis. <strong>Rheuma</strong>tology (Oxford) 45 Suppl 4:iv18-<br />
21, 2006.<br />
4 Fathi M, Lundberg IE, Tornling G: Pulmonary complications<br />
of polymyositis and dermatomyositis. Semin<br />
Respir Crit Care Med 28(4):451-8, 2007.<br />
5 Fardet L, Dupuy A, Gain M, Kettaneh A, Chérin P,<br />
Bachelez H, Dubertret L, Lebbe C, Morel P, Rybojad<br />
M: Factors associated with underlying malignancy in a<br />
retrospective cohort of 121 patients with dermatomyositis.<br />
Medicine (Baltimore) 88(2):91-7, 2009.<br />
6 Gunawardena H, Betteridge ZE, McHugh NJ: Myositisspecific<br />
autoantibodies: their clinical and pathogenic significance<br />
in disease expression. <strong>Rheuma</strong>tology (Oxford)<br />
48(6):607-12, 2009.<br />
7 Greenberg SA: Inflammatory myopathies: evaluation<br />
and management. Semin Neurol. 28(2):241-9, 2008.<br />
8 Hengstman GJ, van den Hoogen FH, van Engelen BG:<br />
Treatment of the inflammatory myopathies: update and<br />
practical recommendations. Expert Opin Pharmacother.<br />
10(7):1183-90, 2009.<br />
51–2009<br />
13
14<br />
STATE OF THE ART<br />
Prometheus-Studie<br />
Methotrexat + Steroide versus Steroid-Monotherapie<br />
bei Poly- / Dermatomyositis<br />
Aktuell nehmen wir an einer internationalen Studie teil, bei<br />
der die Kombination von Methotrexat + Steroiden mit einer<br />
Steroid-Monotherapie bei PatientInnen mit neu diagnostizierter<br />
Poly-/Dermatomyositis verglichen wird. Bei dieser<br />
seltenen Erkrankung sind wir auf Ihre Mitarbeit sehr angewiesen<br />
und bitten Sie deshalb, uns PatientInnen zuzuweisen,<br />
die folgende Kriterien erfüllen:<br />
❙ Neu entdeckte oder sehr wahrscheinliche<br />
Poly-/Dermatomyositis +<br />
❙ bisher keine Behandlung oder seit maximal zwei Monaten<br />
Steroid-Monotherapie<br />
Fragen?<br />
Für Fragen im Zusammenhang mit der Studie oder Patienten-<br />
Anmeldungen stehen wir Ihnen gerne zur Verfügung:<br />
Telefon: 044 255 42 12 diana.frey@usz.ch oder<br />
Telefon: 044 255 30 34 sandra.blumhardt@usz.ch<br />
Klinische Studien, Information<br />
Abteilung Clinical Trials<br />
<strong>Rheuma</strong>klinik und Institut für<br />
Physikalische Medizin UniversitätsSpital Zürich<br />
Gloriastrasse 25, 8091 Zürich<br />
PD Dr. med. Daniel Uebelhart<br />
Dr. med. Diana Frey<br />
Co-Leitung Clinical Trials<br />
Dr. med. Sandra Blumhardt (Oberärztin)<br />
Annemarie Koch (Studienkoordinatorin)<br />
Principle Investigator für PROMETHEUS:<br />
PD Dr. med. Oliver Distler
und<br />
Das erfolgreiche Original<br />
zum Generikumpreis<br />
Wirksamkeit2) und<br />
Verträglichkeit1,2) als<br />
Anspruch – nicht<br />
als Widerspruch<br />
Was wollen Sie mehr?<br />
DROSSA PHARM AG<br />
4002 Basel/Arlesheim<br />
www.drossapharm.ch<br />
Ein unabhängiges <strong>Schweiz</strong>er Pharmaunternehmen<br />
Gekürzte Fachinformation: Zusammensetzung: 1 Kapsel Tilur ® enthält 60mg Acemetacin, 1 Kapsel Tilur ® retard enthält 90mg Acemetacin. Dosierung/Anwendung: Übliche Dosierung bei Tilur: 1-3 mal täglich 1 Kapsel Tilur ® , 1-2 mal<br />
täglich 1 Kapsel Tilur ® retard. Anwendungseinschränkungen/Kontraindikationen: Da Acemetacin eine geringe Neigung zur Auslösung von Ulzerationen des Magen-Darm-Traktes besitzt, sollten Patienten mit vorbestehendem akuten<br />
Magen- oder Zwölffingerdarmgeschwür nicht mit Acemetacin behandelt werden. Acemetacin ist kontraindiziert bei Patienten mit Allergie gegen Acemetacin oder gegen einen der Formulierungsbestandteile von Tilur ® .<br />
Vorsichtsmassnahmen: Kopfschmerzen und Schwindel können das Lenken und das Bedienen von Apparaten beeinträchtigen. Vorsicht ist geboten bei der Behandlung von Patienten mit psychischen Störungen und bei Patienten unter<br />
Antikoagulantienbehandlung. Unerwünschte Wirkungen: Gastrointestinale Nebenwirkungen, Kopfschmerzen, Schwindel, Leberfunktionsstörungen. Schwangerschaft/Stillzeit: Kat C/D, von einer Anwendung in der Schwangerschaft<br />
und Stillzeit ist abzusehen. Interaktionen: Mögliche Verstärkung der Wirkung von Methotrexat und Litium. Tilur ® kann die Serum-Kaliumspiegel erhöhen. Packungen: Tilur ® Kapseln 20* und 50*, *kassenzulässig, Tilur ® retard Kapseln<br />
20* und 50*, *kassenzulässig. Verkaufskategorie B. Weitere Informationen siehe Arzneimittelkompendium der <strong>Schweiz</strong>. Weitere Informationen Dr. C. Lütolf, Marketing Manager Drossapharm AG, Birsweg 1, 4144 Arlesheim.<br />
1) Sedman E (1994): Recent Research on Acemetacin in the UK. Topics in Arthritis and <strong>Rheuma</strong>tism, Raven Press New York / Arzneimittelkompendium 2005. 2) Pelster B. 1993. Retardierte NSAR bei aktivierter Arthrose. Z. Allg. Med.<br />
69, 1033-1038.<br />
51–2009<br />
15
16<br />
SPEZIAL<br />
DANIEL UEBELHART<br />
Physikalische Medizin und muskulo-skelettale<br />
Rehabilitation – Neuigkeiten im Jahr 2009<br />
Dieser Artikel soll die wichtigsten Neuigkeiten des Jahres 2009 in der Physikalischen Medizin und Rehabilitation (PMR)<br />
und insbesondere in der muskulo-skelettalen Rehabilitation aufzeigen.<br />
Osteoporose<br />
Im Jahr 2009 war die wichtigste Neuigkeit zweifelsohne die<br />
Verfügbarkeit des FRAX für die <strong>Schweiz</strong>er Ärzte. Dieses<br />
Werkzeug ermöglicht die Beurteilung des Frakturrisikos von<br />
Patienten über eine Zeitspanne von zehn Jahren anhand der<br />
wichtigsten klinischen Risikofaktoren mit oder ohne Einbeziehen<br />
der Knochendichte des Schenkelhalses. Im Auftrag des<br />
WHO hat John A. Kanis anhand zahlreicher internationaler<br />
Kohortenstudien 1 dieses Prognosewerkzeug über mehrere<br />
Jahre entwickelt. Eine wichtige Hilfe für unser Land stellt die<br />
kürzliche Publikation von K. Lippuner et al. 2 über die <strong>Schweiz</strong>er<br />
Anwendung des FRAX dar, die dank des Zusammentragens<br />
von epidemiologischen Daten aus der <strong>Schweiz</strong> es<br />
ermöglicht, ab sofort dieses Instrument in der <strong>Schweiz</strong>er<br />
Bevölkerung anzuwenden. Das Instrument steht vorbehaltlos<br />
auf folgenden Internet-Seiten zur Verfügung: SVGO/ASCO<br />
http://www.svgo.ch/ und IOF http://www.iofbonehealth.org/<br />
mit direktem Link zur Original-Website an der Universität<br />
Sheffield/UK 3 . Beim FRAX kann die Sprache ausgewählt<br />
werden, was die Benützung in Anwesenheit des Patienten<br />
erleichtert.<br />
Allerdings sind zurzeit noch einige Einschränkungen und Mängel<br />
zu verzeichnen. Zum Beispiel werden gewisse Frakturrisiken<br />
wie die Sturzanfälligkeit oder ein vermehrter Knochenaufbau,<br />
Werte aus einer quantitativen Ultrasonographie usw.<br />
nicht integriert. Das Instrument basiert auf dem errechneten<br />
Frakturrisiko aufgrund von epidemiologischen Daten des<br />
Schenkelhalses und ist deshalb nicht direkt anwendbar zur<br />
Risikoevaluation einer Wirbelfraktur. Deshalb kann man zurzeit<br />
nur ein globales, absolutes Frakturrisiko und ein Frakturrisiko<br />
im Bereich des Schenkelhalses auf zehn Jahre in Prozenten<br />
ermitteln. Das FRAX-Instrument wurde so konzipiert,<br />
dass es entwicklungsfähig ist und an neue zur Verfügung stehende<br />
Daten angepasst werden kann. Deshalb kann man ohne<br />
weiteres erwarten, dass die aktuellen beschränkten Faktoren es<br />
in Zukunft nicht mehr sein werden. Das Hauptproblem bleibt<br />
die Schwelle der therapeutischen Intervention, die verschieden<br />
eingeschätzt wird. Diese Bestimmung sollte in der <strong>Schweiz</strong> so<br />
schnell als möglich definiert werden, indem alle betroffenen<br />
medizinischen Spezialitäten integriert werden. Auf jeden Fall<br />
stellt dieses zur Verfügung stehende Instrument zur Beurteilung<br />
des Frakturrisikos einen unvergleichbaren Fortschritt<br />
gegenüber früher dar als nur die Knochendichte für den Arzt<br />
brauchbar war.<br />
Muskulo-skelettale Beschwerden<br />
Eine interessante Publikation widmet sich der Auswirkung von<br />
Bewegung bei Gonarthrose-Patienten. Insgesamt 32 Studien<br />
lieferten Daten von 3616 Patienten mit Schmerzen im Kniegelenk<br />
und 3719 Patienten, deren physikalische Funktion<br />
gemessen wurde. Die eingeschlossenen Studien wiesen grosse<br />
Unterschiede auf, die Autoren kommen aber zum Schluss, dass<br />
kurz- und mittelfristige physikalische Übungen zweifelsohne<br />
eine günstige Wirkung im Sinne von Schmerzminderung und<br />
-besserung der Gelenkfunktion bei Gonarthrose-Patienten<br />
haben. Die Wirkung dieser therapeutischen Intervention ist<br />
zwar schwach aber vergleichbar mit jener von nicht-steroidalen<br />
Entzündungshemmern 4 .
Ein weiterer interessanter Beitrag ist das Trainieren des<br />
Gleichgewichts und der Propriozeption bei Patienten mit<br />
rheumatoider Arthritis. Diese Studie steht zurzeit zur Verfügung<br />
als Studienprotokoll, wobei die Resultate noch ausstehend<br />
sind. Die berücksichtigten primären Parameter zur Beurteilung<br />
der Wirksamkeit eines Propriozeptionstrainings sind<br />
die folgenden: das HAQ, Lauftest von sechs Minuten, der<br />
Timed up and go-Test (TUG) oder Tinetti-POMA-Test, die<br />
VAS-Skala zur Ermittlung des Schmerzes. Die Resultate dieser<br />
grossangelegten Studie werden mit Ungeduld erwartet 5 .<br />
Dies ist nur eine beschränkte Auswahl von Evidenz-basierten<br />
Schriften, die kostenlos auf folgender Website zur Verfügung<br />
stehen: http://www.thecochranelibrary.com Die angewendete<br />
Vorgehensweise veranschaulicht die von der Physikalischen<br />
Medizin und Rehabilitation gefolgte neue Linie, die sich fortschreitend<br />
der Beweis- und Evidenz-basierten Medizin öffnet.<br />
Literatur<br />
1 Kanis JA, on behalf of the World Health Organization<br />
Scientific Group. Assessment of osteoporosis at the<br />
primary health care level: WHO Collaborating Centre<br />
for Metabolic Bone Diseases, University of Sheffield<br />
(UK) and World Health Organization, 2007.<br />
2 Lippuner K, Johansson H, Kanis JA, Rizzoli R.<br />
Remaining lifetime and absolute 10-year probabilities<br />
of osteoporotic fracture in Swiss men and women.<br />
Osteoporos Int 20(7):1131-1140, 2009.<br />
3 Rizzoli R, Ammann P, Birkhäuser M, Ferrari S,<br />
Häuselmann HJ, Kraenzlin ME, Krieg MA, Meier C,<br />
Theiler R, Uebelhart D, Wimpfheimer C. Ostéoporose:<br />
du diagnostic ostéodensitométrique à l’évaluation du<br />
risque absolu de fracture. Forum Med Suisse 9(36):<br />
633-635, 2009.<br />
4 Fransen M, McConnell S. Exercise for osteoarthritis<br />
of the knee. Cochrane Database of Systematic Reviews<br />
2008, Issue 4. Art. No.:<br />
CD004376.DOI:10.1002/14651858.CD004376.pub2.<br />
5 Silva KNG, Mizusaki Imoto A, Almeida GJM, Atallah<br />
AN, Peccin MS, Fernades Moça Trevisani V. Balance<br />
training (proprioceptive training) for patients with<br />
rheumatoid arthritis. Cochrane Database of Systematic<br />
Reviews 2009, Issue 1. Art. No.:<br />
CD007648.DOI:10.1002/14651858.CD007648.<br />
51–2009<br />
17
18<br />
SPEZIAL<br />
C A V E N S A R<br />
Umdenken. Risiken senken.<br />
von Anfang an<br />
Paracetamol 325 mg + Tramadol 37.5 mg I: symptomatische Behandlung mässiger bis starker Schmerzen bzw. ungenügender Wirksamkeit nicht-opioider Analgetika. D: Erw.: 1–2 Tabletten als Einzeldosis (max. 8 Tabl./d).<br />
KI: Überempfindlichkeit auf Tramadol/Paracetamol. Akute Vergiftungen mit Alkohol oder Psychopharmaka; schwere Leber- und Nierenfunktionsstörungen. Die Einnahme von Zaldiar®‚ ist bei gleichzeitiger Einnahme von<br />
MAO-Hemmern untersagt. VM: Vorsicht ist geboten bei Nieren-/ Leberinsuffizienz. Bei gleichzeitiger Anwendung von Substanzen, die ebenfalls auf das Zentralnervensystem wirken, ist mit einer gegenseitigen Verstärkung<br />
zu rechnen. UW: Schwindel, Übelkeit, Müdigkeit, Erbrechen, Ängstlichkeit, Verwirrung. WH: Unter Umständen kann das Reaktionsvermögen und somit die aktive Teilnahme am Strassenverkehr und das Bedienen<br />
von Maschinen beeinträchtigt werden. Patienten mit Epilepsie oder Krampfanfälligkeit dürfen nur bei zwingender Indikation mit Zaldiar® behandelt werden. P: 10, 20 und 60 Tabletten, kassenzulässig.<br />
Liste A. Ausführliche Angaben siehe Arzneimittel-Kompendium der <strong>Schweiz</strong>. Grünenthal Pharma AG, 8756 Mitlödi, Tel. 055 647 31 31 www.zaldiar.com
ACR 2009<br />
STEFFEN GAY<br />
Das ACR-Meeting in Philadelphia, PA, war wieder ein voller Erfolg für die Experimentelle <strong><strong>Rheuma</strong>tologie</strong> an der <strong>Rheuma</strong>klinik.<br />
Joanna Stanczyk Feldges beeindruckte in einer Plenary Session mit ihrem Vortrag zur Rolle der microRNA bei <strong>Rheuma</strong>toider Arthritis<br />
(RA) genauso wie Astrid Jüngel mit ihrer Präsentation zur Identifikation von über zehn neuen Autoantigenen, die sie bei der RA<br />
identifizieren konnten. Britta Maurer konnte durch ihre neuen Ergebnisse zur Aufklärung der Pathogenese der Systemischen Sklerose<br />
(Sklerodermie) ebenfalls mit der Rolle von Fra-2 beeindrucken. Steffen Gay hielt eine State of the Art-Lecture zur Bedeutung der<br />
synovialen Fibroblasten in der Pathogenese der RA.<br />
01<br />
Tyrosine kinase inhibitors (TKI) are promising therapeutic agents for<br />
the proliferative vasculopathy in SSc<br />
Britta Maurer, Nicole Busch, Astrid Jüngel, Renate E. Gay, Georg Schett, Beat A.<br />
Michel, Steffen Gay, Jörg HW Distler and Oliver Distler<br />
Purpose: Proliferative vasculopathy such as pulmonary arterial hypertension<br />
(PAH) and fibrosis are the leading causes of death in SSc patients. Herein, we<br />
analyzed the effects of TKI on the proliferative vasculopathy in the novel vascular<br />
SSc model of Fra-2 tg mice, and examined the activation of TKI targets in<br />
the skin of SSc patients and fibrotic animal models of SSc.<br />
Method: Fra-2 tg mice (n=12; Bl6), wt littermates (n=3) and bleomycin treated<br />
mice (n=3; C3H/HeJ) were analyzed. Subgroups of Fra-2 tg mice (n=6) were<br />
treated with the TKI nilotinib at 2 x 35mg/d p. o. from 8 weeks of age. In addition,<br />
skin sections from SSc patients (n=5) were examined.<br />
Results: Untreated Fra-2 tg mice developed a strong proliferative vasculopathy<br />
in the lungs resembling PAH. Vascular remodelling of small arteries was characterized<br />
by proliferation (PCNA staining) of vascular smooth muscle cells<br />
(SM22α, double staining) and myofibroblasts/pericytes (α-SMA and Thy). The<br />
expression of the phosphorylated and thus activated TKI targets p(phospho)-cabl<br />
and p-PDGFRβ was significantly increased in the pulmonary vessels of<br />
untreated Fra-2 tg mice. Accordingly, nilotinib improved the proliferative vasculopathy<br />
in the lungs of treated (vessel wall diameter, mean ± SEM 30.6 ± 1.3<br />
µm) compared to the untreated Fra-2 tg mice (43.3 ± 1.4 µm, p
20<br />
KONGRESS<br />
strong effect on the expression of EZH2 by reducing the TNF-α-mediated upregulation<br />
by 105±14% (IKK2) and 47±17% (JNK) in RASF and 86±17% and<br />
81±4% in OASF (p
Conclusion: Our results show that VEGF aggravates fibrosis in vitro and in<br />
vivo. Potential mechanisms include direct profibrotic effects via PDGF receptors<br />
and indirect profibrotic effects by the induction of inflammation via VEG-<br />
FR1 signalling on monocytes. Thus, our data suggest VEGF as a novel link<br />
between vascular injury, inflammation and onset of fibrosis in SSc.<br />
07<br />
Specific histone deacetylases (HDACs) modulate fibrosis and angiogenesis<br />
in systemic sclerosis (SSc)<br />
Hossein Hemmatazad, Britta Maurer, Hanna Maciejewska Rodrigues, Renate E.<br />
Gay, Beat A. Michel, Steffen Gay, Oliver Distler and Astrid Jüngel<br />
Purpose: Recently, we have shown that Trichostatin A (TSA) does not only<br />
inhibit the activity of HDACs but also modulates significantly the transcriptional<br />
expression of two isoforms of HDACs, HDAC3 and 7. While the expression<br />
of HDAC7 is almost completely down-regulated by TSA, HDAC3 expression is<br />
up-regulated. Furthermore, we demonstrated that silencing of HDAC7 has antifibrotic<br />
effects in skin fibroblasts from patients with SSc. However, there are<br />
reports indicating that silencing of HDAC7 affects angiogenesis in human<br />
umbilical vein endothelial cells (HUVECs). Since microvascular damage is<br />
characteristic for SSc, we investigate here the role of HDAC3 in fibrosis and in<br />
angiogenesis in human uterine microvascular endothelial cells (HUMECs).<br />
Method: Over-expression of HDAC3 in SSc skin fibroblasts and HUMECs was<br />
achieved by transfecting a HDAC3-expression vector/plasmid into cells using<br />
Amaxa nucleotransfection. An empty vector was used as control. Gene expression<br />
patterns of collagen types I and III, connective tissue growth factor (CTGF)<br />
and intercellular adhesion molecule-1 (ICAM-1) were analyzed by Sybr Green<br />
Real-time PCR. To assess the expression on the protein level, antibodies against<br />
collagen types I and III, CTGF and ICAM-1 were used for Western blot.<br />
Endothelial capillary sprouting was assessed using tube formation assay.<br />
Results: After over-expression of HDAC3 in skin fibroblasts from patients with<br />
SSc, the transcription of collagen types I and III was reduced by 38 ± 16 % and<br />
25 ± 20 % (n=6 each, p
22<br />
KONGRESS<br />
The promoter of socs-3 was heavily hypermethylated in SSc fibroblasts. Incubation<br />
with 5-aza reactivated the expression of socs-3 in SSc fibroblasts, but had no<br />
effects in control fibroblasts. The hypermethylation of socs-3 in SSc might be<br />
mediated by TGFβ. TGFβ induced hypermethylation of the promoter of socs-3<br />
in healthy fibroblasts similar to SSc fibroblasts and reduced the expression of<br />
socs-3 by 69 ± 8 % (p < 0.05). The increased DNA methylation was mediated by<br />
TGFβ dependent induction of the DNA methyltransferase 3a. Coincubation<br />
with 5-aza prevented not only the inhibitory effects of TGFβ on the expression<br />
of socs-3, but also reduced the TGFβ induced stimulation of the collagen synthesis<br />
by 68 ± 6 % (p < 0.05). 5-aza also exerted anti-fibrotic effects in vivo. 5aza<br />
reduced dermal thickening upon challenge with bleomycin by 89 ± 9 % (p<br />
< 0.05). In addition, 5-aza induced regression of pre-established fibrosis with a<br />
decrease in dermal thickening of 44 ± 3 % below pre-treatment levels (p < 0.05).<br />
Conclusion: We demonstrate that TGFβ induces silencing of the anti-fibrotic<br />
gene socs-3 via DNA methyltransferase 3a dependent promoter hypermethylation.<br />
Inhibition of the TGFβ induced silencing of socs-3 by 5-aza reduced the<br />
stimulatory effects of TGFβ on the collagen synthesis in vitro and exerted<br />
potent anti-fibrotic effects in vivo. Thus, we identify inhibitors of DNA methyltransferases<br />
as novel anti-fibrotic drugs and provide a novel mechanism for the<br />
pro-fibrotic effects of TGFβ.<br />
11<br />
Systemic sclerosis organ involvement is associated with increased<br />
adipokine expression<br />
Elena Neumann, Klaus Frommer, Massimiliano Vasile, Tim Schmeiser, Oliver<br />
Distler, Steffen Gay, Valeria Riccieri, Andreas Günther, Elke Roeb and Ulf<br />
Müller-Ladner<br />
Purpose: Systemic sclerosis (SSc) is a connective tissue disorder characterized<br />
by progressive fibrosis of the skin and remodeling of the microvasculature.<br />
Increased extracellular matrix deposition also affects most internal organs<br />
including the gastrointestinal (GI) tract and lungs. Lung fibrosis represents the<br />
most common cause of death in SSc. We recently showed that severe fibrosis,<br />
increased expression of profibrotic cytokines and numbers of inflammatory<br />
cells are important hallmarks in the gastric wall (GW) of SSc patients.<br />
Adipokines such as adiponectin, visfatin/PBEF or resistin are immunomodulatory<br />
cytokine-like mediators. The present study analyzed whether adipokines<br />
are present in SSc-associated inflammation.<br />
Method: Gastric biopsy samples obtained during esophagogastroscopy (corpus,<br />
esophagus, antrum) of 5 SSc patients and 2 healthy controls; lung tissues from<br />
patients with IPF, EAA/NSIP, controls as well as skin biopsy samples (2 SSc; 2 controls)<br />
were obtained. In bronchoalveolar lavages (BAL) of healthy controls (9),<br />
patients with SSc (22), IPF (6), and EAA/NSIP (4) adiopokines were measured<br />
(ELISA). Adiponectin, visfatin and resistin immunohistochemistry and double stainings<br />
with CD45 (LCA), CD3 (T cells), CD20 (mature B cells), CD68 (macrophages),<br />
vimentin (fibroblasts), CD31 (endothelial cells) were performed. Affymetrix analysis<br />
was performed using skin fibroblasts stimulated with adiponectin.<br />
Results: Expression of adipokines in fibrotic skin, fibrotic lung tissue and the<br />
GI-tract of SSc was increased as compared to controls. In the GW, adipokines<br />
were localized at sites of inflammation in the mucosal layer without fibrosis in<br />
this area. Strongest expression showed adiponectin and visfatin. Adipokines<br />
were expressed by fibroblasts, inflammatory cells (CD45) and perivascular. In<br />
fibrotic lung tissue increased amounts of adipokines were detectable.<br />
Adipokine levels were increased in the BAL of fibrotic lungs when compared<br />
to controls (2.5fold) and to idopathic pulmonary fibrosis (1.7fold). Affymetrix<br />
array results showed a reduced expression of matrix components and an upregulation<br />
of matrix-degrading enzymes (MMPs).<br />
Conclusion: The data show that in SSc patients adipokines are increased at sites<br />
of fibrosis in skin and lung. In contrast, adipokines are expressed in the GW at<br />
site of inflammation without fibrosis. Further analysis of the role of adipokines<br />
in fibrosis and inflammation may help to understand the pathophysiological<br />
mechanisms in SSc. Especially the role of adipokines with anti-fibrotic potential<br />
are of distinct interest for future investigations.<br />
12<br />
Adiponectin affects gene expression of rheumatoid arthritis effector<br />
cells including synovial fibroblasts, lymphocytes, endothelial cells and<br />
chondrocytes<br />
Klaus W. Frommer, Birgit Zimmermann, Dirk Schröder, Andreas Schäffler,<br />
Christa Büchler, Fabia Brentano, Steffen Gay, Ulf Müller-Ladner and Elena Neumann<br />
Purpose: <strong>Rheuma</strong>toid arthritis (RA) is associated with increased production of<br />
adipokines. Elevated levels of these cytokine-like mediators are found both in<br />
synovial tissue and synovial fluid of RA patients. RA effector cells may be<br />
affected by these adipokines. We therefore investigated the effect of the<br />
adipokine adiponectin on human synovial fibroblasts (SF), lymphocytes,<br />
endothelial cells and chondrocytes. We focused on the expression of proinflammatory<br />
and matrix-degrading mediators induced by adiponectin. We also<br />
analyzed the signaling pathways of adiponectin in RASF.<br />
Method: Human RASF, lymphocytes, endothelial cells and chondrocytes were<br />
stimulated in vitro with adiponectin. Affymetrix microarrays and protein arrays<br />
were used to screen for changes in gene expression. Real-time PCR and<br />
immunoassays were used to quantify mRNA and protein levels, respectively.<br />
Signaling analysis was performed using intracellular chemical inhibitors.<br />
Results: Adiponectin stimulation of RASF induced the expression and secretion<br />
of chemokines (protein: e.g. ENA-78, 22.5-fold), proinflammatory<br />
cytokines (mRNA: e.g. IL-11, 24.3-fold), other inflammatory molecules<br />
(mRNA: e.g. PGE synthase, 3.4-fold), growth factors (mRNA: e.g. fibroblast<br />
growth factor 10, 5.0 fold), genes involved in bone metabolism (mRNA: e.g.<br />
stanniocalcin-1, 19.8-fold) and matrix remodeling proteins (mRNA: e.g. MMP3<br />
62.5 fold; protein: e.g. pro-MMP1 15.4-fold). Increased chemokine and cytokine<br />
secretion (e.g. IL-8, IL-6) was a common response to adiponectin stimulation<br />
found in all cell types studied, while chondrocytes additionally secreted<br />
increased levels of MMPs. Adiponectin-induced secretion of IL-6, MCP-1 and<br />
MMP10 by RASF was decreased using inhibitors against p38 MAPK and PKC<br />
but not by inhibitors against PKA and NFkB.<br />
Conclusion: Adiponectin promotes the progression of RA primarily by inducing<br />
the secretion of proinflammatory molecules, chemokines and matrixdegrading<br />
enzymes in cell types involved in RA pathophysiology. While proinflammatory<br />
molecules such as IL-6 and PGES promote inflammation directly,<br />
chemokines attract and activate inflammatory cells further increasing inflammation.<br />
Additionally, elevated levels of MMPs lead to degradation of extracellular<br />
matrix and cartilage. According to our results, adiponectin-induced signaling<br />
in RASF is not only mediated by p38 MAPK but also by PKC, whereas<br />
PKA and NFkB appear not to be involved. Our data further elucidate the complex<br />
molecular mechanisms of RA.<br />
13<br />
RNAi-mediated gene therapy of PBEF reduces the severity of collagen-induced<br />
arthritis in mice<br />
Gabriel Courties, Diego Kyburz, Virginie Escriou, Daniel Scherman, Christian<br />
Jorgensen, Steffen Gay and Florence Apparailly<br />
Purpose: PBEF (Pre-B cell colony-enhancing factor/visfatin) is a hormone<br />
released by adipose tissue described as a new marker of inflammation in<br />
rheumatoid arthritis (RA) with pro-inflammatory and matrix-degrading activities.<br />
We previously showed that in vitro PBEF lead to the expression of proinflammatory<br />
mediators (IL-6, TNF) and matrix degrading enzymes (MMPs)<br />
in synovial fibroblasts and/or monocytes. The purpose of this study was to<br />
examine the therapeutic effects of systemic delivery of anti-PBEF siRNA<br />
lipoplexes in mouse arthritis pre-clinical model.<br />
Method: Collagen-induced arthritis (CIA) was induced in male DBA/1 mice,<br />
and 0,5 mg/Kg small interfering (si)RNA against mouse PBEF (siPBEF) or<br />
non targeting siRNA (siCT) sequences formulated with the cationic liposome<br />
RPR209120/DOPE were injected intravenously weekly during arthritis progression.<br />
Clinical and biological features of the disease were investigated.<br />
Results: Systemic siPBEF delivery significantly decreased clinical disease activity<br />
scores of CIA as evidenced by paw swelling measures. Importantly, RNAimediated<br />
PBEF silencing significantly decreased IL-6 secretion in both sera<br />
and spleen, without altering serum anti-collagen (bCII) antibodies levels and<br />
bCII-specific T cell proliferation. Importantly, frequencies of the IFN-γ- and<br />
IL-17A-producing CD4+ cells were decreased within spleen and liver, while<br />
frequency of the IL-10-producing CD4+/CD25+/Foxp3 cells was increased.<br />
Histological scores of inflammation and cartilage damage, bone erosion, and<br />
mRNA levels of pro-inflammatory cytokines and MMPs in the joints will be<br />
investigated, as well as immunohistochemical staining of PBEF in the joints.<br />
Conclusion: These results provide novel evidence that systemic PBEF inhibition<br />
efficiently reduces experimental arthritis and might be proposed as novel<br />
therapeutic target for RA.
ACTEMRA BEWEGT.<br />
Direkt, konsequent, überlegen.<br />
Nach DMARD-Versagen. 1-4<br />
1,2<br />
DIREKT: Schnell mehr Lebensqualität, normalisiertes CRP.<br />
1– 4<br />
KONSEQUENT: Remission für rund jeden 3. Patienten nach 24 Wochen.<br />
ÜBERLEGEN: Reduziert in Monotherapie RA-Symptome stärker als Methotrexat. 4<br />
Actemra ® (Tocilizumab): Monoklonaler humanisierter Antikörper gegen den IL-6-Rezeptor. Indikation: Behandlung der mittelschweren bis schweren aktiven rheumatoiden Arthritis bei erwachsenen Patienten, die<br />
auf eine Behandlung mit DMARDs oder TNF-Hemmer nicht ausreichend angesprochen haben. Gabe als Monotherapie oder in Kombination mit Methotrexat und/oder anderen herkömmlichen DMARDs. Dosierung:<br />
8mg/kg alle 4 Wochen über 1 Stunde i.v. Kontraindikationen:<br />
und bis zu 1 Monat nach Behandlung mit Anti-TNF-Antikörpern. Warnhinweise und Vorsichtsmassnahmen: Bei aktiven Infektionen ist die Anwendung von Actemra nicht zu empfehlen; bei Neigung zu Infektionen<br />
<br />
Unerwünschte Wirkungen:<br />
Packungen: <br />
entnehmen Sie bitte dem Arzneimittel-Kompendium der <strong>Schweiz</strong> ® .<br />
Referenzen: 1<br />
2<br />
3<br />
<br />
4<br />
<br />
51–2009<br />
Roche Pharma (<strong>Schweiz</strong>) AG<br />
4153 Reinach 05/2009<br />
23
24<br />
SPEZIAL<br />
Golimumab<br />
Ein neuer TNF-alpha-Hemmer mit einmal monatlicher subkutaner<br />
Verabreichung bei Patienten mit <strong>Rheuma</strong>toider Arthritis (RA)<br />
Golimumab<br />
Golimumab ist ein neuer, rein humaner monoklonaler anti-<br />
TNF-alpha-Antikörper, der einmal monatlich in einer Dosis<br />
von 50mg subkutan verabreicht wird. In den USA ist Golimumab<br />
(Simponi ® ) seit April 2009 in Kombination mit<br />
Methotrexat oder als Monotherapie zur Behandlung von<br />
mittelmässig bis stark aktiver RA bei Erwachsenen und von<br />
Psoriasisarthritis sowie zur Behandlung der Spondylitis<br />
ankylosans zugelassen.<br />
Golimumab in der <strong>Schweiz</strong><br />
In der <strong>Schweiz</strong> ist Golimumab noch nicht auf dem Markt.<br />
Studie mit Golimumab<br />
Aktuell nehmen wir an einer multizentrischen internationalen<br />
Studie mit Golimumab teil. Im ersten Teil der Studie<br />
geht es darum, die Wirksamkeit und Sicherheit von einmal<br />
monatlich subkutan verabreichtem Golimumab 50mg bei<br />
RA-Patienten zu beurteilen, die noch nie mit einem Biologikum<br />
behandelt wurden, jedoch ein ungenügendes<br />
Ansprechen auf konventionelle DMARDs aufweisen. Alle<br />
Patienten bekommen die aktive Therapie, es gibt also keine<br />
Placebo-Gruppe.<br />
Im zweiten Teil der Studie werden diejenigen Patienten, die<br />
zwar auf die Therapie angesprochen haben, aber nicht in<br />
Remission sind, im Verhältnis 1:1 in Gruppen randomisiert:<br />
Die eine Gruppe erhält Golimumab nun intravenös, die<br />
zweite Gruppe wird weiterhin subkutan behandelt. Patienten<br />
in Remission behalten ihre subkutane Therapie bei.<br />
Die Studie dauert pro Patient insgesamt ein Jahr.<br />
Patientenzuweisungen für die Studie<br />
Bitte weisen Sie uns Patienten für diese Studie zu<br />
❙ mit aktiver <strong>Rheuma</strong>toider Arthritis +<br />
❙ mit ungenügendem Ansprechen auf konventionelle<br />
DMARDs +<br />
bei denen der Einsatz eines TNF-alpha-Hemmers geplant ist<br />
Fragen?<br />
Für Fragen im Zusammenhang mit der Studie oder Patienten-<br />
Anmeldungen stehen wir Ihnen gerne zur Verfügung.<br />
Telefon: 044 255 42 12 diana.frey@usz.ch oder<br />
Telefon: 044 255 30 34 sandra.blumhardt@usz.ch<br />
Telefax: 044 255 45 65<br />
Klinische Studien, Information<br />
Abteilung Clinical Trials<br />
<strong>Rheuma</strong>klinik und Institut für<br />
Physikalische Medizin UniversitätsSpital Zürich<br />
Gloriastrasse 25, 8091 Zürich<br />
PD Dr. med. Daniel Uebelhart<br />
Dr. med. Diana Frey<br />
Co-Leitung Clinical Trials<br />
Dr. med. Sandra Blumhardt (Oberärztin)<br />
Annemarie Koch (Studienkoordinatorin)<br />
Principle Investigator für GOLIMUMAB:<br />
PD Dr. med. Diego Kyburz
Herzliche Gratulation<br />
Muriel Keller, langjährige Mitarbeiterin<br />
Neurochirurgie Nord1 und Nord2, hat den<br />
Master of Advanced Studies in Applied<br />
Ethics erfolgreich abgeschlossen. Wir gratulieren<br />
ihr zu ihrem erfolgreichen Abschluss<br />
ihrer Weiterbildung und wünschen<br />
ihr weiterhin viel Erfolg!<br />
Dr. med. Patric Gross, Oberarzt, hat die<br />
Ausbildung zum Master of Advanced<br />
Studies in Managed Health Care an der<br />
ZHAW (Zürcher Hochschule für Angewandte<br />
Wissenschaften) erfolgreich abgeschlossen.<br />
Der Titel der Masterarbeit lautet: Osteoporose Disease<br />
Management Programm – eine Machbarkeitsstudie für die<br />
Region Winterthur.<br />
Wir gratulieren herzlich.<br />
Promotion<br />
Wir gratulieren Dr. Jaap Swanenburg, PT, MSc, ganz herzlich<br />
zum PhD-Titel, offiziell verliehen nach der Verteidigung<br />
seiner Thesis «Maintaining balance in elderly fallers», am<br />
Montag, 12.10.2009, vom Rektor der Universität Groningen<br />
(NL).<br />
Übergabe des Diploms.<br />
Für ihre Verdienste mit Bereich der<br />
Vitamin D-Forschung erhält Frau Heike<br />
Bischoff den diesjährigen mit 25 000 Euro<br />
dotierten DSM Nutrition Award. Die internationale<br />
Fachjury begründet ihren<br />
Entscheid damit, dass die am UniversitätsSpital Zürich<br />
tätige Professorin im Rahmen ihrer Forschungstätigkeit<br />
einen wichtigen Beitrag zur Förderung der Volksgesundheit<br />
geleistet hat. Der Preis wird von Royal DMS, einer international<br />
tätigen im Bereich Life Science spezialisierten<br />
Unternehmung verliehen. Frau Bischoff erhielt den Preis am<br />
6. Oktober 2009, anlässlich des in Bangkok stattfindenden<br />
International Congress of Nutrition.<br />
Wir gratulieren herzlich.<br />
Dies war ein krönender Abschluss nach Jahren harter wissenschaftlicher<br />
Arbeit mit signifikanten Publikationen und<br />
Vorträgen an nationalen und internationalen Kongressen.<br />
Bei der Verteidigung seiner Arbeit am 12.10.2009, in<br />
Groningen (NL), waren seine Co-Promotoren PD Dr. Eling<br />
de Bruin, PhD, und PD Dr. med. Daniel Uebelhart,<br />
Leitender Arzt, sowie als Opponent, PD Dr. med. Andreas<br />
Klipstein, Oberarzt, anwesend. Zusätzlich wurde er unterstützt<br />
von MitarbeiterInnen der <strong>Rheuma</strong>klinik und Institut<br />
für Physikalische Medizin.<br />
Wir wünschen dem jungen,<br />
neuen Doktor alles Gute für<br />
seine Zukunft.<br />
Prof. Theo Mulder (Promotor der Dissertation)<br />
und Dr. Jaap Swanenburg.<br />
51–2009<br />
PERSÖNLICH<br />
25
26<br />
PUBLIKATIONEN<br />
Original- und Übersichtsartikel<br />
September bis Dezember 2009<br />
Originalartikel<br />
1. Maciejewska-Rodrigues H, Al-Shamisi M, Hemmatazad<br />
H, Ospelt C, Bouton MC, Jäger D, Cope AD, Charles P,<br />
Plant D, Distler JH, Gay RE, Michel BA, Knuth A,<br />
Neidhart M, Gay S, Jüngel A: Functional autoantibodies<br />
against serpin E2 in rheumatoid arthritis.<br />
Arthritis Rheum 62:93-104, 2009.<br />
2. Reich N, Maurer B, Akhmetshina A, Venalis P, Dees C,<br />
Zerr P, Palumbo K, Zwerina J, Nevskaya T, Gay S, Distler<br />
O, Schett G, Distler JH: The transcription factor Fra-2<br />
regulates the production of extracellular matrix in systemic<br />
sclerosis. Arthritis Rheum 62:280-290, 2009.<br />
3. Lefèvre S, Knedla A, Tennie C, Kampmann A, Wunrau C,<br />
Dinser R, Korb A, Schnäker EM, Tarner IH, Robbins PD,<br />
Evans CH, Stürz H, Steinmeyer J, Gay S, Schölmerich J,<br />
Pap T, Müller-Ladner U, Neumann E: Synovial fibroblasts<br />
spread rheumatoid arthritis to unaffected joints.<br />
Nat Med 15:1414-1420, 2009.<br />
4. Oslejsková L, Grigorian M, Hulejová H, Vencovsky J,<br />
Pavelka K, Klingelhöfer J, Gay S, Neidhart M, Brabcová<br />
H, Suchy D, Senolt L: Metastasis-inducing S100A4 protein<br />
is associated with the disease activity of rheumatoid<br />
arthritis. <strong>Rheuma</strong>tology (Oxford) 48:1590-1594, 2009.<br />
5. Hayer S, Pundt N, Peters MA, Wunrau C, Kuhnel I,<br />
Neugebauer K, Strietholt S, Zwerina J, Korb A,<br />
Penninger J, Joosten LAB, Gay S, Ruckle T, Schett G, Pap<br />
T: PI3gamma regulates cartilage damage in chronic<br />
inflammatory arthritis. FASEB J 23:4288-4298, 2009.<br />
6. Neidhart M, Baraliakos X, Seemayer C, Zelder C, Gay<br />
RE, Michel BA, Boehm H, Gay S, Braun J: Expression of<br />
cathepsin K and MMP-1 but not MMP-3 indicates persistent<br />
osteodestructive activity of osteoclasts in longstanding<br />
ankylosing spondylitis.<br />
Ann Rheum Dis 68:1334-1339, 2009.<br />
7. Guiducci S, Distler JHW, Jüngel A, Huber LC, Michel<br />
BA, Gay RE, Pisetsky DS, Gay S, Matucci-Cerinic M,<br />
Distler O: Elevated numbers of microparticles in the<br />
blood of patients with systemic sclerosis.<br />
Arthritis Rheum 58(9):2845-2853, 2009.<br />
8. Karouzakis E, Gay RE, Michel BA, Gay S, Neidhart M:<br />
DNA hypomethylation in rheumatoid arthritis synovial<br />
fibroblasts. Arthritis Rheum 60(12):3613-3622, 2009.<br />
9. Maurer B, Busch N, Jüngel A, Pileckyte M, Gay RE,<br />
Michel BA, Schett G, Gay S, Distler J, Distler O: Fra-2<br />
induces progressive peripheral vasculopathy in mice<br />
closely resembling human systemic sclerosis.<br />
Circulation 120:2367-2376, 2009.<br />
10. Wittmann L, Sensky T, Maeder L, Michel BA, Stoll T,<br />
Buechi S: Suffering and posttraumatic growth in patients<br />
with systemic lupus eryhematosus (SLE) – a qualitativequantitative<br />
case study. Psychosomatics 50:362-374, 2009.<br />
11. Sellam J, Proulle V, Jungel A, Ittah M, Miceli-Richard C,<br />
Gottenberg JE, Toti F, Benessiano J, Gay S, Freyssinet<br />
JM, Mariette X: Increased levels of circulating microparticles<br />
in primary Sjogren's syndrome, systemic lupus erythematosus<br />
and rheumatoid arthritis, and relation with<br />
disease activity. Arthritis Res Ther 15;11(5):R156, 2009.<br />
12. Kurowska-Stolarska M, Distler JH, Rudnicka W,<br />
Neumann E, Pap T, Wenger R, Jüngel A, Michel BA,<br />
Müller-Ladner U, Gay RE, Maslinski W, Gay S, Distler<br />
O: Id-2 induced by hypoxia promotes synovial fibroblastdependent<br />
osteoclastogenesis.<br />
Arthr Rheum 60:3663-3675, 2009.<br />
13. Mannion AF, Helbling D, Pulkovski N, Sprott H: Spinal<br />
segmental stabilisation exercises for chronic low back<br />
pain: programme adherence and its influence on clinical<br />
outcome. Eur Spine J 18:1881-1891, 2009.<br />
14. Hartmann A, Knols R, Murer K, de Bruin ED:<br />
Reproducibility of an isokinetic strength-testing protocol<br />
of the knee and ankle in older adults.<br />
Gerontology 55(3):259-268, 2009.
Reviews<br />
15. Senolt L, Vencovský J, Pavelka K, Ospelt C, Gay S:<br />
Prospective new biological therapies for rheumatoid<br />
arthritis. Autoimmun Rev 9:102-107, 2009.<br />
16. Filková M, Haluzík M, Gay S, Senolt L: The role of<br />
resistin as a regulator of inflammation: Implications for<br />
various human pathologies. Clin Immunol 133:157-170,<br />
2009.<br />
17. Müller-Ladner U, Distler O, Ibba-Manneschi L,<br />
Neumann E, Gay S: Mechanisms of vascular damage in<br />
systemic sclerosis. Autoimmunity 42:587-595, 2009.<br />
18. Distler JH, Beyer C, Schett G, Lüscher TF, Gay S, Distler<br />
O: Endothelial progenitor cells: Novel players in the<br />
pathogenesis of rheumatic diseases.<br />
Arthritis Rheum 60:3168-3179, 2009.<br />
19. Heitz CAM, Hilfiker R, Bachmann LM, Joronen H,<br />
Lorenz T, Uebelhart D, Klipstein A, Brunner F:<br />
Comparison of risk factors predicting return to work<br />
between patients with subacute and chronic non-specific<br />
low back pain: systematic review.<br />
Eur Spine J 18:1829-1835, 2009.<br />
Buchkapitel<br />
20. Danuser B, Klipstein A, Kern F, Canjuga M, Joronen H,<br />
Läubli T: Influences of system structures and research<br />
demands on the study design of a return to work RCT.<br />
In: 15. Erfurter Tage: Prävention von arbeitsbedingten<br />
Gesundheitsgefahren und Erkrankungen.<br />
Verlag Dr. Bussert & Stadeler, 13-25, 2009.<br />
Others<br />
21. Michel BA, Tschumi U, Woolf AD, Zeidler H, Beglinger<br />
Ch, Dalvit G, Felder M, Graf A, Steurer J: Chronische<br />
muskuloskelettale Schmerzen in der <strong>Schweiz</strong>: Die<br />
Betreuungsqualität aus Sicht der Ärzte und der<br />
Patienten. PRAXIS, <strong>Schweiz</strong> Rundschau Med, 17, 2009.<br />
22. Michel BA, Tschumi U, Beglinger Ch, Dalvit G, Felder<br />
M, Graf A, Steurer J: Chronische muskuloskelettale<br />
Schmerzen in der <strong>Schweiz</strong>: Defizite in der<br />
Betreuungsqualität und Massnahmen für die Praxis.<br />
<strong>Schweiz</strong> Aerztezeitung 39:1518-1520, 2009.<br />
23. Michel BA: <strong>Rheuma</strong>behandlung: Vom Heilbad zu<br />
Hightech. VSAO-Journal 2. März:32-34, 2009.<br />
24. Fiechter LB: Was macht die Physiotherapie mit Folterund<br />
Kriegsopfern? [Case Report]. afk Newsletter.<br />
Update 2:6, 2009.<br />
25. Beckmann-Fries V, Ewald SG: Assessment in der<br />
Handtherapie. Praxis Ergotherapie 4:211-215, 2009.<br />
26. Beckmann-Fries V, Meier C: Narbenbehandlung – für<br />
das Optimum an Funktion und Ästhetik.<br />
Pro Manu 1:16-21, 2009.<br />
27. Läubli T, Klipstein A, Norberg M, Jeanrenaud C,<br />
Bienlein B, Canjuga M, De-Goumoens P, Joronen H,<br />
Kern F, Marti J, Tomatis L, Danuser J: An ongoing randomized<br />
controlled trial (RCT) of an interdisciplinary<br />
return-to-work program in back pain patients.<br />
Swiss Medical Weekly 139, Suppl 169:3, 2009.<br />
51–2009<br />
27<br />
FORT- UND<br />
WEITERBILDUNG
28<br />
FORT- UND<br />
WEITERBILDUNG<br />
Fort- und Weiterbildung in<br />
<strong><strong>Rheuma</strong>tologie</strong> und Physikalischer Medizin (USZ)<br />
9. Februar bis 29. April 2010<br />
Datum Thema Zeit Ort<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
9. Februar – Prof. Dr. Christan Wolfrum, Institut für Molekulare Systembiologie, ETH Zürich 14.10 Uhr Gloriastrasse 25<br />
Lipid system receptors<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
23. Februar – Dr. Itshak Golan, Institute of Life Sciences, Swansea University, U.K. 14.10 Uhr Gloriastrasse 25<br />
The Role of CD44 and its Ligand Galectin-8 in the Induction of<br />
Apoptosis in the Arthritic Joints; Routes to New Therapies for<br />
Autoimmune and Cancer Diseases<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
2. März – Dr. med. Karin J. Metzner, USZ 14.10 Uhr Gloriastrasse 25<br />
Genomic diversity of HIV-1 and its impact on antiretroviral therapy<br />
Donnerstag Jahresversammlung 13.00 bis Kleiner Hörsaal OST B<br />
18. März der Zürcher Fachärztegesellschaft für <strong><strong>Rheuma</strong>tologie</strong> 14.45 Uhr<br />
Generalversammlung<br />
Fortbildungsprogramm 15.00 bis<br />
17.30 Uhr<br />
– Prof. Dr. Peter Villiger, <strong><strong>Rheuma</strong>tologie</strong>, Inselspital, Bern 15.00 Uhr<br />
ANCA-assoziierte Vaskulitiden – Klinik und Diagnostik<br />
– PD Dr. Oliver Distler, <strong><strong>Rheuma</strong>tologie</strong>, USZ 15.30 Uhr<br />
ANCA-assoziierte Vaskulitiden – Therapie<br />
– PD Dr. Urs Schwarz, Neurologie, USZ 16.00 Uhr<br />
Vaskulitis – neurologische Manifestationen und sinnvolle Abklärungen<br />
– PD Dr. Thomas Kündig, Dermatologie, USZ 16.30 Uhr<br />
Vaskulitis – Hautmanifestationen<br />
– Prof. Dr. Beat A. Michel, <strong><strong>Rheuma</strong>tologie</strong>, USZ 17.00 Uhr<br />
Grossgefäss-Vaskulitis – Klinik, Diagnostik, Therapie<br />
Stehbuffet 17.30 Uhr<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
23. März – Prof. Dr. Christian Frei, Institut für Zellbiologie, ETH Zürich 14.10 Uhr (gross)<br />
Hypoxia and Cdk4<br />
Donnerstag Kolloquium: Osteoporose 14.30 bis Grosser Hörsaal B Ost<br />
25. März – Einführung und Moderation: PD Dr. Daniel Uebelhart 17.30 Uhr Gloriastrasse 29<br />
Programm auf Homepage Ende Januar 2010<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
30. März – Prof. Matthias Peter, Komp.zentr. Systemphysiologie, ETH Zürich 14.10 Uhr (gross)<br />
Regulation of cell growth and division by ubiquitin-dependent<br />
mechanisms
Datum Thema Zeit Ort<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
13. April – Dr. Jan Krützfeldt, ETH Zürich 14.10 Uhr (gross)<br />
Strategies to silence miRNA<br />
Dienstag Experimentelle <strong><strong>Rheuma</strong>tologie</strong> 13.30 bis Kursraum U Ost 157<br />
20. April – Dr. Alessandra Baumer Wolz, Institute of Medical Genetics, Universität Zürich 14.10 Uhr (gross)<br />
X chromosome inactivation or Human androgenetic cells:<br />
cells with no maternal chromosomes<br />
Donnerstag Kolloquium: Arthrose 14.30 bis Grosser Hörsaal B Ost<br />
29. April – Einführung und Moderation: Prof. Dr. Haiko Sprott 17.30 Uhr Gloriastrasse 29<br />
Programm auf Homepage Ende Januar 2010<br />
Aktualisierte Informationen finden Sie auf der Website http://www.rheuma-schweiz.ch/go2/de/33<br />
51–2009<br />
29
30<br />
Sponsoren «Fort- und Weiterbildung»<br />
Folgende Firmen haben unsere Weiterbildungsveranstaltungen unterstützt, wofür wir uns herzlich bedanken!<br />
Essex Chemie AG
Stark wirksam für Ihre Patienten mit Arthrose 1<br />
Referenz: 1. Fachinformation ARCOXIA ®<br />
, Arzneimittel-Kompendium der <strong>Schweiz</strong>, www.kompendium.ch, Stand Juli 2009.<br />
Gekürzte Fachinformation: Konsultieren Sie bitte vor einer Verschreibung von ARCOXIA ®<br />
die vollständige Fachinformation im Arzneimittel-Kompendium der <strong>Schweiz</strong>. ARCOXIA ®<br />
Filmtabletten. W: Etoricoxib 30 mg<br />
bzw. 60 mg. IND: Arcoxia ist indiziert zur symptomatischen Behandlung von Entzündungen und Schmerzen bei Patienten mit Arthrosen. D: Arcoxia sollte in der niedrigsten wirksamen Dosis über einen möglichst kurzen Zeitraum<br />
angewendet werden. Bei Arthrose beträgt die empfohlene Dosis 30 mg einmal täglich. Arcoxia wird oral eingenommen. Arcoxia kann unabhängig von der Nahrungsaufnahme eingenommen werden. K: Bei bekannter Überempfindlichkeit<br />
gegenüber Etoricoxib oder einem der Hilfsstoffe des Arzneimittels, Bronchospasmus, Urtikaria oder allergieähnlichen Symptomen nach Einnahme von Acetylsalicylsäure oder anderen nicht-steroidalen Antirheumatika,<br />
im dritten Trimenon der Schwangerschaft und in der Stillzeit, bei aktiven Magen- und/oder Duodenalulzera oder aktiven gastrointestinalen Blutungen, bei entzündlichen Darmerkrankungen, bei schwerer Leberfunktionsstörung,<br />
bei schwerer Niereninsuffizienz (Kreatinin-Clearance
32<br />
Condrosulf® hält das Fortschreiten der Arthrose auf. 1,2<br />
1. Kahan A, Vignon E et al. STOPP (STudy on Osteoarthritis Progression Prevention): A new two-year trial with chondroitin 4&6<br />
sul fate. Presented in a Satellite Symposium held at the Annual European Congress of <strong>Rheuma</strong>tology (EULAR), Amsterdam,<br />
21–24 June 2006. 2. Michel BA, Stucki G, Frey D, De Vathaire F, Vignon E, Bruehlmann P, Uebelhart D. Chondroitin 4 and 6<br />
Sul fate in Osteoarthritis of the Knee: A Randomized, Controlled Trial. Arthritis Rheum 2005; 52(3): 779–786.<br />
Z: chondroitini sulfas natricus. I: Degenerative Gelenkerkrankungen. D: 800 mg täglich während einer 3-monatigen Kur. Kl:<br />
Überempfindlichkeit gegen den Wirkstoff. UW: Leichte gastrointestinale Beschwerden, sporadisch allergische Reaktionen. IA:<br />
Keine bekannt. P: Tabletten zu 800 mg: 30*/90*; Granulat in Beuteln zu 800 mg: 30*/90*. Liste B. *Kassenzulässig. Aus führliche<br />
Angaben siehe Arzneimittel-Kompendium der <strong>Schweiz</strong>.<br />
IBSA Institut Biochimique SA, Headquarters and Marketing Operations, Via del Piano, CH-6915 Pambio-Noranco, www.ibsa.ch<br />
Bewegt Menschen.