Bericht - Blattfisch
Bericht - Blattfisch
Bericht - Blattfisch
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Artenschutzprojekt<br />
Kleinfische und Neunaugen in Oberösterreich<br />
<strong>Bericht</strong> über das Projektjahr 2008<br />
C. Gumpinger, C. Ratschan, M. Schauer, J. Wanzenböck & G. Zauner
Finanziert wird dieses Projekt dankenswerter Weise von<br />
folgenden Institutionen:<br />
Naturschutzzentrum d. NATURSCHUTZBUNDES
Artenschutzprojekt Kleinfische – Modul 1 Danksagung<br />
DANKSAGUNG<br />
Bei der Suche nach stark gefährdeten, im Rückgang begriffenen Arten ist man neben Hinweisen<br />
aus der Literatur oft auch auf Fundmeldungen und Beobachtungen von interessierten und<br />
engagierten Privatpersonen angewiesen. Herzlich danken möchten wir in diesem Zusammenhang<br />
Herrn Franz Grims aus Taufkirchen an der Pram, der uns auf frühere Funde von<br />
Schlammpeitzgern, Steinbeißern und Neunaugen im Innviertel aufmerksam machte. Herr Christian<br />
Schafleitner wies uns auf einen aktuellen Neunaugenfund in der Fornacher Redl bei Krichpoint aus<br />
dem Jahr 2007 hin.<br />
Oft ist es eine besondere logistische Herausforderung entlegene Gewässer in den verbliebenen<br />
Auensystemen zu erreichen bzw. potentielle, manchmal sehr kleinräumige Habitate in diesen<br />
Ökosystemen überhaupt erst aufzuspüren. Darüber hinaus war es notwendig die für die<br />
Elektrobefischung notwendigen Zustimmungserklärungen von den Bewirtschaftern der<br />
untersuchten Gewässer einzuholen.<br />
Im Eferdinger Becken hat uns diesbezüglich Mag. Albin Lugmair sehr geholfen. Er besitzt eine<br />
ausgezeichnete Kenntnis der aquatischen Habitate im Eferdinger Becken und beschäftigt sich seit<br />
mehreren Jahren mit ausgewählten biologischen und ökologischen Themen (Amphibien, Vögel,<br />
Makrophyten, Vegetationsökologie, Neophyten, …) in diesem Augebiet. Die Revierobmänner<br />
Manfred Prammer (Aschach), Ing. Georg Lediger (Pesenbach-Gusen) und Josef Dannerbauer<br />
(Donau A) beteiligten sich rege an der Organisation der Befischungsgenehmigungen in den<br />
jeweiligen Revieren.<br />
Bei den Streifzügen im Machland stand uns Hr. Ernst Zobel mit logistischer und tatkräftiger<br />
Unterstützung zur Seite. Hr. Heinrich Hochstöger, Obmann des Reviers Donau-Perg übernahm<br />
dankenswerter Weise die Einholung der Zustimmungserklärungen für die Elektrofischerei in den<br />
Gewässern des Reviers.<br />
Bei den Freilandarbeiten in der Innviertler Seenplatte konnten wir uns auf die ausgezeichnete<br />
Lokalkenntnis von Hermann Maislinger, seines Zeichens Obmann des Reviers Salzach, verlassen.<br />
Hr. Maislinger war auch in Bezug auf die zeitintensive Organisation der Genehmigungen für die<br />
Elektrofischerei im Revier sehr hilfsbereit.<br />
In den Inn-Auen hat sich Herr Josef Grahamer viel Zeit genommen und uns beim Aufspüren<br />
"verdächtiger" Kleingewässer und Kontakten zu Fischereiberechtigten sehr geholfen.<br />
Für die engagierte Mithilfe in den unzugänglichen Traun-Auen bedanken wir uns bei Gerhard<br />
Kirchmayr und Markus Andert.<br />
Bei Herrn Helmut Wellendorf vom Naturhistorischen Museum in Wien bedanken wir uns für das<br />
freundliche Übermitteln einer Liste von Belegen unserer Zielfischarten.<br />
Für fachliche Inputs, Literatur und Daten bedanken wir uns bei Jörg Bohlen, Wolfgang Honsig-<br />
Erlenburg, Thomas Mörtelmaier, Nikolaus Schotzko, Bernhard Schmall und Friedrich Schwarz.<br />
Und schlussendlich einen großen Dank an alle Fischereiberechtigten und -pächter, die den<br />
Freilanderhebungen in ihren Revieren zugestimmt haben!
Artenschutzprojekt Kleinfische – Modul 1 Inhaltsverzeichnis<br />
INHALTSVERZEICHNIS<br />
Inhaltsverzeichnis ........................................................................................................................... 1<br />
1 Zusammenfassung .................................................................................................................. 3<br />
2 Einleitung ................................................................................................................................. 6<br />
3 Zielsetzung .............................................................................................................................. 8<br />
4 Methodik ................................................................................................................................ 10<br />
5 Ergebnisse ............................................................................................................................. 14<br />
5.1 Strömer (Leuciscus souffia) ............................................................................................ 14<br />
5.1.1 Allgemeines ............................................................................................................. 14<br />
5.1.2 Historische Verbreitung ............................................................................................ 16<br />
5.1.3 Aktuelle Verbreitung ................................................................................................ 17<br />
5.1.4 Diskussion ............................................................................................................... 20<br />
5.1.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 21<br />
5.2 Neunaugen (Eudontomyzon mariae / Lampetra planeri) ................................................. 23<br />
5.2.1 Allgemeines ............................................................................................................. 23<br />
5.2.2 Historische Verbreitung ............................................................................................ 26<br />
5.2.3 Aktuelle Verbreitung ................................................................................................ 27<br />
5.2.4 Diskussion ............................................................................................................... 31<br />
5.2.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 38<br />
5.3 Goldsteinbeißer (Sabanejewia balcanica) ....................................................................... 41<br />
5.3.1 Allgemeines ............................................................................................................. 41<br />
5.3.2 Historische Verbreitung ............................................................................................ 43<br />
5.3.3 Aktuelle Verbreitung ................................................................................................ 43<br />
5.3.4 Diskussion ............................................................................................................... 44<br />
5.3.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 48<br />
5.4 Steinbeißer (Cobitis elongatoides) .................................................................................. 51<br />
5.4.1 Allgemeines ............................................................................................................. 51<br />
5.4.2 Historische Verbreitung ............................................................................................ 53<br />
5.4.3 Aktuelle Verbreitung ................................................................................................ 54<br />
5.4.4 Diskussion ............................................................................................................... 57<br />
5.4.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 60<br />
1
Artenschutzprojekt Kleinfische – Modul 1 Inhaltsverzeichnis<br />
5.5 Schlammpeitzger (Misgurnus fossilis) ............................................................................. 63<br />
5.5.1 Allgemeines ............................................................................................................. 63<br />
5.5.2 Historische Verbreitung ............................................................................................ 65<br />
5.5.3 Aktuelle Verbreitung ................................................................................................ 66<br />
5.5.4 Diskussion ............................................................................................................... 68<br />
5.5.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 72<br />
5.6 Karausche (Carassius carassius).................................................................................... 76<br />
5.6.1 Allgemeines ............................................................................................................. 76<br />
5.6.2 Historische Verbreitung ............................................................................................ 77<br />
5.6.3 Aktuelle Verbreitung ................................................................................................ 78<br />
5.6.4 Diskussion: .............................................................................................................. 80<br />
5.6.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 82<br />
5.7 Bitterling (Rhodeus amarus) ........................................................................................... 82<br />
5.7.1 Allgemeines ............................................................................................................. 82<br />
5.7.2 Historische Verbreitung ............................................................................................ 84<br />
5.7.3 Aktuelle Verbreitung ................................................................................................ 84<br />
5.7.4 Diskussion ............................................................................................................... 87<br />
5.7.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 88<br />
5.8 Moderlieschen (Leucaspius delineatus) .......................................................................... 88<br />
5.8.1 Allgemeines ............................................................................................................. 88<br />
5.8.2 Historische Verbreitung ............................................................................................ 89<br />
5.8.3 Aktuelle Verbreitung ................................................................................................ 90<br />
5.8.4 Diskussion ............................................................................................................... 91<br />
5.8.5 Defizitanalyse und Maßnahmenvorschläge .............................................................. 92<br />
6 Ausblick ................................................................................................................................. 93<br />
7 Literatur ................................................................................................................................. 94<br />
8 Abbildungs- und Tabellenverzeichnis ................................................................................... 104<br />
9 Anhang ................................................................................................................................ 108<br />
2
Artenschutzprojekt Kleinfische – Modul 1 Zusammenfassung<br />
1 ZUSAMMENFASSUNG<br />
Das Artenschutzprojekt „Kleinfische und Neunaugen in Oberösterreich“ hatte im vergangenen<br />
ersten Untersuchungsjahr die Nachsuche nach gefährdeten und seltenen Fisch- und<br />
Neunaugenarten zum Ziel (Abb. 1). Folgende fünf Fischarten bzw. die Rundmäulergruppe wurden,<br />
teils erst während des Projektes, als Zielarten der ersten Projektphase definiert:<br />
Strömer (Leuciscus souffia)<br />
Neunaugen (Eudontomyzon mariae / Lampetra planeri)<br />
Goldsteinbeißer (Sabanejewia balcanica)<br />
Steinbeißer (Cobitis elongatoides)<br />
Schlammpeitzger (Misgurnus fossilis)<br />
Abb. 1 Aktuelle Nachweise der Zielfischarten in den untersuchten Gebieten in Oberösterreich<br />
Einige weitere Arten die mit den Hauptzielarten häufig in den gleichen Wohngewässern<br />
vergesellschaftet sind, wurden als sekundäre Zielfischarten definiert. Für sie wurden keine<br />
gezielten Beprobungen durchgeführt, sie wurden aber in den Untersuchungen zu den<br />
Hauptzielarten mit bearbeitet. Alle Haupt-Zielarten sind im Anhang II der FFH-Richtlinie der<br />
Europäischen Union genannt. Insgesamt wurden, auch im Zuge anderer Projekte, die<br />
Elektrobefischungen beinhalteten und deren Ergebnisse hinsichtlich der Fragestellung<br />
vorliegenden Projektes ausgewertet wurden, 174 Gewässer bzw. Probestrecken untersucht.<br />
3
Artenschutzprojekt Kleinfische – Modul 1 Zusammenfassung<br />
Dabei zeigte sich, dass das aktuelle Vorkommen des Strömers in Oberösterreich auf das<br />
Ennsgebiet beschränkt ist, die Populationsgrößen lokal sind allerdings überraschend gut. Im<br />
Vergleich zur historischen Verbreitung in Oberösterreich ist dies ein dramatischer Rückgang des<br />
Verbreitungsareals, der sich in erster Linie aus dem Verlust geeigneter Habitate durch<br />
flussbauliche Maßnahmen ergibt. Neben der Wiederherstellung der Durchwanderbarkeit des<br />
Hauptflusses sowie zahlreicher Zuflüsse im Enns-System stehen die Rücknahme oder zumindest<br />
das Hintanhalten von Uferverbauungen, die die Gewässerdynamik einschränken, im Vordergrund<br />
der Maßnahmenvorschläge zur Verbesserung der Bestandssituation.<br />
Hinsichtlich der beiden Neunaugen-Arten, (eine davon kommt im Mühlviertel nicht allzu selten<br />
vor; nördlich der Donau wurde daher bewusst nicht erhoben) konnten in den, hinsichtlich der<br />
Wissensdefizite und naturschutzrelevanter Fragestellungen wichtigen Gewässern südlich der<br />
Donau, neue Populationen gefunden und teils eindeutig zumindest auf Gattungsniveau bestimmt<br />
werden.<br />
In den Gewässern Fornacher Redlbach und Sipbach, sowie im Pfuda-System, einem Zufluss der<br />
Pram, im Sandbach, einem Aschach-Zufluss, in der oberösterreichischen Enns und in kleinen<br />
Bächen des Machlandes sowie im Inn im Zuge der Gewässerzustandserhebung durch das<br />
Bundesamt für Wasserwirtschaft (Scharfling) wurden Neunaugen nachgewiesen. Offenbar ist das<br />
Vorkommen der Gattung Lampetra in Oberösterreich tatsächlich auf das Mühlviertel beschränkt.<br />
Allerdings scheint die Donau nicht jenen Stellenwert als Verbreitungsgrenze zwischen Lampetra<br />
und Eudontomyzon zu haben, der ihr mangels genauerer Daten bisher zuerkannt wurde.<br />
Generell müssen Erhalt und Ausweitung des Lebensraums bestehender Bestände als oberste<br />
Priorität gelten. Die Entfernung von Wanderhindernissen, die für Neunaugen unpassierbar sind,<br />
die Vernetzung der Hauptflüsse mit den Zubringern und die Renaturierung völlig ausgebauter<br />
Gewässerstrecken sind weitere wichtige Maßnahmen zur Förderung der Neunaugenbestände.<br />
Der Sensationsfund schlechthin gelang im Zuge dieses Projektes, sowie einer parallel<br />
durchgeführten Erhebung im gleichen Aschach-Abschnitt mit dem Fund des Goldsteinbeißers. Es<br />
ist dies nicht nur der Erstnachweis in Oberösterreich sondern gleichzeitig auch der westlichste<br />
Fundort für diese Fischart.<br />
Um die lokale Verbreitung sowie die Bestandsdichten des Goldsteinbeißers in der Aschach besser<br />
abschätzen zu können ist eine verdichtende Bestandsuntersuchung im Fundgebiet nötig.<br />
Geeignete Strategien, um das Risiko des Verschwindens dieses sehr kleinräumigen Vorkommens<br />
zu minimieren, sind die Vernetzung der bzw. Herstellung von besiedelbaren Habitaten durch<br />
morphologische Sanierungsmaßnahmen, die räumliche Ausweitung der aktuellen Bestände durch<br />
ein umsichtiges Nachzuchtprogramm, sowie die Etablierung von Beständen in für eine<br />
Besiedelung geeigneten Zubringern.<br />
Aufgrund der ungeklärten Auftrennung in verschiedene Arten und entsprechender Unsicherheiten<br />
in der Taxonomie ist eine Abgrenzung der Gesamtverbreitung des Steinbeißers in Europa zum<br />
derzeitigen Wissensstand nicht möglich. In Oberösterreich lagen für das Vorkommen dieser<br />
Fischart vor der Durchführung des Projektes nur einzelne Meldungen unterschiedlicher Aktualität<br />
aus dem Inn- und Mühlviertel vor. Im Rahmen des Kleinfischprojektes konnte diese Fischart in fünf<br />
von 45 Befischungsstellen nachgewiesen werden. Die Fundorte verteilen sich auf mehrere<br />
Gewässer des Machlandes und ein Gieß-System der Enknach. Offensichtlich stellen in den<br />
Machland-Gewässern, die vor Jahrzehnten durchgehend kanalisiert wurden und aktuell in<br />
gewissen zeitlichen Abständen geräumt werden, schon einige kleinräumige, wenige Monate alte<br />
Sedimentablagerungen mangels naturnaher Bachabschnitte noch das geeignetste Mikrohabitat für<br />
diese seltene Fischart dar. Im Laufe des folgenden Projektjahres müssen noch weitere Zuflüsse im<br />
Machland untersucht werden, um zumindest einen groben Eindruck von der Verbreitung des<br />
Steinbeißers in diesem wasserbaulich stark überprägten Gewässernetz zu bekommen.<br />
Zum unmittelbaren Schutz des Steinbeißers müssen wirksame Maßnahmen zur Reduktion der<br />
Auswirkungen der Gewässerräumungen erarbeitet werden. Langfristig müssen<br />
Renaturierungskonzepte formuliert und umgesetzt werden. Um diese Umsetzung zu ermöglichen<br />
4
Artenschutzprojekt Kleinfische – Modul 1 Zusammenfassung<br />
oder zumindest zu beschleunigen wird die Ausweitung der bestehenden Natura2000-Gebiete und<br />
–Schutzgutlisten vorgeschlagen.<br />
Der Schlammpeitzger war in Oberösterreich vor der Durchführung der Freilandarbeiten für das<br />
Kleinfischprojekt rezent nur an einem Fundort im Machland nachgewiesen. Im Rahmen des<br />
Projektes wurde an 73 Probestellen speziell nach dieser Fischart gesucht. In elf davon konnte die<br />
in Österreich vom Aussterben bedrohte Art, teils in beachtlichen Stückzahlen, nachgewiesen<br />
werden. Die neuen Fundorte liegen im Machland, im Eferdinger Becken und in den Traun-Donau-<br />
Auen östlich von Linz. Dazu kommt eine, nicht von den Verfassern bearbeitete Fundstelle in den<br />
Innauen bei Mühlheim.<br />
Die Hauptursache für den drastischen Rückgang dieser stark gefährdeten Art ist der Verlust<br />
geeigneter Lebensräume und das Fehlen deren natürlicher Neubildung. Der typischen<br />
Verlandungstendenz von Augewässern steuern natürlicherweise Hochwasserereignisse entgegen,<br />
die an der Donau aber infolge Donauausbau und Kraftwerksketten in Häufigkeit und Mächtigkeit<br />
anthropogen stark verändert sind, und deshalb diese Funktion nicht mehr ausreichend erfüllen<br />
können.<br />
Aus fachlicher Sicht sollte der Schlammpeitzger jedenfalls als Schutzgut in den geplanten<br />
Natura2000-Schutzgebieten Machland, Traun-Donau-Auen und Unterer Inn bzw. Auwälder am<br />
unteren Inn aufscheinen bzw. nachgeführt werden. Zur Förderung des Schlammpeitzgers in<br />
Oberösterreich muss grundsätzlich das Ausbringen von standortfremden Fischarten in<br />
Lebensräume des Schlammpeitzgers unterbleiben. Die Neubildung bzw. Aufwertung von Habitaten<br />
kann durch ambitionierte Gewässervernetzungsprogramme und die Dynamisierung von<br />
Altarmsystemen initiiert werden. Ein Besatzprogramm zur Ansiedelung der Art in neu geschaffenen<br />
und noch existenten Lebensräumen ist sicherlich eine geeignete Maßnahme zur<br />
Bestandssicherung in Oberösterreich. Inwiefern ein Nachzuchtprogramm sinnvoll ist oder die<br />
Initiierung neuer Populationen lediglich durch Umsetzen von Tieren aus dicht besiedelten<br />
Habitaten erfolgen kann, muss das nächste Untersuchungsjahr zeigen.<br />
Im Zuge der Untersuchungen wurde eine weitgehende Übereinstimmung in den<br />
Lebensraumansprüchen zwischen dem Schlammpeitzger und der Karausche, aber auch mit<br />
anderen limnophilen Kleinfischarten bestätigt. Aus diesem Grund werden keine gezielten<br />
Maßnahmen für die Karausche formuliert. Die Art profitiert von Maßnahmen, die auf den Schutz<br />
und Erhalt des Schlammpeitzgers abzielen.<br />
Das Phänomen, dass Bitterlinge in kleineren Fließgewässern in hohen Dichten auftreten, war<br />
zwar aus anderen Bundesländern beschrieben, dass auch in der Aschach und anderen<br />
oberösterreichischen Fließgewässern überaus dichte Bitterlingsbestände auftreten, ist hingegen<br />
erst seit kurzem bekannt und hat sich bei den Erhebungen im Rahmen des Kleinfisch-Projekts<br />
eindrucksvoll bestätigt. Bezüglich der landesweiten Verbreitung des Bitterlings können keine<br />
dramatischen Unterschiede zwischen historischen Angaben und aktuellen Daten diagnostiziert<br />
werden. Dabei sei noch einmal darauf verwiesen, dass dichte Großmuschelbestände die<br />
Grundbedingung für eine erfolgreiche Reproduktion des Bitterlings sind. Besonders zu erwähnen<br />
sind in diesem Zusammenhang die Vorkommen der vom Aussterben bedrohten Flussperlmuschel<br />
Margaritifera margaritifera sowie der ebenfalls stark gefährdeten Gemeinen Flussmuschel Unio<br />
crassus in mehreren Bereichen der Aschach.<br />
Unabhängig von der aktuell auf wissenschaftlicher Ebene diskutierten Frage, ob das<br />
Moderlieschen in Oberösterreich überhaupt autochthon, also ursprünglich heimisch ist, ist der<br />
potentielle Lebensraum dieser Fischart in den letzten Jahrzehnten massiv zurückgegangen.<br />
Aktuell gibt es lediglich ein bekanntes Vorkommen, untypischerweise in einem kleinen Wiesenbach<br />
im Norden Oberösterreichs.<br />
Das erste Untersuchungsjahr im Kleinfischprojekt brachte viele neue Erkenntnisse, vor allem<br />
hinsichtlich der Verbreitung einzelner Arten in Oberösterreich. Die weitere Suche, vor allem aber<br />
auch die Konzeption geeigneter Schutzmaßnahmen zur Sicherung und Verbesserung der<br />
Bestandssituation werden in den kommenden Jahren in diesem Projekt im Vordergrund stehen.<br />
5
Artenschutzprojekt Kleinfische – Modul 1 Einleitung<br />
2 EINLEITUNG<br />
Beschäftigt man sich mit Gewässern als Fischlebensraum, fischökologischen Fragestellungen oder<br />
auch fischereilichen Themen, so fällt auf, dass es einige wenige Fischarten gibt, die im<br />
allgemeinen Interesse und damit auch in der einschlägigen Literatur stark verankert sind. Es<br />
handelt sich vor allem um wirtschaftlich interessante Arten. Dieser wirtschaftliche Stellenwert leitet<br />
sich in unserer Zeit, in der die Berufsfischerei zwar in den Seen noch, wenn auch meist im<br />
Nebenerwerb, betrieben wird, an den Flüssen aber nur noch rudimentär existent ist, hauptsächlich<br />
aus der Angelfischerei ab.<br />
Angelfischereilich interessant sind in Österreich in erster Linie die Bewohner kühler, rasch<br />
strömender Fließgewässer, etwa die heimischen Arten Bachforelle (Salmo trutta f. fario) oder<br />
Äsche (Thymallus thymallus), aber auch allochthone Arten, wie die eigentlich in Nordamerika<br />
beheimateten und in Europa vom Menschen eingebrachten Regenbogenforelle (Oncorhynchus<br />
mykiss) und Bachsaibling (Salvelinus fontinalis). Dieses Interesse hängt natürlich auch mit der<br />
Tatsache zusammen, dass ein überwiegender Teil des österreichischen Gewässernetzes montane<br />
und alpine Bäche und Flüsse umfasst.<br />
Es finden sich aber auch zahlreiche Gewässerabschnitte, die vom Typ her eher einem<br />
Tieflandgewässer gleichen. Zwar fehlen in Oberösterreich gewässertypologisch gesehen echte<br />
Tieflandflüsse weitgehend, aber sowohl manche kleinere Flüsse des Alpenvorlands als auch die<br />
Unterläufe der meisten größeren Flüsse und die Donau gehören der sogenannten Barbenregion<br />
(Epi-Potamal) an, in der Salmoniden nicht mehr den Hauptanteil der Artenzusammensetzung<br />
ausmachen. In diesen Gewässern sind die fischereilich interessanten Arten eher Raubfische,<br />
beispielsweise Hecht (Esox lucius), Zander (Sander lucioperca) oder Huchen (Hucho hucho).<br />
Die Fischerei auf sogenannte Weißfische, also die karpfenartigen Vertreter der heimischen<br />
Fischfauna hat in heutiger Zeit, mit Ausnahme des namensgebenden Karpfen (Cyprinus carpio), in<br />
Oberösterreich sehr eingeschränkt auf das unmittelbare Umland der Donau kaum mehr<br />
Bedeutung. Dagegen hatte die Fischerei auf, und die Nutzung aller Fischarten über Jahrhunderte<br />
nicht nur eine bedeutende Tradition, sondern war ein wichtiger Aspekt in der Ernährung der<br />
Bevölkerung.<br />
Neben der Flussfischerei hat in Österreich die Seenfischerei, die auch heute noch sehr vereinzelt<br />
hauptberuflich betrieben wird, eine lange Geschichte. Da die meisten, vor allem<br />
oberösterreichischen Seen eher sauerstoffreich und kalt sind, dominieren auch hier<br />
kaltstenotherme Arten, etwa Seesaibling (Salvelinus umbla) und verschiedene Renken-Arten<br />
(Coregonus sp.).<br />
Generell ist das Fangspektrum der Angel- und der noch verbliebenen Berufsfischer also auf einige<br />
wenige Arten beschränkt. Die Mehrzahl der mehr als 60 heimischen Fisch- und Rundmäulerarten<br />
fällt also nicht in das Zielspektrum der Fischerei. Dem entsprechend ist traditionell von Seiten der<br />
Fischerei über diese Arten, es handelt sich vor allem um kleinwüchsige und solche mit versteckter<br />
Lebensweise, sehr wenig bekannt.<br />
Bereits in der ersten Hälfte des 19. Jahrhunderts begannen allerdings frühe Fischforscher wie<br />
Siebold, Heckel oder Kner mit der gezielten Sammlung und Beschreibung heimischer Fische,<br />
wobei sie, soweit verfügbar, auch wirtschaftlich unbedeutende Arten bearbeiteten. Deren<br />
Verfügbarkeit war allerdings eingeschränkt, weil sie ihre Forschungen eher auf den lokalen<br />
Fischmärkten betrieben als in Form selbstständiger Freilandarbeiten.<br />
Erst etwa seit den 80er Jahren hat sich die Freiland-Fischökologie als eigene Disziplin zu<br />
entwickeln begonnen, wobei ein starker Schwerpunkt auf angewandten Fragestellungen liegt.<br />
Leider war der Lebensraum für Fische durch die systematische Regulierung, die intensive Nutzung<br />
der Wasserkraft und Güteprobleme zu diesem Zeitpunkt schon sehr stark in Mitleidenschaft<br />
gezogen. Die grundlegenden Daten zur Faunistik der meisten unserer Kleinfischarten stammen<br />
daher erst aus den letzten zwei bis drei Jahrzehnten.<br />
6
Artenschutzprojekt Kleinfische – Modul 1 Einleitung<br />
Bei genauerer Betrachtung verschiedener ökosystemarer Zusammenhänge zeigt sich, dass<br />
zahlreiche, unauffällige Arten eine teils eminent wichtige Rolle in der jeweiligen Biozönose spielen.<br />
Das vorliegende Gemeinschaftsprojekt soll helfen, den Wissensstand über ausgewählte,<br />
besonders gefährdete Fischarten zu verbessern und damit auch eine Basis für die Formulierung<br />
von Maßnahmen zu schaffen, die den Erhalt dieser Arten in Oberösterreich langfristig sichern.<br />
Dass diese Thematik vielen naturinteressierten Menschen ein Anliegen ist, zeigt die Vielzahl der<br />
Institutionen, die dieses Projekt finanziell unterstützt und selbst über oft traditionelle<br />
Auffassungsunterschiede hinweg zu einem gemeinsamen Engagement gefunden haben. Diese<br />
Entwicklung soll durch eine intensive Öffentlichkeitsarbeit, einerseits durch Publikation der<br />
Projektergebnisse in Fachzeitschriften, besonders aber durch ihre Verbreitung in Medien, die<br />
allgemeinverständlich und der breiten Öffentlichkeit zugänglich sind, vorangetrieben werden.<br />
Das Schaffen von Bewusstsein für seltene und teils unbekannte Gewässerlebewesen kann nur<br />
über den Weg der Wissensvermittlung erfolgreich sein. Die Untersuchungen geben Einblick in<br />
hochinteressante und teils unbekannte Zusammenhänge, die nicht nur Experten begeistern<br />
sondern auch den wissenschaftlichen Laien zum Staunen bringen. Diese Erkenntnisse wurden<br />
zum Teil schon während des Projektes veröffentlicht (siehe Anhang) und sollen in nächster Zukunft<br />
einem breiten Publikum zugänglich gemacht werden.<br />
7
Artenschutzprojekt Kleinfische – Modul 1 Zielsetzung<br />
3 ZIELSETZUNG<br />
Zielsetzung vorliegenden Projektes ist ein Erkenntniszugewinn bezüglich Verbreitung,<br />
Lebensweise und ökologischer Ansprüche einiger ausgewählter Fischarten aus dem Spektrum der<br />
meist gefährdeten Fischarten Oberösterreichs. Als Zielfischarten wurden im Zuge einer intensiven<br />
fachlichen Diskussion folgende Kleinfischarten beziehungsweise die Rundmäulergruppe<br />
ausgewählt:<br />
Strömer (Leuciscus souffia)<br />
Neunaugen (Eudontomyzon mariae / Lampetra planeri)<br />
Steinbeißer (Cobitis elongatoides)<br />
Schlammpeitzger (Misgurnus fossilis)<br />
Moderlieschen (Leucaspius delineatus)<br />
Weitere Species, beispielsweise Karausche (Carassius carassius) und Bitterling (Rhodeus<br />
amarus), die mit den Hauptzielarten häufig in den gleichen Wohngewässern vergesellschaftet sind,<br />
wurden als sekundäre Zielfischarten definiert. Für diese Arten wurden also keine gezielten<br />
Beprobungen durchgeführt, sie wurden aber in den Untersuchungen zu den Hauptzielarten mit<br />
bearbeitet und entsprechend dem vertretbaren Aufwand detailliert erfasst.<br />
Während der Freilandarbeiten wurde dann in der Aschach erstmalig in Oberösterreich der<br />
Goldsteinbeißer (Sabanejewia balcanica) nachgewiesen. In der Folge wurde diese Art zu den<br />
prioritären Zielfischarten dazu genommen und das Moderlieschen, dessen natürliche Verbreitung<br />
ohnehin nicht restlos geklärt ist, wurde zu den sekundären Species gereiht.<br />
Alle Haupt-Zielarten sind im Anhang II der FFH-Richtlinie der Europäischen Union genannt, die in<br />
den letzten Jahren in nationales Recht umgesetzt wurde. In der FFH-Richtlinie wird neben der<br />
Errichtung von Schutzgebieten für diese Arten, die sog. Natura 2000 Gebiete, auch das Monitoring<br />
ihres Erhaltungszustandes gefordert. Vorliegende Arbeit liefert wichtige Grundlagen für ein zu<br />
implementierendes Monitoringprogramm für eine Reihe dieser Arten. Sie stellt daher einen<br />
integralen Bestandteil der Umsetzung der FFH-Richtlinie in Oberösterreich dar.<br />
In Bezug auf eine Reihe weiterer in Oberösterreich nachgewiesene Fischarten, z.B.<br />
Weißflossengründling (Romanogobio vladykovi), Kesslergründling (Romanogobio kessleri),<br />
Semling (Barbus sp. petenyi-Gruppe), Sichling (Pelecus cultratus), Donau-Kaulbarsch<br />
(Gymnocephalus baloni), Sterlet (Acipenser ruthenus), Perlfisch (Rutilus meidingeri) oder die<br />
Gruppe der Coregonen bestehen aktuell mindestens ebenso große Wissensdefizite. Diese Arten<br />
kommen jedoch schwerpunktmäßig in der Donau und großen Potamalgewässern oder in großen<br />
Seen vor, wo die methodische Bearbeitung sehr aufwändig ist und den Rahmen des Projektes bei<br />
weitem sprengen würde.<br />
Die wichtigste Fragestellung hinsichtlich der genannten Hauptzielarten ist in vorliegendem Projekt<br />
jedenfalls, mehr über ihre Verbreitung im oberösterreichischen Landesgebiet in Erfahrung zu<br />
bringen. So waren vor Beginn der Untersuchungen beispielsweise nur drei Verbreitungsstandorte<br />
des Steinbeißers und lediglich ein einziger Schlammpeitzgerfundort bekannt.<br />
Aber nicht nur über das aktuelle Verbreitungsgebiet dieser Kleinfischarten ist sehr wenig bekannt.<br />
Auch historische Belege oder zumindest geschichtliche Hinweise auf solche Arten sind in der<br />
Regel nur in dem Ausmaß vorhanden, in dem diese Fische aus kulinarischer Sicht verwertet und<br />
daher in diversen Anlieferungs- und Lagerlisten verschiedener Institutionen, vor allem Klöster,<br />
registriert sind. Zahlreiche Arten, darunter in der Regel auch die genannten Zielfischarten,<br />
scheinen dem entsprechend in der historischen Literatur praktisch nicht auf.<br />
Aus der Verschneidung zahlreicher zusätzlicher Parameter, etwa solche zur Beschreibung von<br />
Gewässermorphologie und -chemismus sowie anderer Einflussgrößen, die im Zuge der<br />
8
Artenschutzprojekt Kleinfische – Modul 1 Zielsetzung<br />
Freilandarbeiten sehr umfangreich erhoben wurden (siehe Kap. 4), können auch autökologische<br />
Aspekte zu den Zielfischarten, zumindest für die Verhältnisse in Oberösterreich, abgeleitet und<br />
zum Teil mit Erkenntnissen aus anderen Bundesländern bzw. Nachbarländern verglichen werden.<br />
Die im Freiland erhobenen und in den folgenden Kapiteln dargestellten Ergebnisse liefern<br />
zahlreiche Erkenntnisse und lassen auch Theorien ableiten, die im letzten Drittel des vorliegenden<br />
<strong>Bericht</strong>es dargestellt und diskutiert werden.<br />
Darauf aufbauend erfolgt für jede Zielfischart eine auf den im ersten Projektjahr erhobenen Daten<br />
basierende Defizitanalyse sowie die Formulierung von Maßnahmenvorschlägen zur Verbesserung<br />
der aktuellen Situation der jeweiligen Fischart, soweit sich dies als nötig herausgestellt hat.<br />
Die vorliegende Untersuchung hat also einerseits den Zweck, mehr über verschiedene Lebens-<br />
und Lebensraumaspekte der Zielfischarten zu erfahren. Dieser Erkenntniszugewinn soll helfen, die<br />
genannten Fischarten in Oberösterreich langfristig und nachhaltig zu schützen und zu erhalten.<br />
Mittel- und langfristig soll im Zuge des Projektes ein Lebensraumnetzwerk in Oberösterreich<br />
aufgebaut werden, das nicht nur den Arterhalt im jeweiligen Gewässer(-system) sichert, sondern<br />
aus Sicht der Autoren auch das beste Mittel gegen das akute Aussterben einer Art im Falle von<br />
Katastrophen oder Schadensereignissen darstellt. Um für neu anzulegende Gewässer bzw.<br />
wiederzubesiedelnde Fließgewässerabschnitte auch Gründerpopulationen bereitstellen zu können,<br />
ist die künstliche Nachzucht vor allem jener Arten, deren lokale Populationen zu klein sind, um<br />
Besatz-Individuen entnehmen und umsetzen zu können, ein wichtiger Projektbestandteil.<br />
Generell wird beim Umsetzen bzw. Neubesatz von Fischen im Zuge des Projektes darauf<br />
geachtet, dass nur solche Gewässer bearbeitet werden, in denen diese Art definitiv verschwunden<br />
ist. Für die Entnahme bzw. die Nachzucht von Besatzindividuen wird die zoogeografisch<br />
nächstliegende Population herangezogen. Auf diese Weise soll die genetische Integrität der Arten<br />
zumindest auf Einzugsgebietsebene, so weit dies ohne genetische Untersuchungen möglich ist,<br />
erhalten bleiben.<br />
Eine weitere Zielstellung des Projektes ist die Verbreitung des neu gewonnenen, wie auch des in<br />
der Fachwelt bereits bekannten Wissens in der Bevölkerung. Die Autoren vorliegenden <strong>Bericht</strong>es<br />
sind der Überzeugung, dass lediglich mit einer breit angelegten Informationskampagne eine<br />
Wissensbasis in unserer Gesellschaft geschaffen werden kann, aus der auch ein gewisses<br />
Verantwortungsgefühl jedes Einzelnen für unsere Umwelt und Natur und auf diese Weise<br />
letztendlich auch für die Zielfischarten entstehen kann.<br />
Die Faszination für naturgeschichtliche Zusammenhänge, vor allem die intensive Vernetzung<br />
biologischer Regelkreise und die Komplexität ökosystemarer Zusammenhänge fasziniert sehr viele<br />
Menschen und fesselt sie an diverse Naturdokumentationen in Print- und anderen Medien. Diese<br />
Faszination auch für die heimische Natur zu wecken, ist Teil der Zielsetzung dieses Projektes. Und<br />
faszinierende Zusammenhänge gibt es auch in der heimischen Natur ohne Zahl. Alleine die<br />
Fortpflanzungsbiologie des Bitterlings beispielsweise, der seine Eier in die Atemöffnung von<br />
Muscheln legt, wo sie sich geschützt entwickeln können oder die Tatsache, dass Schlammpeitzger<br />
atmosphärische Luft atmen können, wenn ihr Wohngewässer vorübergehend austrocknet, sind<br />
nicht weniger fesselnd, als etwa biologische Besonderheiten in tropischen Breiten – sie sind nur<br />
schlichtweg unbekannt.<br />
9
Artenschutzprojekt Kleinfische – Modul 1 Methodik<br />
4 METHODIK<br />
Aufgrund zeit- und budgetbedingter Grenzen war die Konzentration der Ressourcen auf<br />
ausgewählte kleinwüchsige Fisch- und Neunaugenarten in Oberösterreich notwendig.<br />
Die Auswahl der Zielarten (Tab. 1) in vorliegendem Artenschutzprojekt geschah unter<br />
Einbeziehung des Gefährdungsstatus in Österreich, methodischer Überlegungen und ihres<br />
Vorkommens in Oberösterreich.<br />
Die Taxonomie einiger Arten ist noch nicht vollends geklärt. In neuerer Zeit kam es zu zahlreichen<br />
Änderungen zum Beispiel bei Arten der Gattungen Cobitis und Sabanejewia (KOTTELAT & FREYHOF<br />
2007). Auch in Zukunft ist hier mit weiteren Änderungen zu rechnen. Die verwendete Nomenklatur<br />
der vorliegenden Arbeit richtet sich nach der aktuellen Ausgabe der Roten Liste für Österreich<br />
(WOLFRAM & MIKSCHI 2007).<br />
Tab. 1: Ausgewählte Zielarten, Gefährdungskategorie, Nennung in Anhang II der FFH-Richtlinie und<br />
bisherige, rezente Fundorte in Oberösterreich.<br />
Art<br />
(Lateinische Bezeichnung)<br />
Strömer<br />
(Leuciscus souffia)<br />
Bachneunauge<br />
(Lampetra planeri)<br />
Ukrainisches Bachneunauge<br />
(Eudontomyzon mariae)<br />
Goldsteinbeißer<br />
(Sabanejewia sp.)<br />
Steinbeißer<br />
(Cobitis elongatoides)<br />
Schlammpeitzger<br />
(Misgurnus fossilis)<br />
Bitterling<br />
(Rhodeus amarus)<br />
Karausche<br />
(Carassius carassius)<br />
Moderlieschen<br />
(Leucaspius delineatus)<br />
Gefährdungskategorie (Rote<br />
Liste Österreich)<br />
FFH-<br />
Richtlinie<br />
Fundorte in<br />
Oberösterreich<br />
EN (stark gefährdet) ja Enns (>10)<br />
EN (stark gefährdet) ja >10<br />
VU (gefährdet) ja 0**<br />
EN (stark gefährdet) ja 0*<br />
VU (gefährdet) ja 3<br />
CR (vom Aussterben bedroht) ja 1<br />
VU (gefährdet) ja >10<br />
EN (stark gefährdet) nein >10<br />
EN (stark gefährdet) nein 1<br />
* Der Goldsteinbeißer war für Oberösterreich nicht nachgewiesen, wurde aber bei Befischungen im Rahmen<br />
des Kleinfischprojekts in der Aschach entdeckt.<br />
** .. vor Projekt bekannte Funde im Vöckla-System waren irrtümlich als Lampetra planeri bestimmt worden<br />
10
Artenschutzprojekt Kleinfische – Modul 1 Methodik<br />
Die Auswahl der Befischungsgebiete erfolgte auf Basis aktuellen Kartenmaterials (ÖK AMap Fly),<br />
von Luftbildern (DORIS, Google Earth), historischer Literatur und vor allem älterer bzw. rezenter<br />
Fundmeldungen für die Zielfischarten sowie der Experteneinschätzung der beteiligten<br />
Büromitarbeiter. Zusätzlich wurde in zahlreichen Publikationen (siehe Anhang) sowie bei<br />
Veranstaltungen des oberösterreichischen Landesfischereiverbandes die Öffentlichkeit um<br />
Mitarbeit gebeten. Auf der Homepage des Technischen Büros für Gewässerökologie<br />
(www.blattfisch.at) war Informationsmaterial zum Projekt abrufbar. Zusätzlich bestand hier die<br />
Möglichkeit Fundmeldungen für gefährdete Kleinfischarten unmittelbar (online) zu übermitteln.<br />
Eingehende Fang- bzw. Fundmeldungen wurden bei der Wahl der zu befischenden Gewässer<br />
ebenfalls berücksichtigt.<br />
Insgesamt wurden zehn Zielgebiete definiert, in denen mindestens eine der Zielfischarten zu<br />
erwarten war (Tab. 2). Im Rahmen des Projektes wurden in diesen Zielgebieten insgesamt 128<br />
Probestrecken untersucht.<br />
Tab. 2: Zielgebiete, Zeitaufwand für Befischungen und realisierte Befischungsstellen der einzelnen Bearbeiter<br />
Zielgebiet Befischungstage Befischungsstellen Bearbeiter<br />
Innviertel (Bezirk Schärding) 2,5 18 ezb – TB Zauner<br />
Innauen 2 11 ezb – TB Zauner<br />
Traun-Krems-Donau Auen 2 7 ezb – TB Zauner<br />
Eferdinger Becken 3,5 28 TBG - blattfisch<br />
Machland 2,5 19 TBG - blattfisch<br />
Innviertler Seengebiet 1,5 12 TBG - blattfisch<br />
Redlbach – Fornacher Redl 1 7 TB Alpenfisch<br />
Enknach 2 9 TB Alpenfisch<br />
Enns und Zubringer 2 17 TB Alpenfisch<br />
Zusätzlich wurden als Eigenleistung von den Bearbeitern 46 weitere Befischungspunkte in<br />
Oberösterreich in die Projektsdatenbank miteinbezogen, sodass sich die Zahl der bearbeiteten<br />
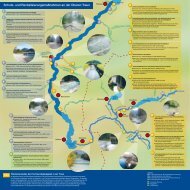
Gewässer bzw. Probestrecken auf insgesamt 174 erhöht (Abb. 2).<br />
11
Artenschutzprojekt Kleinfische – Modul 1 Methodik<br />
TBG -<br />
Abb. 2: Übersichtskarte über die Verteilung der Befischungsstellen im Rahmen des vorliegenden Projektes in<br />
Oberösterreich.<br />
Die Beprobung der Gewässer erfolge mittels Elektrobefischung mit benzinbetriebenen<br />
Gleichstromaggregaten.<br />
Fließgewässer wurden watend gegen die Strömungsrichtung befischt. Stillgewässer wurden im<br />
Uferbereich watend befischt. In manchen Fällen kamen hier auch kleinere Boote zum Einsatz.<br />
Größere Fließgewässer wurden mit speziellen Elektrofangbooten in Strömungsrichtung befischt.<br />
Anfangs- und gegebenenfalls auch Endpunkte der Befischungsstrecken wurden mittels GPS-<br />
Geräten aufgenommen (Fa. Garmin). Es wurden (unprojizierte) geographische Koordinaten in<br />
Dezimalgrad-Format gespeichert bei Verwendung des Datums WGS84 (World Geodetic System<br />
1984). Zusätzlich wurde die befischte Länge bzw. Fläche geschätzt und die Befischungszeit<br />
notiert. Über die Abschätzung des Befischungsaufwandes können Fischdichten an<br />
unterschiedlichen Gewässern miteinander verglichen werden.<br />
Der Strom wird bei der Befischung über die Anode, die den Metallring des Keschers bzw. den<br />
Fangrechen des Bootes bildet, ins Wasser geleitet; die Kathode führt in Form einer Kupferlitze vom<br />
Fangaggregat ins Wasser. Fische werden bei der Elektrobefischung je nach Leitfähigkeit des<br />
Gewässers und Körperlänge in einem Umkreis von etwa 1 bis 3 m vom Fangpol angezogen,<br />
schwimmen auf diesen zu (Galvanotaxis) und werden in seiner unmittelbaren Nähe im Stromfeld<br />
narkotisiert (Galvanonarkose). Die betäubten Fische werden unverzüglich aus dem Wasser<br />
gekeschert und in einer Wanne mit ausreichend Frischwasserversorgung bis zur Messung und<br />
Wägung zwischengehältert. Die gefangenen Individuen der Zielfischarten wurden vermessen und<br />
12
Artenschutzprojekt Kleinfische – Modul 1 Methodik<br />
zum Teil ein repräsentativer Querschnitt auch gewogen, um für diese Arten neben dem<br />
Artenspektrum auch beschreibende Größen wie Populationsaufbau und Bestandsgewicht<br />
berechnen und analysieren zu können. Begleitfischarten wurden bestimmt und semiquantitativ in<br />
Häufigkeitsklassen (1-einzelne (1-3 Individuen), 2-wenige (4-20 Ind.), 3-viele (21-100 Ind.), 4massenhaft<br />
(>100 Ind.)) unterteilt. Nach abgeschlossener Datenaufnahme wurden die Tiere in die<br />
ursprünglichen Habitate zurückgesetzt.<br />
Neben der Verortung der Befischungsstrecken wurden auch allgemeine hydromorphologische<br />
Parameter der Gewässer aufgenommen (Gewässerlänge, mittlere Breite, Abfluss, mittlere Tiefe,<br />
maximale Tiefe, Sichttiefe). Der Gewässertyp (Entwässerungsgraben, Bach, Fluss, Augewässer,<br />
Tümpel, Weiher, See, künstlich), das Erscheinungsbild (natürlich-naturnahe, naturnahe verbaut,<br />
hart verbaut, naturfern), sowie bei Augewässern auch die Art der Anbindung (ober-, unter-,<br />
beidseitig, nicht) und die Anbindungsfrequenz (>HQ1, HQ1 – HQ10,
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5 ERGEBNISSE<br />
5.1 Strömer (Leuciscus souffia)<br />
5.1.1 Allgemeines<br />
Merkmale: Langgestreckter, fast drehrunder Körper (meist 12 bis 18 cm, max. 25 cm lang);<br />
kleines, leicht unterständiges Maul; 44 bis 60 Schuppen entlang der Seitenlinie; 10-13<br />
Afterflossenstrahlen (im Gegensatz zu 18 bis 20 beim Schneider); Ansätze der paarigen Flossen<br />
und der Afterflosse orange; orange-gelb eingefasste Seitenlinie (im Gegensatz zur schwarz<br />
eingefassten Seitenlinie beim Schneider); vor allem zur Laichzeit mit violett schimmerndem,<br />
dunklem Längsband (Abb. 3).<br />
Abb. 3: Habitus von Strömer (unten) und Schneider (oben) im Vergleich. Bild: C. Ratschan.<br />
Habitat: Der Strömer besiedelt hauptsächlich Fließgewässer der Äschenregion und vereinzelt<br />
auch Seen, er zeigt ähnliche Habitatansprüche wie der Schneider (Alburnoides bipunctatus) und<br />
die Hasel (Leuciscus leuciscus) (GERSTMEIER & ROMIG 1998, SCHWARZ 1998, BOHL et al. 2004).<br />
Nach letzteren Autoren ist er häufig zusammen mit Aitel (Leuciscus cephalus), Bachforelle (Salmo<br />
trutta f. fario), Koppe (Cottus gobio), Bachschmerle (Barbatula barbatula), Barbe (Barbus barbus)<br />
und dem Schneider selbst anzutreffen. In der Schweiz wurde bei landesweiten Untersuchungen,<br />
die sowohl die Vorkommen des „Nordströmers“ (Telestes souffia) als auch des „Südströmers“<br />
(Telestes (Leuciscus) souffia muticellus) erfassten, eine Vergesellschaftung mit Elritze (Phoxinus<br />
phoxinus), Bachschmerle, Bachforelle und Koppe ermittelt (SCHWARZ 1998).<br />
Die von BOHL et al. (2004) untersuchten Gewässerabschnitte in Bodensee-Zuflüssen, in denen<br />
Strömer angetroffen wurden, waren überwiegend naturbelassene, naturnahe oder bedingt<br />
naturnahe Bereiche. Der überwiegende Teil war nur geringfügig beschattet. An Substraten fanden<br />
sich vor allem Fels, Steine, Kies und Sand. Die Strömungsgeschwindigkeiten im Stromstrich<br />
betrugen meistens zwischen 30 und 60 cm/s. Unterstandsmöglichkeiten fanden sich sowohl im<br />
Ufer- als auch im Sohlbereich. An allen Beprobungsstellen mit Strömernachweisen waren<br />
Uferbereiche mit Grobsteinschüttungen vorhanden. Die Strömer sämtlicher Altersklassen wurden<br />
14
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
überwiegend ufernah, in Bereichen heterogen verteilter Fließgeschwindigkeiten, angetroffen.<br />
Immer wurden dabei die strömungsberuhigten Bereiche bevorzugt, zumeist Strömungsschatten<br />
und Lücken in Grobsteinschüttungen mit bis über 50 cm Eindringtiefe. Die Standorte hatten<br />
Wassertiefen bis 60 cm oder wenig mehr.<br />
Auch Hinterwasserbereiche von Buhnenstrukturen bzw. Verklausungen und Wurzelwerk bewirkten<br />
die nötige Strömungsvarianz und wurden von Strömern aufgesucht. SCHWARZ (1998) und BOHL et<br />
al. (2004) charakterisierten auch Winter-, Fortpflanzungs-, Brut- und Sommerhabitate.<br />
Winterhabitate sind vor allem durch größere Tiefe, geringe Strömung und reichlich Deckungs- oder<br />
Einstandsmöglichkeiten gekennzeichnet. Zudem wurde die besondere Bedeutung von<br />
Nebengewässern (Seitenbäche, Altarme) als stark frequentierte Winterhabitate hervorgehoben.<br />
Differenzierte Beschreibungen von Laichplätzen im Freiland liegen in der bekannten Literatur nicht<br />
vor. Die Untersuchungen von BLESS (1994, 1996) und BOHL et al. (2004) zeigen die<br />
Minimalanforderungen hinsichtlich Strömung und Substrat. Es werden relativ flache Bereiche mit<br />
Strömungsgeschwindigkeiten von 15-50 cm/s und Steinen von 1-3 cm Durchmesser benötigt. Das<br />
Kieslückensystem sollte gut durchströmt sein, da die Strömer keine Laichgruben schlagen,<br />
sondern ihre Eier in das Lückensystem legen, wo sie den Steinen anhaften. Die Wassertiefe an<br />
sich scheint aber im Vergleich mit anderen Faktoren nicht bestimmend zu sein. Bei Bruthabitaten<br />
handelte es sich hauptsächlich um sehr flache Standorte, an denen praktisch keine Strömung<br />
vorhanden war und das Wasser bei Sonneneinstrahlung stärker als der restliche Wasserkörper<br />
erwärmt wurde. Der Gewässergrund bestand zumeist aus Feinsedimentablagerungen.<br />
Diese Standorte fanden sich häufig in sehr flachen Gleithangbereichen und Seitenarmen. In<br />
letzteren konnten die größten Brutschwärme beobachtet werden. Weiterhin wurden<br />
Larvenschwärme auch in flachen, strömungsfreien Einbuchtungen hinter und zwischen<br />
Blocksteinen gefunden. Die adulten Laichtiere suchen nach der Reproduktionsphase ihre<br />
Sommerhabitate auf, genauso wie die 1 + und 2 + -Fische nach dem Verlassen ihrer Winterstandorte.<br />
Sie halten sich dabei in strömungsberuhigten Uferbereichen auf, vor allem im Bereich hinter<br />
Felsen, im Spaltensystem von Grobsteinschüttungen oder hinter Verklausungen auf, wo<br />
unterschiedlichste Strömungsverhältnisse anzutreffen sind. Durch den nahen Hauptstromstrich<br />
wird Nahrung zugeführt. Es wurden Wassertiefen von 60 cm und mehr bei Sohlsubstraten, die<br />
überwiegend aus Kies, Steinen, Felsen und Sand bestanden, bevorzugt.<br />
Fortpflanzung: Strömer werden frühestens in ihrem zweiten Lebensjahr, meist jedoch im dritten<br />
bei einer Länge von etwa 11 bis 12 cm geschlechtsreif (SCHWARZ 1998). Geschlechtsdimorphismus<br />
wird durch den stärkeren Laichausschlag und längere Brust- und Bauchflossen der<br />
Männchen beschrieben (SPILLMANN 1962). Strömer laichen in Schwärmen in der Zeit von Ende<br />
März bis Anfang Mai bei einer Wassertemperatur von 10 bis 12 °C. Dem Laichgeschehen können<br />
kurze, stromaufgerichtete Laichwanderungen, auch in Zubringer, vorausgehen, um geeignete<br />
Laichhabitate aufzusuchen. BLESS (1996a) beschreibt diese mit einer Strömungsgeschwindigkeit<br />
von 0,2 m/s und einer Korngröße von 2 – 3 cm. Pro Saison wird nur einmal abgelaicht, die Eizahl<br />
liegt bei 1500 bis 6250 pro Weibchen. Nach einer Entwicklungsdauer von 100 bis 180<br />
Tagesgraden (BLESS 1996; KAINZ & GOLLMANN 1998; BOHL et al. 2004) schlüpfen die Larven und<br />
dringen zuerst noch tiefer ins Interstitial ein, um es nach zwei bis drei Wochen zu verlassen. Nach<br />
der Emergenz werden die Larven in die Bruthabitate verdriftet.<br />
Nahrung: Die Adulttiere gelten als vorwiegend benthivor, GERSTMEIER & ROMIG (1998) und<br />
SCHWARZ (1998) geben jedoch auch driftende Kleintiere und über der Wasseroberfläche fliegende<br />
Insekten, die im Sprung erbeutet werden, als wichtige Nahrungskomponenten an. Das Höchstalter<br />
wird mit 13 Jahren angegeben.<br />
15
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Populationsdynamik: Aus Schweizer Gewässern sind Dichten von 105 bis 11797 Ind/ha,<br />
Biomassen von 0,3 bis 368,3 kg/ha und relative Individuenanteile von 1 bis 28% bekannt<br />
(SCHWARZ, 1996). Bei BOHL et al. (2004) werden maximale Dichten von 33 Individuen pro 100 m<br />
Befischungsstrecke in der Leiblach angegeben. Aufgrund der hohen Mobilität (Laichwanderungen)<br />
bzw. der jahreszeitlich unterschiedlichen Habitatpräferenzen wurden auch zeitlich im Jahresverlauf<br />
stark schwankende Dichten dokumentiert. Die minimale Verdoppelungszeit einer Population wird<br />
mit 1,4 bis 4,4 Jahren angegeben (www.fishbase.org), wobei die Grundlage für diese Angabe<br />
unklar bleibt.<br />
5.1.2 Historische Verbreitung<br />
Europa: Nach WOLFRAM & MIKSCHI (2007) ist der Strömer eine mitteleuropäische Art, die nur in<br />
Südfrankreich, im Einzugsgebiet der Rhone, in Süddeutschland bis zum Main, in Norditalien und<br />
im ehemaligen Jugoslawien sowie in der Schweiz und Österreich vorkommt. Nach GERSTMEIER &<br />
ROMIG (1998) und BANARESCU & HERZIG-STRASCHIL (1998) und KOTTELLAT & FREYHOF (2007)<br />
kommt der Strömer auch im oberen Theißbecken, in Rumänien und der Ukraine vor. Weiters wird<br />
er von BANARESCU & HERZIG-STRASCHIL (1998) auch für den Balkan bis Süd-Bulgarien und<br />
Montenegro angegeben, wobei es sich um die Nominalform handeln soll und nicht um die<br />
zahlreichen, nahe verwandten Arten bzw. Unterarten die ebenfalls die Balkanhalbinsel bevölkern.<br />
Diese Autoren stellen den Strömer wieder in die Untergattung Telestes, was auch durch<br />
genetische Untersuchungen gestützt wurde (MACHORDOM et al 1999). Früher wurden in<br />
Mitteleuropa 3 Unterarten des Strömers unterschieden: Die Nominalform (Leuciscus souffia<br />
souffia) aus Frankreich, der Südströmer (Leuciscus souffia muticellus) aus Italien und der<br />
Nordströmer (Leuciscus souffia agassizi bzw. L. souffia agassii). Aufgrund morphologischer<br />
(BANARESCU & HERZIG-STRASCHIL 1998; KOTTELAT 1997) und genetischer Untersuchungen<br />
(GILLES et al. 1998; SALZBURGER et al. 2003) werden heute nur noch Nord- und Südströmer<br />
unterschieden, die französischen Populationen werden dem Nordströmer zugerechnet.<br />
Nach DUßLING & BERG (2001) war der Strömer im 19ten Jahrhundert eine in Baden-Württemberg<br />
weit verbreitete und häufige Fischart. Auch GERSTMEIER & ROMIG (1998) bezeichnen den Strömer<br />
als „…früher nicht selten“.<br />
Österreich: Nach SPINDLER (1997), WOLFRAM & MIKSCHI (2007) und ZAUNER & RATSCHAN (2007)<br />
besiedelte der Strömer ursprünglich geeignete Gewässer in ganz Österreich mit Ausnahme des<br />
Burgenlandes.<br />
Oberösterreich: Historische Hinweise auf den Strömer sind grundsätzlich problematisch und<br />
kritisch zu hinterfragen. Verwechslungen mit Laube und Schneider sind kaum auszuschließen,<br />
zumal die örtlichen Bezeichnungen für den Strömer auch Lauge oder Laube lauteten.<br />
So findet sich beispielsweise in einem sehr umfangreichen Werk über die Traunfischerei von<br />
SCHEIBER (1930) eine Eingangsrechnung des Stiftes Kremsmünster, wo u. a. die dortigen<br />
Traunfischer "Laugen" abgeliefert hatten. Weiter wird in diesem Werk auch von "Lauben"<br />
gesprochen, die von Traunfischern gefangen wurden. Ob es sich dabei jeweils um Alburnus<br />
alburnus, Alburnoides bipunctatus oder Leuciscus souffia gehandelt hat, bleibt ungeklärt. Der<br />
einzige brauchbare Hinweis auf Strömer in der Traun findet sich bei KUKULA (1874), der „Telestes<br />
agassizii in den Nebenflüssen der Donau, Enns, Traun, Inn usw.“ nennt.<br />
Für den Tiroler Inn wird der Strömer bereits bei MOJSISOVIC (1897) genannt. Vorkommen auch im<br />
oberösterreichischen Unteren Inn bzw. dessen Zuflüsse lassen sich von der bereits zitierten<br />
Angabe von KUKULA (1874) ableiten. Ein diesbezüglich relevanter Hinweis zum Strömer findet sich<br />
weiters bei KERSCHNER (1956) mit der Bemerkung, dass dieser im Salzach-Inn-Gebiet als "Lauge"<br />
16
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
bezeichnet wurde. Ebenfalls für den oberösterreichischen Inn und die Salzach werden „Laugen“<br />
von KRAFFT (1874) genannt.<br />
Eine fundierte historische Aufschlüsselung von Nachweisen in der Salzach liefert SCHMALL (2008).<br />
Strömer - Angaben gehen bis zu SCHRANK (1798) zurück. Auch MOJSISOVIC (1897) führte den<br />
Strömer für die Salzach an. Den wertvollsten Hinweis liefert allerdings ANONYMUS (1979), der<br />
ehemals massenhafte Vorkommen in der Salzach schildert und die Art genau beschreibt, sodass<br />
Verwechslungen mit Schneider oder Laube auszuschließen sind. Ende der 70er Jahre kam der<br />
Strömer in der Salzach kaum mehr vor und ist aktuell ausgestorben.<br />
Das historische Vorkommen von Strömern in der Enns kann aufgrund der ausgedehnten aktuellen<br />
Bestände als gesichert angenommen werden. Konkrete, verfügbare historische Quellen<br />
beschränken sich auf die bereits zitierte Arbeit von KUKULA (1874).<br />
Zusammenfassend zeichnet sich das Bild, dass das Verbreitungsgebiet des Strömers in<br />
Oberösterreich ursprünglich nachweislich weit größer war, als dies das einzige erhaltene<br />
Vorkommen im Ennsgebiet vermuten ließe. Neben Salzach, Inn und Traun wären ehemalige<br />
Vorkommen in hyporhithralen Abschnitten beispielsweise von Antiesen, Mühl, Vöckla, Alm, Krems,<br />
Steyr oder Aist plausibel, diesbezügliche Annahmen müssen aber derzeit spekulativ bleiben.<br />
5.1.3 Aktuelle Verbreitung<br />
Europa: GERSTMEIER & ROMIG (1998) berichten von einem drastischen Rückgang im historischen<br />
Verbreitungsgebiet und vor allem in Deutschland. Dies wird von DUßLING & BERG (2001) sowie von<br />
LEUNER et al. (2000) für Baden-Württemberg und Bayern bestätigt. Auch SCHWARZ (1998) äußert<br />
sich ähnlich in Bezug auf den Nordströmer in der Schweiz.<br />
Österreich: WOLFRAM & MIKSCHI (2007) sehen den Strömer als eine der am stärksten gefährdeten<br />
Rhithralarten Österreichs. Die Sensitivität des Strömers gegenüber flussbaulichen Eingriffen und<br />
hydrologischen Veränderungen bewirkte einen drastischen Rückgang und die Aufsplitterung in<br />
isolierte Teilpopulationen. Nach ZAUNER & RATSCHAN (2007) kommen Strömer aktuell in der<br />
alpinen Bioregion noch vor allem in Enns, Ybbs, Mur, Gail, Drau, Gurk, Tiroler Inn, Alpenrhein,<br />
Bregenzer Ach, Dornbirner Ach sowie in deren Zubringern vor. In der kontinentalen Bioregion ist er<br />
noch in Mur, Ybbs und Enns zu finden. Vereinzelte Nachweise sind aus Traisen, Triesting, Kleine<br />
Erlauf, Gießgang Greifenstein und Donau bekannt; Das aktuelle Verbreitungsgebiet bleibt damit<br />
weit unter dem historischen (vermutlich Fließgewässer vom Hyporhithral bis zum Übergang ins<br />
Epipotamal incl. weitgehend erloschener Bestände in Inn, unterer Salzach, unterer Traun, Steyr,<br />
Donau).<br />
Oberösterreich: Die Erhebungen im Zuge des vorliegenden Kleinfischprojektes und im Zuge der<br />
Gewässerzustandsüberwachung zeigen das aktuelle Vorkommen des Strömers in Oberösterreich<br />
auf das Ennsgebiet beschränkt. Auch weiter stromauf in der steirischen Enns kommen aktuell<br />
Strömer vor (JUNGWIRTH et al. 1996). Die nächstgelegenen Bestände außerhalb Oberösterreichs<br />
liegen in der mittleren und unteren Ybbs in Niederösterreich.<br />
Trotz intensiver Suche im Rahmen verschiedener Projekte konnten Strömer im Inn und in der<br />
Salzach bzw. anderen Nebenflüssen der Donau nicht mehr gefunden werden. In der Enns konnte<br />
der Strömer allerdings auf einer relativ langen Flussstrecke von Thaling und Kronstorf über Steyr<br />
(Gewässerzustandsüberwachung, Restwasserstudie Enns) bis in die Stauräume Losenstein und<br />
Großraming bis unterhalb des Kraftwerkes Weyer (Kleinfischprojekt) nachgewiesen werden (Abb.<br />
4). Zur Laichzeit im Mai 2008 fanden sich Schwärme von laichbereiten Strömern in den<br />
Mündungsbereichen fast aller Zuflüsse zu diesen Stauräumen, namentlich im Stiedelsbach,<br />
Rohrbach, Reichraming (Mündungsbereich unterhalb des unpassierbaren „Schrabachwehres“) ,<br />
17
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Rodelsbach, Pechgrabenbach, Neustiftgraben, Lumplgraben und Gaflenzmündung, daneben noch<br />
an einigen Standorten im Uferbereich der Stauräume selbst. Lediglich in einigen kleinen Zuflüssen<br />
mit stark rhithralem Charakter (z.B. Oberplaißabach) konnten keine Strömer gefunden werden. Als<br />
einzige Ausnahme von diesem Bild muss der Ramingbach gelten. Hier wurden trotz ähnlicher<br />
Habitatausprägung wie in anderen Zuflüssen mit Strömern, keine Bestände nachgewiesen.<br />
Abb. 4: Fundorte des Strömers im Jahr 2008 im Vergleich zu früheren Nachweisen in der Umgebung.<br />
Die Bestandsgrößen waren als überraschend gut einzustufen, an den meisten Standorten wurden<br />
massenhaft (d.h. über 100 Tiere – siehe Anhangblätter) Strömer gefunden. Dabei gilt zu beachten,<br />
dass sich die Tiere auf Grund der Laichzeit aus größeren Flussbereichen an den Mündungen der<br />
Zubringerbäche zum Laichen versammelten. Dieser Umstand spiegelt sich auch in der<br />
Größenzusammensetzung der gefangenen Individuen wieder (Abb. 5). In den Stauräumen<br />
Losenstein und Großraming bzw. deren Zubringerbächen wurden im Mai deutlich größere<br />
Individuen gefangen, fast ausschließlich laichbereite Tiere mit einer Länge von 13 – 15 cm. Im<br />
Unterlauf der Enns überwogen im Oktober kleinere Fische um 10 cm.<br />
18
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Individuenzahl<br />
100<br />
80<br />
60<br />
40<br />
20<br />
0<br />
Leuciscus souffia, Enns + Zubringer<br />
Kleinfisch, n = 193<br />
GZÜV, n = 188<br />
0 50 100 150 200 250 300<br />
Totallänge<br />
Abb. 5: Längenfrequenz der gefangenen Strömer im Unterlauf der Enns (Gewässerzustandsüberwachungsverordnung<br />
GZÜV) und in den Stauräumen Losenstein und Großraming bzw. deren<br />
Zubringerbächen (Artenschutzprojekt Kleinfische).<br />
An den Fundstellen waren die Strömer hauptsächlich mit Bachforellen, Regenbogenforellen,<br />
Elritzen, Äschen, Bachschmerlen, Koppen, Aiteln, Nasen und Hechten vergesellschaftet (Abb. 6).<br />
Daneben fanden sich vereinzelt Barben, Gründlinge, Huchen, Flussbarsche, Bachsaiblinge,<br />
Lauben, Schneider, Aale und Rotaugen.<br />
Stellen<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
Le.so<br />
Sa.tr<br />
On.my<br />
Ph.ph<br />
Th.th<br />
Ba.br<br />
Co.go<br />
Le.ce<br />
Ch.na<br />
Es.lu<br />
Ba.ba<br />
Strömer, Leuciscus souffia<br />
Go.go<br />
Abb. 6: Begleitfischarten die zusammen mit Strömern an den verschiedenen Fundstellen nachgewiesen wurden.<br />
Blau: rheophile Arten, grün: indifferente Arten.<br />
Hu.hu<br />
Pe.fl<br />
Sa.fo<br />
Al.al<br />
Al.bi<br />
An.an<br />
Ru.ru<br />
19
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5.1.4 Diskussion<br />
Die Ergebnisse der vorliegenden Studie stimmen in Bezug auf die Habitatwahl des Strömers<br />
teilweise mit den bisherigen Literaturangaben überein. Großräumig ist die Enns über weite<br />
Strecken vom Unterlauf bis zum Kraftwerk Weyer der Äschenregion (bzw. dem Hyporhithral bis<br />
zum Übergang ins Epipotamal) zuzurechnen, für die der Strömer charakteristisch ist. Tatsächlich<br />
war die Äsche auch ein oft gefundener Begleitfisch des Strömers. Andererseits ist die Enns in<br />
Oberösterreich stark anthropogen überformt und als Staukette ausgebaut. Dies widerspricht den<br />
Angaben von BOHL et al. (2004) die den Strömer nur in naturnahen Fließgewässern finden<br />
konnten. Auch die Aussage von WOLFRAM & MIKSCHI (2007) und ZAUNER & RATSCHAN (2007), die<br />
den Ausbau der Fließgewässer als wesentliche Ursache des Rückgangs und der Gefährdung<br />
ansehen, scheint in diesem Fall, zumindest auf den ersten Blick, nicht zutreffend. Dagegen muss<br />
festgehalten werden, dass der relativ große Fluss Enns mit zahlreichen strömungsberuhigten<br />
Nebengewässern, die in die Seitentäler hineinragen, die in der Literatur oft hervorgehobene<br />
Heterogenität in Bezug auf Wasserströmungen, Tiefenvarianz und Sedimentvielfalt aufweist.<br />
In den Stauräumen von Losenstein und Großraming wurden die Strömer hauptsächlich in den<br />
Mündungen der Nebenbäche gefunden, und zwar zur Laichzeit. Diese Habitate stimmen in ihren<br />
Eigenschaften weitgehend mit den bei BLESS (1996), SCHWARZ (1998) und BOHL et al. (2004)<br />
beschriebenen Laichhabitaten überein. Die vergleichsweise hohen Individuendichten in den<br />
Zubringern relativieren sich allerdings in Anbetracht der Tatsache, dass sich der Lebensraum einer<br />
Population außerhalb der Laichzeit auf einen gesamten Enns-Stauraum (ca. 7 – 12 km) bezieht.<br />
Somit sind außerhalb des Laichhabitats (unter der Annahme, dass die gesamte Strömerpopulation<br />
in Zubringern laicht) deutlich geringere Strömer-Dichten anzunehmen. Dies bestätigt auch die<br />
geringe Dichte von subadulten Individuen, die bei den Erhebungen in den Stauräumen Losenstein<br />
und Großraming im Hauptstrom selbst gefunden wurden.<br />
Bemerkenswert ist, dass im Gegensatz dazu in der einzigen kurzen Fließstrecke der<br />
oberösterreichischen Enns (Unterwasser Kraftwerk Garsten bis Mündung Steyr; GZÜV 2008) bei<br />
herbstlichen Erhebungen viele Strömer nachgewiesen werden konnten. Dies weist darauf hin,<br />
dass Fließstrecken der Enns ein deutlich höheres Potential als Strömer-Habitat aufweisen dürften<br />
als Staue mit Zubringern als Reproduktionsareal.<br />
Auch in der kurzen Stauwurzel im Unterwasser des Kraftwerks Mühlrading (letzter Stauraum der<br />
Unteren Enns stromab) konnten dichte Strömerbestände gefunden werden. Besonders interessant<br />
erscheint hier, dass am Tag trotz intensiverer Beprobung (ca. 4 km Uferlinie) nur 4 Individuen<br />
gefangen wurden, während in der Nacht (ca. 2 km Uferlinie) 150 Strömer dokumentiert wurden.<br />
Dies weist auf eine diurnal stark unterschiedliche Habitatwahl hin: Untertags dürften sich die<br />
Strömer hier in hohen Wassertiefen bzw. tief in den Ritzen der blocksteingesicherten Ufer<br />
aufhalten, während nachts eine seichtere, ufernähere Habitatwahl und höhere Dispersion zu<br />
beobachten war.<br />
Im stromab anschließenden Stau bei Thaling wurden trotz umfangreicher Tag- und<br />
Nachtbeprobungen keine Strömer dokumentiert. Dies lässt vermuten, dass tiefe Staue unattraktive<br />
Lebensräume für Strömer darstellen. Auch im Ennskanal, einem künstlichen, strukturarmen<br />
Gerinne, konnten keine Strömer gefunden werden (ZAUNER & RATSCHAN, 2008), während in der<br />
Restwasserstrecke stromab Thaling zwar Strömer nachgewiesen wurden, jedoch nur ein einzelnes<br />
Individuum (BERG et al. 2009). Auch diese Restwasserstrecke weist durch bestehende<br />
Querbauwerke (Rampen) den Charakter eines weitgehend gestauten Gewässers mit nur sehr<br />
kurzen freifließenden Abschnitten auf.<br />
In Bezug auf die Vergesellschaftung mit anderen Fischarten wurde schon das häufige Auftreten<br />
gemeinsam mit der Äsche erwähnt. Auch die, im vorliegenden Projekt am häufigsten gefangenen<br />
Begleitfischarten wie Bachforelle, Regenbogenforelle, Elritze, Schmerle, Koppe und Aitel gleichen<br />
den Angaben von SCHWARZ (1998) und BOHL et al. (2004). Obwohl die Ansprüche des Strömers<br />
mit denen von Schneider und Hasel gleichgesetzt wurden (GERSTMEIER & ROMIG 1998, BOHL et al.<br />
2004), konnten in diesem Projekt Schneider nur einmal zusammen mit Strömern gefangen werden.<br />
20
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Haseln wurden überhaupt nicht zusammen mit Strömern vorgefunden. Dies war auch bei<br />
SCHWARZ (1998) der Fall. BOHL et al. (2004) fanden Schneider oft und Haseln fallweise mit<br />
Strömern vergesellschaftet.<br />
Allerdings zeigt eine genaue Analyse der Tabellen in BOHL et al. (2004), dass an jenen Stellen wo<br />
sehr viele Strömer gefangen wurden gar keine Haseln vorkamen und dort wo Haseln gefunden<br />
wurden nur wenige Strömer gefangen wurden. Dies würde eher auf eine Konkurrenzbeziehung<br />
zwischen Hasel und Strömer hindeuten, ja im Extremfall sogar auf ein konkurrenzbedingtes<br />
Ausschlussphänomen, wenn eine weitgehende Überlappung ihrer ökologischen Nischen<br />
angenommen wird.<br />
Gegen diese Hypothese spricht allerdings, dass zumindest in Österreich eine deutliche Zonierung<br />
im Längsverlauf der Fließgewässer zu beobachten ist:<br />
Der Strömer als im Vergleich zu Hasel und Schneider rhithralere Art, kommt mehr auf die<br />
Mittelläufe beschränkt vor (hier sehr oft vergesellschaftet mit der Elritze), während der<br />
Verbreitungsschwerpunkt von Schneider und Hasel weiter im Potamal liegt. Dies bestätigen durch<br />
die längszonalen Verteilungen von Hasel, Strömer und Schneider in anderen Fließgewässern wie<br />
beispielsweise Mur, Ybbs oder Drau und es schlägt sich in entsprechenden Einstufungen des<br />
Fischregionsindex nach SCHMUTZ et al. (2000) nieder (Strömer: 5,4; Schneider: 5,6; Hasel: 6,3).<br />
Darüber hinaus dürfte der Strömer eher sommerkühle Gewässer bevorzugen, während<br />
Schneiderbestände oft in ausgesprochen sommerwarmen, kleineren Fließgewässern in hohen<br />
Dichten auftreten.<br />
Genauere Untersuchungen müssten diese Hypothesen näher beleuchten.<br />
5.1.5 Defizitanalyse und Maßnahmenvorschläge<br />
Der Strömer ist im Anhang II der FFH Richtlinie der Europäischen Union gelistet und genießt<br />
dadurch einen besonderen Schutzstatus. Österreich verpflichtete sich zur Umsetzung der FFH-<br />
Richtlinie, daher sollten Schutzgebiete für diese Art ausgewiesen werden, die<br />
Bestandsentwicklung verfolgt und gegebenenfalls Maßnahmen für die Erreichung des günstigen<br />
Erhaltungszustandes gesetzt werden. Gerade für das oberösterreichische Landesgebiet fehlten<br />
jedoch die dafür notwendigen Grundlagendaten über die Verbreitung und Bestandsgrößen für<br />
diese in Österreich stark gefährdete Fischart (WOLFRAM & MIKSCHI 2007). Die im Rahmen der<br />
vorliegenden Studie durchgeführten Untersuchungen stellen hier im Landesgebiet erstmalig<br />
systematische Erhebungen zum Abbau dieses Defizites dar. Es konnten mehrere<br />
Strömerbestände in Oberösterreich nachgewiesen werden, allerdings waren diese auf das<br />
Ennssystem beschränkt. Im Vergleich zur historischen Verbreitung in Oberösterreich ergibt dies<br />
mit dem Verschwinden aus mehreren Flussgebieten, wie z.B. Salzach, Unterer Inn und Traun<br />
einen dramatischen Rückgang des Verbreitungsareals. Dieser Arealrückgang ergibt sich in<br />
erster Linie aus dem Verlust geeigneter Habitate infolge flussbaulicher Maßnahmen (WOLFRAM &<br />
MIKSCHI 2007, ZAUNER & RATSCHAN 2007), wie Kontinuumsunterbrechungen,<br />
Gewässerregulierungen, Ausleitungen und Stauhaltungen. Darin bestehen die wesentlichen<br />
Defizite im Hinblick auf die Bestandsentwicklung des Strömers in OÖ.<br />
Mögliche Maßnahmen zur positiven Beeinflussung der Bestandsentwicklung werden im Folgenden<br />
von lokalen zu regionalen Skalen beschrieben bzw. auch in einer Prioritätenreihung.<br />
Vorrangig sollten die Zubringer der Enns im Hinblick auf Durchgängigkeit und Struktur verbessert<br />
werden. Als wichtigstes Beispiel wäre die Entfernung oder zumindest die Herstellung der<br />
Passierbarkeit des Schrabachwehrs hervorzuheben. Dieses Wehr schneidet derzeit die<br />
Reichraming von der Enns ab. Bei Herstellung der Passierbarkeit würden viele Kilometer<br />
hochwertiger Lebensraum und hochwertige Laichplätze (Reichraming; Großer Bach im<br />
Nationalpark Kalkalpen) erschlossen, auch für weitere, mittelstreckenwandernde Fischarten wie<br />
Nase und Huchen.<br />
21
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Einige, derzeit bestehende, massive Verbauungen zum Schutz kleiner Uferbereiche wären zu<br />
überdenken (Beispiel siehe Abb. 7).<br />
Abb. 7: Frische, massiv ausgeführte und teure Uferverbauungen am Stiedelsbach mit aus<br />
schutzwasserwirtschaftlicher Sicht fragwürdiger Notwendigkeit, die die Habitat- und Laichplatzqualität für<br />
Strömer und andere Arten verringern.<br />
Im Zuge der Herstellung der Durchgängigkeit der Enns-Staukette (und anderer historischer<br />
Strömer-Gewässer) im Rahmen der Umsetzung der EU-WRRL wäre zum Schutz der FFH-Art<br />
Strömer entscheidend, dass dies in Form möglichst naturnaher, dynamischer Umgehungsarme<br />
geschieht (und - nach Maßgabe der Rahmenbedingungen - nicht in Form von technischen<br />
Gerinnen), sodass Laich- und Lebensräume auch in Stauketten hergestellt bzw. verbessert werden<br />
können.<br />
Für die Steyr, dem wichtigsten Zufluss im Ennssystem, wäre eine Wiederansiedlung des Strömers<br />
anzudenken. Hier wäre im Detail abzuklären, ob eine natürliche Wiederbesiedelung durch<br />
Herstellung der Passierbarkeit aus der Enns im Zuge der Umsetzung der EU-WRRL in absehbarer<br />
Zeit umsetzbar wäre. Alternativ wäre eine Unterstützung der Wiederansiedlung durch<br />
Besatzmaßnahmen nach BLOHM et al. (1994) zu diskutieren.<br />
Vorrangig werden auch Maßnahmen für das Traunsystem vorgeschlagen und hier insbesondere<br />
für die Vöckla und die Traun im Bereich des sog. Almspitz, dem Mündungsbereich der Alm. Hier<br />
scheinen aktuell noch Lebensraumbedingungen für den Strömer gegeben, historische Vorkommen<br />
sind belegt, aber gleichzeitig ist eine natürliche Wiederbesiedelung über Fischaufstiegshilfen aus<br />
dem Enns-Donau-System extrem unwahrscheinlich, weil diese stromauf über die Stauräume der<br />
Donau und unteren Traun (ohne geeignete Trittsteinbiotope) erfolgen müsste.<br />
Zuerst sollte vereinzelten Hinweisen (mündliche Mitteilungen von Fischern 2008) auf Vorkommen<br />
in der Traun nachgegangen werden um eventuell vorhandene Restbestände einer lokalen<br />
Population zu entdecken. Dabei muss aber festgehalten werden, dass die Erfolgsaussichten aus<br />
heutiger Sicht sehr niedrig eingeschätzt werden, weil gerade in den letzten Jahren in der Traun<br />
sehr umfangreiche Erhebungen durchgeführt wurden, die keine Strömer-Nachweise mit sich<br />
brachten. Trotzdem wären solche Fische nach BLOHM et al. (1994) die erste Wahl für eine<br />
22
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
eventuelle Wiederansiedlung im Traunsystem und erst in zweiter Linie sollten Fische aus dem<br />
Ennssystem Verwendung finden.<br />
Eine Wiederansiedelung der Art in der Salzach bzw. im Unteren Inn wäre nur nach massiver<br />
morphologischer Aufwertung und Bewahrung bzw. Entwicklung eines Fließgewässercharakters<br />
dieser Gewässer Erfolg versprechend. Daher sollten mögliche Maßnahmen in dieser Richtung<br />
vorerst nachranging bzw. nur langfristig verfolgt werden.<br />
5.2 Neunaugen (Eudontomyzon mariae / Lampetra planeri)<br />
5.2.1 Allgemeines<br />
Merkmale und Taxonomie: Aalförmiger Körper bis etwa 23 cm Länge (Lampetra planeri: 19 cm);<br />
größter Durchmesser am Vorderende; im Larvenstadium (sog. Querder oder Ammocoeten) ohne<br />
Mundscheibe; kieferloses Saugmaul mit artspezifischer Bezahnung und Auge nur bei Adulten;;<br />
sieben Paar Kiemenöffnungen hinter dem Auge; schuppenlose, schleimige Haut; strahlenloser<br />
Flossensaum; Färbung hellbraun bis dunkel, Bauchseite heller, bei Adulten silberglänzend.<br />
Nach derzeitigem Kenntnisstand kommen in Österreich zwei Neunaugenarten vor: Das<br />
Bachneunauge (Lampetra planeri) und das Ukrainische Bachneunauge (Eudontomyzon mariae).<br />
Die Unterscheidung von E. mariae, insbesondere der Larven, von anderen Arten der Gattung<br />
Eudontomyzon und L. planeri ist schwierig. Meristisch-taxonomische Merkmale sind zum Teil von<br />
großer Variabilität und überlappen. Die Bestimmung erfolgt primär aufgrund von Merkmalen der<br />
Mundscheibe der Adulten. Auch die Zahl von Rumpfmyomeren oder die Größe von Querdern und<br />
Adulten (E. mariae ist großwüchsiger) liefert Hinweise auf die Artzugehörigkeit. Dabei ist zu<br />
berücksichtigen, dass sich Körpergröße und –proportionen auch nach der Umwandlung<br />
(Metamorphose) von der Larve zum adulten Neunauge noch ändern können (KRAPPE, 2008).<br />
Zunehmend werden auch biochemische (Enzym-Elektrophorese) und molekulargenetische<br />
Methoden zur taxonomischen Aufklärung bei Neunaugen verwendet. Die Möglichkeit der<br />
Ausbildung von Hybriden zwischen L. planeri und Eudontomyzon sowie der laufenden Bildung<br />
nicht-parasitischer, nicht anadromer Lampetra-Populationen aus dem Flussneunauge (Lampetra<br />
fluviatilis) ist in Diskussion (HOLCÍK 1995).<br />
Eine umfangreiche Revision von Neunaugen des „E. mariae complex“ (vor allem aus der Mittleren<br />
und Unteren Donau) durch RENAUD (1982) ergab, dass verschiedene als Arten und Unterarten der<br />
Gattung Eudontomyzon beschriebene Taxa einer einzigen, variablen Art E. mariae zuzuordnen<br />
sind. Unter 17 anderen taxonomischen Einheiten wäre auch E. vladykovi als Synonym von<br />
E. mariae zu bezeichnen. Nach FRIEDL (1995) gehören alle in Kärnten untersuchten Neunaugen<br />
E. mariae an, gemäß KOTTELAT (1997) und KOTTELAT & FREYHOF (2007) kommt hingegen im<br />
Einzugsgebiet der Oberen Donau nur Eudontomyzon vladykovi vor; E. mariae wäre im<br />
Donaueinzugsgebiet auf Zubringer unterhalb des Eisernen Tors beschränkt. Damit verbleiben –<br />
auch angesichts der Funde von E. mariae gem. KOTTELAT & FREYHOF (2007) in Oberösterreich –<br />
Widersprüche, die dringend vertiefender taxonomischer Untersuchungen bedürfen.<br />
Biologie: Da hinsichtlich der Biologie des Ukrainischen Bachneunauges und des Bachneunauges<br />
keine wesentlichen Unterschiede erkennbar sind bzw. spezifisches Wissen über die Biologie von<br />
E. mariae nur in geringem Ausmaß verfügbar ist, wird grundsätzlich auf Angaben über das besser<br />
erforschte L. planeri zurückgegriffen. Sofern spezifische Daten zu Eudontomyzon angeführt<br />
werden, so wird dies extra erwähnt.<br />
23
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 8: Querder aus dem Kenadinger Bach (Pfuda-Zubringer) mit für Eudontomyzon mariae typischer<br />
Marmorierung der Flanken.<br />
Bachneunaugen erreichen ab dem 3. Lebensjahr die Geschlechtsreife (HARDISTY, 1986), in<br />
bayrischen Gewässern tritt diese in einem Alter von 5. bis 7. Jahren ein (BOHL & STROHMEIER,<br />
1992; SALEWSKI, 1991). SCHROLL (1959) berichtet in steirischen Gewässern (Eudontomyzon) von<br />
3-4 Jahren Dauer des Larvenstadiums. Über die maximale Dauer liegen divergierende Ergebnisse<br />
vor, es werden bis zu 8 Jahre angenommen (SCHROLL, 1969; WATERSTRAAT, 1989). Auch das<br />
Wachstum der Querder dürfte in verschiedenen Gewässern sehr unterschiedlich verlaufen.<br />
Bei der Umwandlung von der Larve zum Adulttier im Spätsommer bis Herbst entwickeln sich<br />
Augen und die bezahnte Mundscheibe (Abb. 11), der Verdauungstrakt wird völlig zurückgebildet,<br />
da die Ernährung nach der Metamorphose eingestellt wird. Nach der Metamorphose leben<br />
Neunaugen noch bis zu einem knappen Jahr, ohne Nahrung aufzunehmen.<br />
Die Weibchen sind vor der Laichzeit mit Eiern prall gefüllt. Als Eizahl wird 500 bis 2000 pro<br />
Weibchen angegeben (BOHL & STROHMEIER, 1992; MAITLAND, 1980). Die Männchen entwickeln<br />
eine wenige Millimeter lange Geschlechtspapille. Zum Ausgleich der Abdrift der Larven und<br />
Aufsuchen geeigneter Laichplätze vollziehen die Bachneunaugen mehr oder wenig kurze,<br />
stromauf gerichtete Laichmigrationen (MALMQUIST, 1980b), die bei einer Wassertemperatur von 11<br />
- 16 Grad einsetzen. Das Ablaichen erfolgt, abhängig von der Wassertemperatur, in der Regel<br />
zwischen April und Juni. Für das Laichsubstrat wird eine Korngröße von 0,2 bis 20 mm angegeben<br />
(WATERSTRAAT, 1989), BOHL (1995) beobachtete eine ausgeprägte Präferenz für Korngrößen von<br />
10 - 20 mm. Laichtiere heben durch Ansaugen und Abtransport von Kieseln eine Laichgrube mit<br />
etwa 15 bis 20 cm Durchmesser und 5 cm Tiefe aus (BOHL & STROHMEIER, 1992). Der<br />
Laichvorgang erfolgt in Gruppen, wobei das Weibchen vom Männchen umschlungen wird und die<br />
Geschlechtsprodukte portionsweise synchron abgegeben werden. Während des Laichvorgangs<br />
zeigen Neunaugen keinen Fluchtreflex und sind dadurch besonders durch Prädatoren wie<br />
Forellen, Aitel, Hecht, Aalrutte oder Huchen gefährdet. Die Elterntiere sterben wenige Tage bis<br />
Wochen nach dem Ablaichen.<br />
Die Larven schlüpfen nach wenigen Wochen (Entwicklungsdauer etwa 232 bis 321 Tagesgrade)<br />
bei einer Länge von knapp über 3 mm und wechseln vom kiesigen Laichsubstrat in sandige<br />
Bereiche (BOHL & STROHMEIER, 1992). Querder ernähren sich durch Filtrieren, wobei Kieselalgen<br />
(Diatomeen), Protozoen und Detritus im Darm gefunden werden (SCHROLL, 1958 und 1959;<br />
MAITLAND, 1980). Es besteht eine starke Präferenz für Diatomeen, was durch eine selektive<br />
Agglutination von Partikeln im erzeugten Wasserstrom auf den Schleimbändern im Schlund<br />
erreicht wird.<br />
Ökologie: Bachneunaugen kommen im Donausystem von Gewässern der Forellenregion und<br />
alpinen Flüssen, in denen hohe Strömungsgeschwindigkeiten und kiesiges Substrat vorherrschen,<br />
bis in den Tieflandbereich vor. Von Lampetra wird in Süddeutschland über Vorkommen mit einer<br />
Obergrenze von etwa 700 bis 900 m Seehöhe berichtet, von Eudontomyzon ist in Österreich als<br />
Extremfall eine über 1100 m vorkommende Population bekannt (LONKA; ZAUNER et al. 2006). Nach<br />
HOLCIK (1986) bevorzugt E. mariae Gewässer über 250 m Seehöhe mit einem Gefälle von 1,7 bis<br />
16 ‰.<br />
24
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Für Österreich wird ein ausgeprägter Verbreitungsschwerpunkt von Lampetra im Meta- und<br />
Hyporhithral angegeben (Fischregionsindex 4,5; SCHMUTZ et al. 2000). Aus der Schweiz, Bayern<br />
und Baden-Württemberg wird hingegen eine Präferenz von Lampetra für quellnahe Oberläufe<br />
berichtet (BOHL, 1995; KIRCHHOFER, 1995; KAPPUS & RAHMANN, 1995). Hier wird ein gewisser<br />
Widerspruch deutlich, der möglicherweise durch die jeweilige geologische Situation und<br />
entsprechende Sedimentverhältnisse zustande kommt.<br />
Hingegen wird das Auftreten von Eudontomyzon in Österreich vom Metarhithral bis ins Epipotamal<br />
eingestuft (Fischregionsindex 5,1; SCHMUTZ et al. 2000). Damit wurde berücksichtigt, dass<br />
Vorkommen auch in großen, alpin geprägten Flüssen und sommerwarmen kleineren<br />
Fließgewässern mit potamaler Begleitfauna bekannt sind. Ob die unterschiedlichen<br />
Verbreitungsschwerpunkte der beiden Arten auf eine tatsächlich breitere ökologische Valenz von<br />
Eudontomyzon im Vergleich zu Lampetra zurück zu führen, oder eher ein Ergebnis der<br />
überregionalen, biogeographischen Verbreitung sind, bleibt dabei ungeklärt. Im europäischen<br />
Überblick erkennen KAPPUS & RAHMANN (1995) jedenfalls zwischen E. mariae und L. planeri<br />
Gewässern „zumindest makroskopisch keine wesentlichen Unterschiede“.<br />
Essentiell für die Besiedlung von Gewässern durch Bachneunaugen ist die Ausstattung mit<br />
geeigneten Habitaten für die verschiedenen Lebensstadien und Jahreszeiten. Nur in<br />
morphologisch reich strukturierten Gewässern bilden sich heterogene Tiefen- und<br />
Strömungsmuster aus, die aufgrund der wechselnden Schleppkraft unterschiedliche<br />
Sedimentfraktionen in kleinräumiger und wechselnder Verteilung ablegen. Als Laichsubstrat<br />
werden kiesige Fraktionen um 1 cm Korngröße bevorzugt. Im Gegensatz dazu werden als<br />
Wohnsubstrat der Querder und Adulten sandige bis schluffige Fraktionen angegeben. Querder<br />
können besonders an Standorten gefunden werden, wo derartige Sedimente mit organischem<br />
Material durchsetzt sind. Sie sitzen überwiegend in Tiefen von 10 bis 30 cm, im Winter deutlich<br />
tiefer (BOHL, 1995). SCHROLL (1958) berichtet von einer ausgeprägten Präferenz für beschattete<br />
Mikrohabitate. Querder bevorzugen eine gekrümmte bis U-förmige Stellung, nicht immer sind aber<br />
Kopf und Schwanz der Oberfläche zugekehrt. Eine Verbindung zur Sedimentoberfläche<br />
(„Atemröhre“) kann im Freiland nur bei schwacher Strömung beobachtet werden. Es wird<br />
angenommen, dass adulte Neunaugen von der Metamorphose bis zum Beginn der Laichperiode<br />
unter Steinen leben (SCHROLL, 1959). Im Aquarium kann jedenfalls beobachtet werden, dass sich<br />
Adulte nicht eingraben.<br />
Über die Populationsökologie von Bachneunaugen bestehen noch große Wissensdefizite. Für<br />
Lampetra wird eine Eizahl von 520 bis 2000 (HARDISTY, 1964; BOHL & STROHMEIER, 1992)<br />
angegeben. Das Geschlechterverhältnis Männchen zu Weibchen in den Laichgruppen liegt in einer<br />
untersuchten Population bei etwa 2:1 (SALEWSKI, 1991). Eine hohe Mortalität wird vor allem für<br />
frühe Stadien angenommen, etwa durch geringen Ei-Schlüpferfolg und hohe Verluste während der<br />
larvalen Phase. Kritische Perioden dürften auch der Wechsel der Larven von den Laichgruben zu<br />
den sandigen Wohnstätten sowie die Metamorphose sein (MAITLAND, 1980). Aufgrund der<br />
Längenverteilung der Querder schätzt WATERSTRAAT (1989) nach dem ersten Lebensjahr die<br />
jährliche Mortalität mit 30 - 40 %. Durch wechselnden Einfluss physikalischer Faktoren wurden<br />
stark schwankende Jahrgänge beobachtet (HARDISTY, 1961). Wiederholt wird auch auf eine hohe<br />
Mortalität durch Prädation während des auffälligen Laichaktes der Bachneunaugen hingewiesen<br />
(z.B. BOHL & STROHMEIER, 1992).<br />
Informationen über Dichten und Bestandsgrößen von Neunaugenpopulationen sind aufgrund<br />
methodischer Schwierigkeiten bei der Erfassung selten und schwer vergleichbar. WATERSTRAAT<br />
(1989) gibt bei L. planeri für einen norddeutschen Niederungsbach eine geschätzte<br />
Populationsgröße von ca. 9300 Querdern und 500 Adulten an, wobei im Längsverlauf<br />
unterschiedliche Dichten bis maximal etwa 7 Querder pro Meter Bachlänge festgestellt wurden.<br />
Hohe Bestandsdichten von 3 – 13 Ind. pro m 2 fand MALMQUIST (1983) in Schweden. In naturnahen<br />
Gewässern wurden Laichgesellschaften von Eudontomyzon mit etwa 50 bis 100 Individuen<br />
beobachtet (LEVIN & HOLCIK, 2006).<br />
25
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5.2.2 Historische Verbreitung<br />
Hinweise in der historischen Literatur sind aufgrund der unauffälligen Lebensweise und geringen<br />
wirtschaftlichen Bedeutung eher selten. Wertvolle Hinweise auf die ursprüngliche Verbreitung<br />
liefern auch jüngere Arbeiten, v. a. SCHROLL (1969), die mittlerweile aufgrund der geschrumpften<br />
Verbreitung von Neunaugen als historisch zu gelten haben.<br />
Aufgrund der historisch und auch aktuell noch recht unklaren Taxonomie wird in der Folge in der<br />
Regel nur auf Neunaugen ohne Gattungs- bzw. Artbezug eingegangen, d. h. ohne die Zuordnung<br />
zu unterschiedlichen Taxa in der Originalliteratur zu erwähnen. Diese ist ohnehin nicht auf den<br />
heutigen Kenntnisstand übertragbar.<br />
Bereits HÖFER (1815) erwähnt, dass Neunaugen (dort: Aal, äälein) 7 Kiemenöffnungen haben und<br />
in der Donau, Traun und anderen Flüssen anzutreffen sind. Am Fischmarkt in Linz wären in den<br />
Monaten Juni und Juli häufig Neunaugen feilgeboten worden, die bei Niederwasser mit Schaufeln<br />
aus dem „koth“ herausgegraben wurden. Bei FITZINGER (1832) werden Querder (Ammocoetes<br />
branchialis) und adulte Neunaugen (z. B. Petromyzon planeri oder fluviatilis) noch als<br />
unterschiedliche Arten beschrieben. Neunaugen werden als selten eingestuft, Querder hingegen in<br />
„Flüssen im lehmigen und sandigen Grunde. In der Donau, Leitha, Fischa, Traun. Ziemlich häufig“.<br />
Einen weiteren Hinweis für das „Trauntal“ findet man bei ARGUS (1910). KRAFFT (1874) weist<br />
darauf hin, dass Neunaugen („Lampreten“) selten in der Donau und Krems (OÖ) vorkommen, aus<br />
dem Schlamm mit Schaufeln ausgegraben werden, und nur zum Ködern dienten.<br />
KUKULA (1874) erwähnt oberösterreichische Vorkommen von „Petromyzon fluviatilis … in der<br />
Donau und deren sumpfigen Seitenarmen, in der Traun und Enns“. Weitere Hinweise aus der<br />
Enns liegen von ARGUS (1910) sowie aus dem steirischen Landesgebiet im Bereich Admont bzw.<br />
dem Zubringer Palten vor. Dort werden in den Aufzeichnungen des Stiftes Admont Neunaugen<br />
angeführt (HAIDVOGL & WAIDBACHER, 1997). Auch SCHROLL (1969) nennt Admont und Liezen als<br />
Fundpunkte. Besonders interessant ist bei letzterer Arbeit, dass Neunaugen auch in der Steyr bei<br />
Pichlern, Grünburg und Frauenstein gefunden wurden.<br />
Für den Tiroler Inn gibt es einen historischen Hinweis, für den Tiroler und Bayerischen Inn auch<br />
wenige aktuellere Funde (HELLER, 1871; SCHROLL, 1969; KAPPUS et al. 1995; SPINDLER et al.,<br />
2002). Ein wahrscheinlich fälschlich als Lampetra planeri determiniertes Belegexemplar aus dem<br />
Tiroler Inn bei Langkampfen liegt am Naturhistorischen Museum in Wien (gesammelt 1989). Dass<br />
Neunaugen auch bis in den Unteren Inn an der bayerisch-oberösterreichischen Grenze heimisch<br />
waren, zeigen neben dem Hinweis von SCHNEEWEIS (1979) auch aktuellere Funde (TEROFAL,<br />
1977; STEINHÖRSTER, 2000; SCHOTZKO & JAGSCH, 2007). SCHROLL (1969) listet Funde im<br />
oberösterreichischen Inn bei Braunau, Schärding und Wernstein. Eine interessante Meldung aus<br />
dem Inn-Einzugsgebiet weist auf einen Neunaugenfund im Rainbach-Unterlauf (Zubringer der<br />
Pram) hin. Diese Population dürfte in den 1960er Jahren ausgestorben sein (GRIMS, schriftl.<br />
Mittlg.).<br />
KOLLMANN (1898) nennt das Neunauge für den Salzburger Flachgau; für die Salzburger Salzach<br />
und Zubringer gibt es Hinweise von AIGNER & ZETTER (1859), ARGUS (1910) und FREUDLSPERGER<br />
(1936). Basierend auf diesen Nachweisen und Funden im Unteren Inn kann ein historisches<br />
Vorkommen auch im Bereich der oberösterreichischen Salzach als sehr wahrscheinlich<br />
angenommen werden (vgl. SCHMALL, 2008)<br />
Aus diversen Fließgewässern im Mühlviertel wären bei intensiver Recherche möglicherweise eine<br />
Reihe historischer Beschreibungen von Neunaugenvorkommen auszuheben. Als konkreter<br />
historischer Hinweis liegt die Arbeit von KERSCHNER (1928) vor. Weitere Recherchen wurden nicht<br />
durchgeführt, da sie aufgrund der auch aktuell noch verbreiteten Bestände wenig Wissensgewinn<br />
erhoffen ließen.<br />
Zusammenfassend ist davon auszugehen, dass Neunaugen beim Vorliegen geeigneter<br />
Sedimentverhältnisse fast oberösterreichweit in Fließgewässern vom Metarhithral bis zum<br />
Epipotamal vorgekommen sind und zumindest lokal häufig gewesen sein dürften. Vor der<br />
26
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
vollständigen Regulierung der großen und mittelgroßen oberösterreichischen Flüsse waren für<br />
Neunaugen lebensnotwendige Habitate in deutlich mehr Gewässerstrecken verfügbar, als dies in<br />
den regulierten und über weite Strecken gestauten Flüssen der heutigen Zeit der Fall ist.<br />
Historische Quellen dokumentieren Petromyzontiden jedenfalls für Salzach, Inn, Donau, Traun,<br />
Krems, Steyr, Enns und Zubringer sowie für das Mühlviertel.<br />
5.2.3 Aktuelle Verbreitung<br />
Bisher wurde in Bezug auf die Artzugehörigkeit österreichischer Neunaugen angesichts der<br />
diagnostischen und taxonomischen Probleme ein pragmatischer Weg beschritten, sofern keine<br />
bestimmbaren Adulttiere verfügbar waren bzw. untersucht wurden: Funde südlich der Donau<br />
wurden Eudontomyzon mariae zugeordnet, während Funde im Wald- und Mühlviertel bzw. in der<br />
Böhmischen Masse zu Lampetra planeri gestellt wurden (vgl. ZAUNER & RATSCHAN, 2005;<br />
WOLFRAM & MIKSCHI, 2007).<br />
Zum gegebenen Zeitpunkt ist eine etwas differenziertere Herangehensweise möglich. Im Zuge der<br />
Erhebungen für das Kleinfischprojekt und weiterer Untersuchungen konnten neue Neunaugen-<br />
Populationen gefunden und teils eindeutig zumindest auf Gattungsniveau bestimmt werden. Nach<br />
Maßgabe des aktuellen Wissenstandes konnten auch einige der älteren Funde den beiden Taxa<br />
zugeordnet werden.<br />
Zum Zeitpunkt vor Projektbeginn waren in Oberösterreich vor allem im Mühlviertel aus den<br />
Einzugsgebieten von Mühl, Rodl, Aist, Gusen, Maltsch und dem nördlichen Machland<br />
Neunaugenfunde bekannt (ZAUNER & RATSCHAN, 2005; GUMPINGER et al. 2005). Südlich der<br />
Donau gab es nur wenige Funde, beispielsweise aus der Vöckla (UIBLEIN et al. 1996) und dem<br />
Sandbach (SILIGATO & GUMPINGER, 2004). Aus der Donau lagen einzelne Funde vor, die primär<br />
durch Abdrift aus Zuflüssen erklärt wurden (ZAUNER, 2002; ZAUNER et al. 2007).<br />
Nach Durchführung der Kleinfisch-Erhebungen hat sich das Bild über die Faunistik der Neunaugen<br />
in Oberösterreich deutlich verdichtet. Dabei wurden bewusst die nicht allzu seltenen<br />
Neunaugenvorkommen im Mühlviertel, die zum damaligen Stand des Wissen pauschal Lampetra<br />
planeri zugeordnet wurden, nicht weiter im Freiland bearbeitet. Dies mit dem Ziel, den<br />
Bearbeitungsaufwand auf die in Bezug auf Wissensdefizite und naturschutzrelevante<br />
Fragestellungen wichtigeren Vorkommen südlich der Donau zu konzentrieren (Abb. 10).<br />
Das einzige schon bekannte Neunaugen-Vorkommen im Traun-System aus der Vöckla, das<br />
damals fälschlich als Lampetra planeri bestimmt wurde (UIBLEIN et al. 1996), konnte 2008 wieder<br />
bestätigt werden. Auch im Jahr 1996 wurden die Neunaugen in der Vöckla nahe der Mündung des<br />
Fornacher Redlbaches gefangen. Ebenfalls im Mündungsbereich, aber im Fornacher Redlbach<br />
selbst, wurden 2008 auf einer Sedimentbank 31 Neunaugen gefunden, davon 4 als Eudontomyzon<br />
mariae bestimmbare Adulte. Auch anhand der Marmorierung der Querder und deren Länge<br />
(Querder bis 215 mm, Adulte bis 200 mm) bestätigte sich diese Determinierung. Etwa 2,5 km<br />
stromauf der Mündung wurden 6 Querder und ein Adulter gefunden – dieser Fundpunkt liegt im<br />
Natura 2000 Gebiet „Wiesengebiete und Seen im Alpenvorland, AT 3123000“ (Abb. 9).<br />
27
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 9: Neunaugen-Standorte im Fornacher Redlbach nahe der Mündung (links) und ca. 2,5 km stromauf (rechts).<br />
Noch weiter stromauf, etwa auf Höhe der Ortschaft Seppenröth, fehlten Neunaugen. In diesem<br />
Bereich lag jedoch auch das geeignete, feinsandige bis schluffige Sohlsubstrat nur mehr in sehr<br />
geringem Ausmaß vor. Im Frankenburger Redlbach wurden keine Neunaugen gefunden, hier<br />
bestehen Hinweise auf Fischsterben in der Vergangenheit.<br />
Neu sind Neunaugenfunde im Sipbach, der ca. bei Fluss-km 12 rechtsufrig in die Traun mündet<br />
(BART & GUMPINGER, 2009). Hier konnten im Unterlauf ebenfalls auf Basis der Größe als<br />
Eudontomyzon zu bestimmende Neunaugen entdeckt werden.<br />
Im Pfuda-System, einem Zubringer der Pram und in weiterer Folge des Inn, konnte eine sehr gute<br />
Neunaugenpopulation entdeckt werden, die bisher nicht bekannt war. Das Gewässer war aufgrund<br />
von vagen Hinweisen eines Fischereiberechtigten als Zielgebiet ausgewählt worden. Bereits erste<br />
sondierende Erhebungen durch den Auftraggeber (schriftl. Mittlg. GUTTMANN / HEHENWARTER)<br />
hatten im Hackinger Bach im Juli 2007 zwei Querderfunde geliefert. Bei den folgenden detaillierten<br />
Erhebungen konnten in der Pfuda selbst in den Bereichen Bereich Angsüß und Kindling insgesamt<br />
72 Neunaugen nachgewiesen werden. Stromauf bei der Mündung des Aubaches sowie stromab<br />
bei Kalling konnten keine Funde verzeichnet werden, sodass der Pfuda-Mittellauf etwa zwischen<br />
Mitterndorf und Sigharting als Verbreitungsschwerpunkt anzunehmen ist.<br />
Darüber hinaus gelangen Nachweise in den angrenzenden Pfuda-Zubringern Auinger Bach (18<br />
Individuen), Kenadinger Bach (Mündungsstrecke, 49 Individuen) und Hackinger Bach (Angsüß und<br />
Heizing; 16 Individuen). Besonders erfreulich ist, dass auch 4 adulte Individuen zum Vorschein<br />
kamen, die anhand der Saugscheibe eindeutig der Gattung Eudontomyzon zugeordnet werden<br />
können (Abb. 11). Bemerkenswert ist die Größe der Neunaugen der Pfuda-Population, die bis zu<br />
225 mm (Querder) bzw. 205 mm (Adulte) messen.<br />
In sämtlichen anderen, nahe gelegenen Fließgewässern im Bezirk Schärding, wie beispielsweise<br />
Rainbach, Diersbach, Doblbach, Großer und Kleiner Kößlbach, Pram etc. wurden keine<br />
Neunaugen gefunden, obwohl teilweise geeignetes Sohlsubstrat vorliegt.<br />
Im Inn konnten im Zug der Gewässerzustandserhebung bei Braunau 2 Querder gefangen werden,<br />
die von SCHOTZKO & JAGSCH (2007) aufgrund ihrer Marmorierung als Eudontomyzon bestimmt<br />
werden. Dieser Fund liegt knapp stromauf des Natura 2000 Gebiets „Unterer Inn“. Ebenfalls im<br />
Stau Ering (km 57,0) konnte bereits STEINHÖRSTER (2000) einen einzelnen Querder nachweisen.<br />
Auch kurz vor der Mündung in die Donau im Unterwasser des Kraftwerkes Ingling bei Passau<br />
wurden auf bayerischer Seite Neunaugen gefunden (OTT, mündl. Mittlg. 2008).<br />
Aus dem Aschach-System wurden Neunaugen erstmals im Sandbach nachgewiesen (SILIGATO &<br />
GUMPINGER, 2004), die zu diesem Zeitpunkt noch als Lampetra planeri bestimmt wurden. Aufgrund<br />
28
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
der ausgesprochen großen Maximallänge der Querder (bis 210 mm) und deren Färbung ist dieser<br />
Fund zum derzeitigen Kenntnisstand wahrscheinlich Eudontomyzon zuzuordnen.<br />
Aus der oberösterreichischen Enns waren im Vorfeld Hinweise auf Neunaugen bekannt geworden,<br />
die in abgesenkten Stauen der Enns-Staukette massenhaft zum Vorschein kamen (HEHENWARTER,<br />
mündl. Mittlg.). Auch aus der stromauf angrenzenden steirischen Enns samt Zubringern liegen<br />
Neunaugenfunde vor (JUNGWIRTH et al. 1996; Life Projekt Gesäuse: WIESNER, mündl. Mittlg.). Im<br />
Zuge der Kleinfisch-Erhebungen in den Stauräumen Großraming und Losenstein gelang aber kein<br />
Nachweis, wofür vor allem die methodische Schwierigkeit verantwortlich sein dürfte,<br />
möglicherweise in größerer Wassertiefe im Stau befindliche Neunauge zu fangen. Allerdings<br />
wurde auch von lokalen Fischereiberechtigten von vereinzelt gesichteten Neunaugen berichtet.<br />
Im Enns-Unterlauf zwischen dem Kraftwerk Garsten und der Ausleitung bei Thaling konnten<br />
aktuelle Erhebungen keine Neunaugen belegen, auch hier ist jedoch ein glaubhafter Hinweis eines<br />
Fischereiberechtigten interessant, der laichende Neunaugen im Bereich hinter dem Leitwerk der<br />
Steyr im Stadtgebiet (km 30,3) beobachten konnte. Ein Einzelnachweis in der oberösterreichischen<br />
Enns gelang lediglich im Herbst 2008 kurz vor der Mündung in die Donau im Ennshafen, wo ein<br />
210 mm langer Querder nachgewiesen wurde (BERG et al, 2009.). Aufgrund der gehäuften<br />
Hinweise ist mit hoher Wahrscheinlichkeit davon auszugehen, dass die oberösterreichische Enns<br />
von Neunaugen der Gattung Eudontomyzon besiedelt ist.<br />
Nachweise von Neunaugen in der Donau sind ausgesprochen selten, obwohl sie historisch auch<br />
aus der Donau bekannt und belegt sind. So liegen in der Fischsammlung des Naturhistorischen<br />
Museums in Wien aus den Jahren 1846 bis 1906 über 50 Belegexemplare, die aus dem Bereich<br />
Prater / Stadlau / Krieau stammen und damals noch der Art Eudontomyzon danfordi (nach<br />
heutigem Stand wahrscheinlich E. mariae) zugeordnet wurden. In jüngerer Zeit wurde ein<br />
Querdernachweis für die Donau erstmals 2002 aus dem Winterhafen bei Linz bekannt (ZAUNER,<br />
2002; 194 mm), sowie ein weiterer bei Ottensheim (ZAUNER et al. 2007, 140 mm). Im Altarm<br />
Grimsing in der Wachau (Niederösterreich) konnten ebenfalls 2 Querder mit Längen von 180 und<br />
190 mm gefunden werden (ZAUNER et al. 2008). Im Stauraum Jochenstein bei Obernzell werden<br />
2008 auf einer Sedimentbank auf der bayerischen Seite Neunaugen gefangen (OTT, mündl.<br />
Mittlg.).<br />
In einem Zubringer zur Naarn im Machland, dem Mettensdorfer Mühlgang, wurden bereits im<br />
Jahr 2005 Neunaugen gefangen (GUMPINGER et al. 2005), 2 Querder (168, 170 mm) und 2 Adulte<br />
(182, 190 mm). Aufgrund der großen Längen (Tab. 3, Abb. 12) können diese mit hoher<br />
Wahrscheinlichkeit als Eudontomyzon bestimmt werden und wären damit der erste Nachweis der<br />
Art im Mühlviertel (siehe Diskussion).<br />
29
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 10: Neunaugen-Nachweise in Oberösterreich; Böhmische Masse (Granit- und Gneisgebiet) in blau.<br />
Im benachbarten Salzburg sind Neunaugen im Salzach-Einzugsgebiet verschollen bzw.<br />
höchstwahrscheinlich ausgestorben - Neunaugen gibt es nur mehr im Mur-Einzugsgebiet im<br />
Lungau (ZAUNER et al. 2006). In Niederösterreich sind Neunaugenbestände aus dem<br />
Lainsitzgebiet und dem Kleinen Kamp bekannt (höchstwahrscheinlich Lampetra planeri; SCHLOTT<br />
& SCHLOTT-IDL, 1991; HINTERHOFER et al. 2007), darüber hinaus gibt es seltene Funde in der<br />
Wachau (Altarm Grimsing, ZAUNER et al. 2008), der Lobau (SCHROLL, 1969) und an der<br />
slowakischen Grenze in einem Zufluss der March (SPINDLER et al. 1992). In der Ybbs wurden<br />
Neunaugen für Rosenau, Waidhofen, Opponitz und Hollenstein angeführt (SCHROLL, 1969), dieser<br />
Bestand dürfte jedoch mit hoher Wahrscheinlichkeit ausgestorben sein. In der Obersteiermark<br />
kommen Neunaugen nach wie vor in der Enns und den Unterläufen diverser Zubringer im Ennstal<br />
vor (z.B. Gulling, Palten). In Südösterreich (Steiermark, Burgenland, Kärnten) sind Neunaugen in<br />
den Einzugsgebieten von Raab (mit Lafnitz, Strem, Pinka und Rabnitz), Mur und Drau (mit Gail)<br />
lokal nicht selten; in Tirol gibt es einzelne aktuelle Nachweise aus dem Inn (MARK, mündl. Mittlg.<br />
2008), aus Vorarlberg sind keine historischen oder rezenten Vorkommen bekannt.<br />
In Bayern ist das Ukrainische Bachneunauge sehr selten, Lampetra aber im Bayerischen Wald<br />
und im Maingebiet deutlich häufiger. Der westlichste Fund von Eudontomyzon gelang bei Paar bei<br />
Aichach, weitere Funde gibt es aus dem Inn bei Wasserburg und in der Großen Ohe nordöstlich<br />
von Passau (KAPPUS & RAHMANN, 1995). Weitere aktuelle Neunaugenfunde liegen aus dem Inn bei<br />
Ingling und im Donau-Stauraum Jochenstein bei Obernzell vor. Generell sind Neunaugen, v. a.<br />
Lampetra planeri, im nördlichen Bayern weit häufiger als im grenznahen südbayerischen Raum<br />
(BOHL, 1995).<br />
30
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5.2.4 Diskussion<br />
Die zwei derzeit für Österreich geführten Petromyzontiden – das Bachneunauge (Lampetra<br />
planeri) und das Ukrainische Bachneunauge (Eudontomyzon mariae) – sind beide im Anhang II<br />
der FFH-Richtlinie geführt. Dies verpflichtet Österreich, Schutzgebiete für diese Arten<br />
auszuweisen, die Entwicklung der Bestände zu beobachten und gegebenenfalls Maßnahmen mit<br />
dem Ziel eines günstigen Erhaltungszustands zu ergreifen. Die Umsetzung der FFH-Richtlinie wird<br />
in diesem Zusammenhang stark erschwert, weil das Wissen über beiden Arten in Bezug auf<br />
entscheidende Aspekte wie Verbreitung und Artzugehörigkeit massive Defizite aufweist.<br />
Oberösterreich war bisher das Bundesland mit den wesentlichsten Wissenslücken, weil hier beide<br />
Schutzgüter vorkommen, jedoch kaum grundlegende Untersuchungen zur Abgrenzung der<br />
Verbreitungsgebiete und Bestandssituation beider Arten durchgeführt wurden.<br />
Zum gegebenen Zeitpunkt hat sich das Wissen über die Faunistik und Ökologie von Neunaugen in<br />
Oberösterreich wesentlich verbessert, sodass wichtige Grundlagen für ein sinnvolles Management<br />
dieser Schutzgüter geschaffen wurden. Daher wird in diesem Kapitel besonders auch der Aspekt<br />
Taxonomie und Biogeographie diskutiert.<br />
Das brauchbarste Merkmal zur Artbestimmung von Neunaugen stellt die Saugscheibe dar, die nur<br />
bei eher schwer nachweisbaren, adulten Tieren ausgebildet ist. Charakteristisch für Eudontomyzon<br />
ist gegenüber Lampetra, dass mehrere Reihen von exolateralen Zähnen auftreten (Lampetra:<br />
einreihig), die mittleren Endolateralzähne zweigipfelig sind (Lampetra: dreigipfelig) und posteriale<br />
Zähne vorliegen (Lampetra planeri: fehlend oder kaum sichtbar). Die Larven der Neunaugen<br />
(Querder, Ammocoeten) weisen wenig taxonomisch brauchbare, morphologische Merkmale auf<br />
und sind daher nur sehr eingeschränkt bestimmbar. Dies stellt – neben der versteckten<br />
Lebensweise – einen wesentlichen Grund für das im Vergleich mit anderen Wirbeltieren<br />
außerordentlich schlechte Wissen über Neunaugen dar.<br />
Auf Basis der Saugscheiben der untersuchten Adulten aus der Pfuda ist dieser Bestand eindeutig<br />
als Eudontomyzon anzusprechen (Abb. 11). Die Saugscheiben ähneln sehr stark jenen der<br />
Adulten, die im Fornacher Redlbach gefangen wurden. Anhand dieser sicher als Eudontomyzon<br />
bestimmten Individuen können auch äußere Merkmale von Querdern derselben Population als<br />
Bestimmungsmerkmale für oberösterreichische Ammocoeten diskutiert werden, weil sympatrische<br />
Bestände mehrerer nicht parasitärer Neunaugenarten an einem Fundort extrem unwahrscheinlich<br />
bzw. in Mitteleuropa nicht bekannt sind.<br />
1<br />
1<br />
2<br />
3<br />
Abb. 11: Saugscheiben von L. planeri (Aist, links) sowie E. mariae aus dem Redlbach (Mitte) und der Pfuda<br />
(rechts). 1 .. exolaterale Zähne; 2 .. endolaterale Zähne; 3 .. posteriale Zähne<br />
In Hinblick auf die Ammocoeten-Taxonomie ist die auffällige Marmorierung großer Querder (Abb.<br />
8) zu erwähnen, die bei KOTTELAT & FREYHOF (2007) als einzig verfügbares Bestimmungsmerkmal<br />
von Eudontomyzon mariae gegenüber anderen Mitgliedern dieser Gattung angegeben wird und<br />
auch zur Unterscheidung von L. planeri, dessen Querder nicht marmoriert sind, verwendbar ist.<br />
31
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Dabei ist zu berücksichtigen, dass die Marmorierung erst bei großen Querdern, wahrscheinlich im<br />
letzten Jahr vor der Metamorphose, deutlich ausgeprägt ist, sodass das Fehlen bei kleineren<br />
Ammocoeten keinesfalls als diagnostisches Merkmal verwendet werden kann.<br />
Diese Marmorierung tritt bei den Querdern aus dem Pfuda- und Vöcklasystem auf, sowie auch bei<br />
den Sipbach- und Sandbachpopulationen. Die Bestimmung der Pfuda-Neunaugen als<br />
Eudontomyzon mariae gemäß dem aktuellen taxonomischen Wissensstand anhand von Fotos wird<br />
auch von FREYHOF bestätigt (schriftl. Mittlg., 2008).<br />
Tab. 3: Biometrische und morphologische Merkmale von Neunaugenfunden in Oberösterreich – Querder und<br />
Adulte getrennt.<br />
Pfuda + Fornacher<br />
Mettensdorfer<br />
Gewässer<br />
Zubringer Redl Sippbach Sandbach Enns Mühlgang Gr. Mühl Maltsch Aist<br />
Datum Apr.08 Sep.08 Jun.08 Sep.04 Sep.08 Apr.05 Aug.08 Jul.02 Apr.07<br />
Querder Anzahl 152 33 11 17 1 2 54 192 9<br />
Kleinstes Ind. 40 55 20 100 - 168 50 40 55<br />
Mittlere Länge 140 141 106 146 - 169 97 100 98<br />
Größtes Ind. 225 215 190 210 210 170 150 153 145<br />
Marmorierung ja ja ja ja ? ? ? ? ?<br />
Adulte Anzahl 4 5 1 - - 2 33 - 4<br />
Kleinstes Ind. 140 185 200 - - 182 110 - 120<br />
Mittlere Länge 168 192 200 - - 186 129 - 129<br />
Größtes Ind. 205 200 200 - - 190 153 - 140<br />
Saugscheibe E. mariae E. mariae - - - - ? - L. planeri<br />
Vorläufige Determination: E. mariae E. mariae E. mariae E. mariae E. mariae E. mariae L. planeri L. planeri L. planeri<br />
In der Literatur wird eine unterschiedliche Maximalgröße von Querdern und Adulten der beiden<br />
Gattungen angegeben (Tab. 4). Dies bestätigt sich eindrucksvoll anhand der oberösterreichischen<br />
Tiere. Mittlere Längen sind bei Querdern wenig aussagekräftig, weil unterschiedliche Jahrgänge<br />
unterschiedlich stark ausgeprägt bzw. aus methodischen Gründen unterschiedlich gut repräsentiert<br />
sein können. Daher werden zur Diskussion vor allem Maximallängen herangezogen. Diese liegen<br />
bei den anhand der Saugscheibe der Adulten als Eudontomyzon bestimmten Populationen bei 225<br />
mm bzw. 215 mm und damit weit über den Mühlviertler Lampetra-Populationen (145 bis 153 mm<br />
Maximallänge), von denen überaus viele Querder vermessen wurden (Abb. 12). Ähnlich stellt sich<br />
das Längenverhältnis bei den Adulten dar, die im Fall von Eudontomyzon bis 205 mm messen, bei<br />
Lampetra hingegen nur bis 153 mm, bei ebenfalls hohen Grundgesamtheiten bei der Vermessung.<br />
Tab. 4: Größenangaben (Totallänge) nicht parasitischer, europäischer Neunaugen in der Literatur .<br />
Art Querder Adulte Quelle<br />
Lampetra planeri max. 184 mm max. 151 mm MAITLAND (1980)<br />
120 – 175 mm 80 - 160 mm KOTTELAT & FREYHOF (2007)<br />
Eudontomyzon mariae - max. 208 mm RENAUD (1982)<br />
max. 193 mm max. 192 mm FRIEDL (1995)<br />
- 128 - 199,5 mm LEVIN & HOLCIK (2006)<br />
bis ca. 200 mm KOTTELAT & FREYHOF (2007)<br />
Eudontomyzon vladykovi bis ca. 212 mm KOTTELAT & FREYHOF (2007)<br />
32
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
mean + max. TL [mm]<br />
250<br />
200<br />
150<br />
100<br />
50<br />
0<br />
Eudontomyzon sp.<br />
Lampetra planeri<br />
Querder<br />
Adulte<br />
Pfuda Redl Sippb. Sandb. Machland Lonka Kärnten Stmk Gr. Mühl Maltsch Aist<br />
Querder: n = 152 n = 33 n = 11 n = 17 n = 2 n = 26 n = 344 n = 218 n = 54 n = 192 n = 9<br />
Adulte: n = 4 n = 5 n = 1 n = 0 n = 2 n = 0 n = ? n = 0 n = 33 n = 0? n = 4<br />
Abb. 12: Größen von Neunaugen-Querdern (Balken) und Adulten (Punkte). n .. Individuenzahl; ? .. Querder und<br />
Adulte nicht differenziert; Kärnten: div. Kärntner Gewässer. Stmk: div. steirische Gewässer (aus: SCHROLL,<br />
1958).<br />
Auf Basis dieser Ergebnisse können auch Hinweise auf die Artzugehörigkeit von Populationen an<br />
Fundorten gewonnen werden, an denen nur Querder nachgewiesen wurden, wenn genügend hohe<br />
Grundgesamtheiten oder entsprechend große Individuen zur Verfügung stehen.<br />
Die Neunaugen aus dem Sipbach können auf Basis der großen Totallänge mit hoher<br />
Wahrscheinlichkeit Eudontomyzon zugeordnet werden, was auch aufgrund der erkennbaren<br />
Marmorierung möglich ist und angesichts des Vorkommens der Art im Vöckla-System (ebenfalls<br />
Traun-Einzugsgebiet) plausibel erscheint.<br />
Auch die Sandbach-Querder sind auffallend groß, marmoriert und damit mit hoher Sicherheit als<br />
Ukrainische Bachneunaugen zu bestimmen. Wie im Fall der Pfuda können damit als Novum auch<br />
im österreichischen Gebiet der Böhmischen Masse (die im Sauwald und dessen östlichen<br />
Ausläufern auch südlich der Donau aufragt) Ukrainische Bachneunaugen nachgewiesen werden.<br />
Die Größenverteilungen der in Abb. 12 dargestellten Mühlviertler Neunaugen sind sehr einheitlich<br />
und weit kleiner – Querder und Adulte werden kaum größer als 150 mm. Die einzige Ausnahme<br />
sind jene aus dem Mettensdorfer Mühlgang aus dem Jahr 2005, wo der größere der je zwei<br />
Adulten 190 mm misst und der größere Querder 170 mm. Eine allfällige Marmorierung der Querder<br />
aus dem Mettensdorfer Mühlgang ist auf Basis der verfügbaren Bilder weder auszuschließen noch<br />
sichtbar, da bei dieser Größe noch nicht unbedingt ausgeprägt und fällt damit als<br />
Bestimmungsmerkmal aus. Aufgrund der geringen Grundgesamtheit verbleiben hier bei der<br />
Determination Unsicherheiten, die Größe der Adulten (im April, d.h. reif und weitgehend fertig<br />
„geschrumpft“) spricht aber mit sehr hoher Wahrscheinlichkeit für Eudontomyzon. Damit wäre das<br />
Ukrainische Bachneunauge erstmals auch nördlich der Donau nachgewiesen. Dazu ist zu<br />
ergänzen, dass eine Population im Aist-Unterlauf (nur etwa 15 Kilometer entfernt und fast auf<br />
derselben Seehöhe), deren Querder und Adulte weit kleiner sind, anhand der Saugscheibe als<br />
L. planeri bestimmt wurde. Dies spricht dafür, dass hier tatsächlich unterschiedliche Gattungen<br />
vorliegen.<br />
33
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Freilich ist einzuschränken, dass eine Determinierung alleine aufgrund der Totallänge auch bei<br />
großer Grundgesamtheit mit gewissen Unsicherheiten behaftet ist. Daher ist für die Zukunft für alle<br />
nachgewiesenen Neunaugenpopulationen eine definitive Bestimmung von Adulten anhand der<br />
Saugscheibe anzustreben.<br />
Dies vor allem deshalb, weil das maximale Größenwachstum von Neunaugen in Abhängigkeit vom<br />
Gewässer variieren und von Umweltfaktoren wie Höhenlage, Wassertemperatur oder<br />
Nahrungsangebot beeinflusst werden kann (MOORE & POTTER, 1976; BIRD & POTTER, 1979;<br />
MAITLAND, 2003). KAPPUS et al. (1995) fanden in einem winterwarmen baden-württembergischen<br />
Donauzubringer als Lampetra zu bestimmende, adulte Neunaugen mit maximal 192 mm. Dies<br />
stellt eine in der Literatur genannte, einzigartige Maximallänge dar, die allerdings in zitierter Arbeit<br />
entsprechend als Ausreißer diskutiert wird. Weder im südbayerischen Raum noch in Österreich<br />
sind bisher derartig große Exemplare von Lampetra bekannt geworden.<br />
In diesem Zusammenhang ist eine in Abb. 12 angeführte Population aus der Lonka (Mur-<br />
Einzugsgebiet im Lungau, ca. 1100 m Seehöhe; ZAUNER et al. 2006) interessant, weil es sich<br />
hierbei aus zoogeographischen Überlegungen um Eudontomyzon handeln sollte, die Größe der<br />
Querder mit maximal 185 mm aber deutlich unter denen der oberösterreichischen Neunaugen und<br />
eines umfangreichen Datensatzes aus verschiedenen Kärntner Gewässern liegt. Hier wäre ein<br />
Einfluss der großen Seehöhe plausibel, aber auch genotypische Unterschiede könnten eine Rolle<br />
spielen.<br />
Große taxonomische Unsicherheiten verbleiben, weil die Gattung Eudontomyzon stark<br />
revisionsbedürftig bzw. ungenügend bearbeitet ist. Neunaugen aus Südösterreich weisen<br />
Unterschiede zu den als E. mariae bestimmten Tieren aus Oberösterreich auf und wären gemäß<br />
KOTTELAT & FREYHOF als E. vladykovi zu bestimmen. Möglicherweise handelt es sich dabei aber<br />
auch um eine neue Art (FREYHOF, schriftl. Mittlg). Hier wären größer angelegte, phylogenetische<br />
und morphologische Untersuchungen von Nöten. Die vorliegende Arbeit kann aber zumindest auf<br />
Gattungsniveau gut abgesicherte, neue Erkenntnisse liefern.<br />
Aus Sicht der Verbreitung von Neunaugen in Oberösterreich zeigt sich, dass Lampetra tatsächlich<br />
auf das Mühlviertel beschränkt vorkommen dürfte. Wie bisher die Donau als Verbreitungsgrenze<br />
heranzuziehen wäre jedoch in Anbetracht des Fundes von Eudontomyzon im nördlichen Machland<br />
unzureichend. Auch die nahe liegende Hypothese, dass in der Böhmischen Masse ausschließlich<br />
Lampetra verbreitet wäre bzw. die Geologie den für die Verbreitung der beiden Arten<br />
entscheidenden Habitatparameter darstellt, wird widerlegt, schließlich können in Sandbach und<br />
Pfuda, beides Gewässer, deren Einzugsgebiete vorwiegend in der Böhmischen Masse liegen,<br />
Ukrainische Bachneunaugen dokumentiert werden (Abb. 10). Ähnliches zeigt sich in Bayern, wo in<br />
der Großen Ohe (linksufriger Donauzubringer nordöstlich von Passau) Eudontomyzon<br />
nachgewiesen werden konnte (KAPPUS & RAHMANN, 1995).<br />
Auch in anderen europäischen Flusssystemen treten gemeinsame Vorkommen von<br />
Eudontomyzon und Lampetra auf [z.B. Wolgasystem (RESHETNIKOV et al., 2004); Weichselsystem<br />
(fraglich; REMBISZEWSKI, 1968); March, Theiss (HOLCIK, 1995)]. Ob es dabei auch zu einer<br />
räumlichen Überlappung von Populationen kommt, ist nicht bekannt und wäre noch zu<br />
untersuchen (LEVIN & HOLCIK, 2006). Auch die Möglichkeit der Hybridisierung beider Arten ist in<br />
Diskussion (REMBISZEWSKI, 1968). Allerdings wird die Beschreibung von Hybriden bezweifelt, weil<br />
die morphologischen Merkmale von E. mariae eine große Variabilität aufweisen (LEVIN & HOLCIK,<br />
2006).<br />
Im gesamten Donaueinzugsgebiet zeigt sich das Verbreitungsmuster, dass L. planeri vor allem<br />
Oberläufe von linksufrigen bzw. nördlichen und östlichen Zubringern der Oberen Donau besiedelt,<br />
während Eudontomyzon schwerpunktmäßig in südlichen und westlichen Zubringern der Mittleren<br />
und Unteren Donau auftritt. Dieses Phänomen lässt sich durch zwei Hypothesen plausibel erklären<br />
(siehe KAPPUS & RAHMANN, 1995):<br />
1) Lampetra ist sekundär durch temporäre Verbindungen mit Oberläufen aus dem<br />
atlantischen Einzugsgebiet eingewandert („Flussanzapfungen“)<br />
34
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
2) Lampetra planeri war zuerst über das gesamte Donaugebiet verbreitet und wurde im Zuge<br />
einer späteren Invasion von Eudontomyzon in die Oberläufe zurück gedrängt.<br />
KAPPUS und RAHMANN (1995) schätzen die zweite Hypothese als schlüssiger ein. Eine ähnliche<br />
Situation kann im Wolga-Einzugsgebiet beobachtet werden, wo im Ober- und Mittellauf, bzw. in<br />
deren Zubringern Lampetra planeri auftritt, im Mittellauf jedoch nur Eudontomyzon mariae (LEVIN &<br />
HOLCIK, 2006).<br />
Mit dem aktuell gefundenen Verbreitungsmuster in Oberösterreich sind beide Hypothesen<br />
vereinbar. Für allfällige weitere Funde südlich der Donau und insbesondere auch in Bezug auf<br />
südlich der Alpen postulierte Vorkommen von Lampetra planeri (vgl. SCHROLL, 1969; HOLCIK &<br />
RAHMANN, 1995) würde das Zutreffen von Hypothese 2 heißen, dass jede einzelne Population auf<br />
ihre Artzugehörigkeit geprüft werden muss, weil auch isolierte, disjunkte Reliktvorkommen von<br />
Lampetra innerhalb des großräumigen Verbreitungsgebiets von Eudontomyzon nicht<br />
auszuschließen sind.<br />
Um Hinweise auf den Populationsaufbau und in weiterer Folge Wachstum und Alter von<br />
Neunaugenpopulationen zu bekommen, ist die Interpretation von Größenklassen als Jahrgänge<br />
(Kohortenanalyse) auf Basis der Längenverteilung bei Neunaugen möglich. Als Einschränkung<br />
erweist sich jedoch, dass lebende Neunaugen im Feld nur sehr schwer bzw. zeitraubend<br />
ausreichend genau vermessen werden können.<br />
Exemplarisch können anhand der umfangreichen Daten von Pfuda mit Zubringern sowie der<br />
Großen Mühl (CSAR & GUMPINGER, 2009) mehrere ausgeprägte Kohorten identifiziert werden<br />
(Abb. 13), darunter 1+ Individuen um 50 mm Länge in der Pfuda und als 2+ interpretierte<br />
Individuen um 70 mm in der Mühl (vgl. SALEWSKI, 1991). Wie für Neunaugen typisch, sind Adulte<br />
tendenziell kleiner als reife Querder (HARDISTY & POTTER, 1971). Dieser Größenunterschied fällt<br />
bei den reifen Adulten an der Pfuda im Frühjahr stärker aus als bei den in Metamorphose<br />
begriffenen Neunaugen an der Mühl im August. Dies ist damit erklärbar, dass sich die<br />
Körperproportionen der Adulten während und auch nach der Metamorphose bis zum Ablaichen<br />
und folgenden Absterben noch deutlich ändern (KRAPPE, 2008).<br />
Individuen<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
Eudontomyzon mariae Pfuda + Zubringer<br />
n = 138<br />
0<br />
0 50 100 150 200<br />
Totallänge [mm]<br />
Lampetra planeri Gr. Mühl<br />
n = 87<br />
0<br />
0 50 100 150 200 250<br />
Totallänge [mm]<br />
Abb. 13: Populationsaufbau in der Pfuda (links; April) und der Großen Mühl (rechts, August).<br />
Querder<br />
Adulte<br />
Wie in der Literatur beschrieben (z.B. BOHL, 1995a; KIRCHHOFER, 1995), wird auch in<br />
oberösterreichischen Gewässern eine obligatorische Bindung der Querder an spezifische<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
35
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Substratfraktionen beobachtet (Abb. 14 und Abb. 15). Es handelt sich dabei um vorwiegend<br />
feinsandige Fraktionen mit schluffigen Anteilen, meist durchsetzt von organischem Material.<br />
In keinem oberösterreichischen Gewässer, in dem derartige Sedimente fehlen, können Neunaugen<br />
nachgewiesen werden. Eine Sedimentation von psammalen bis pelalen Fraktionen liegt bei den<br />
untersuchten kleineren Fließgewässern vor allem in Strecken mit vergleichsweise geringem<br />
Gefälle und daher natürlicherweise mäandrierendem bis pendelndem Lauf vor, insbesondere an<br />
den Gleithängen und kleinräumig auch hinter Strömungshindernissen im Gewässerbett.<br />
Abb. 14: Typische „Neunaugen-Sedimentbank“ in der Pfuda bei Angsüß mit feinsandig-schluffigem, mit<br />
organischem Material durchsetztem Sediment; links Überblick; rechts Detail. Auf dieser Bank konnten 61<br />
Querder gefangen werden.<br />
Abb. 15: Makro-Aufnahmen von mit Querdern besiedeltem Sohlsubstrat aus dem Redlbach (links) und aus der<br />
Pfuda (rechts).<br />
Dementsprechend können Neunaugen beispielsweise in den Mittel- und Unterläufen von Pfuda<br />
(inkl. Zubringer) und Fornacher Redlbach gefunden werden, wo das Gefälle zwischen 1 und 8<br />
Promille beträgt. Dies entspricht in Bezug auf das Breiten-Gefälleverhältnis nach HUET (1949) dem<br />
unteren Metarhithral bis Epipotamal (Abb. 16). Weiter stromauf in denselben Gewässersystemen<br />
(Epirhithral bis gefällereiches Metarhithral; Gefälle über 9 Promille) fehlen Neunaugen. Es ergibt<br />
sich ein gewisser Zusammenhang mit der Begleitfischfauna: Sind zusätzlich zur Bachforelle auch<br />
Fischarten wie Aitel, Gründling oder Bachschmerle vorhanden, so kommen in diesen beiden<br />
Gewässern fast immer auch Neunaugen vor; treten nur Salmoniden und die Koppe auf, so fehlen<br />
36
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
hier auch meist die Neunaugen (Ausnahmen: Kenadinger Bach nahe Mündung in Pfuda; mittlere<br />
Gefälle ‰<br />
20<br />
15<br />
10<br />
5<br />
0<br />
0 5 10 15 20<br />
Strecke am Redlbach).<br />
Gewässerbreite [m]<br />
Fund Pfuda + Zubringer<br />
Nullfang Pfuda<br />
Fund Redl<br />
Nullfang Redl<br />
Epirhithral<br />
Metarhithral<br />
Hyporhithral<br />
Epipotamal<br />
Metapotamal<br />
Abb. 16: Gefälle –Breiten-Verhältnisse der Probestellen mit und ohne Neunaugenfund an Pfuda (mit Zubringern)<br />
und Fornacher Redl nach Huet (1949).<br />
Die Verfügbarkeit von überströmten, kiesigen Sohlbereichen als wahrscheinlich ebenfalls vitale<br />
Habitate zur Reproduktion (Laichhabitat; vgl. BOHL, 1995; KUHN, 1992) ist in den Gewässern mit<br />
aktuellem Neunaugenvorkommen gegeben. Laichmigrationen in Zubringer sind beispielsweise an<br />
der Pfuda (Abb. 17) und der Vöckla möglich und wahrscheinlich. Um die Bedeutung derartiger<br />
Migrationen zu untersuchen, wären Reusenuntersuchungen im Frühjahr geeignet und sinnvoll (vgl.<br />
MORRIS & MAITLAND, 1987).<br />
Abb. 17: Im Kenadinger Bach kommen neben einer großen Sedimentbank im Mündungsbereich in die Pfuda auch<br />
kiesige Furten als potentielle Laichplätze vor (Hintergrund links). Hier können neben einer großen Zahl von<br />
Querdern (46) auch drei Adulte (rechts) gefangen werden.<br />
37
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Fast alle derzeit gefundenen Neunaugenpopulationen sind mit der Bachforelle vergesellschaftet,<br />
jedoch wie beschrieben in der Regel auch mit den weiteren Begleitfischarten Aitel, Schmerle,<br />
Gründling und Koppe (Abb. 18). Dies zeigt, dass Neunaugenbestände heute vorwiegend an (meta-<br />
und hypo-) rhithralen Gewässern erhalten sind. Eine ähnliche Vergesellschaftung von Lampetra<br />
planeri mit vorwiegend rhithralen Fischarten beschreibt BOHL (1995a) für bayerische Gewässer.<br />
Vor dem Hintergrund, dass historische Hinweise (siehe oben) und wenige aktuelle Funde auch<br />
Vorkommen in den großen Flüssen belegen, ist aus den seltenen Nachweisen gemeinsam mit<br />
ausgeprägt potamalen Fischartengemeinschaften zu schließen, dass Bestände im Potamal stärker<br />
zurück gegangen sind als in kleineren Rhithralgewässern. Auch die schwierige Nachweisbarkeit in<br />
großen Flüssen, insbesondere Stauräumen, dürfte in diesem Zusammenhang eine Rolle spielen.<br />
Stellen<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
Eu./La.<br />
Sa.tr<br />
Le.ce<br />
Ba.br<br />
Go.go<br />
On.my<br />
Co.go<br />
Neunaugen, Eudontomyzon bzw. Lampetra<br />
Abb. 18: Mit Neunaugen vergesellschaftete Arten (excl. Funde aus Inn und Donau). Blau ... rheophile; grau ...<br />
oligorheophile; grün ... indifferente; rot ... limnophile.<br />
5.2.5 Defizitanalyse und Maßnahmenvorschläge<br />
Le.le<br />
Lo.lo<br />
Th.th<br />
Al.bi<br />
Pe.fl<br />
Ph.ph<br />
Ch.na<br />
Die derzeit bekannten Vorkommen von Neunaugen sind großteils durch Isolation voneinander<br />
bzw. durch eine geringe Länge besiedelter Gewässerstrecke gekennzeichnet. Sie weichen damit<br />
deutlich von einer anhand historischer Literatur und Gewässermorphologie rekonstruierbaren,<br />
ursprünglich dichten und weit verbreiteten Besiedelung oberösterreichischer Gewässer ab. Aus<br />
einer Reihe ursprünglich besiedelter Gewässer (z.B. Salzach, Steyr, Krems, Traun excl. Zubringer)<br />
liegen heute keine Funde mehr vor.<br />
Betrachtet man die Gefährdungssituation in den benachbarten österreichischen Bundesländern<br />
und in Bayern (ZAUNER & RATSCHAN, 2005; BOHL, 1995), so zeigt sich auch vor allem im<br />
südbayerischen Raum, aber auch in Niederösterreich und Salzburg, dass ähnlich wie in<br />
Oberösterreich Neunaugenbestände regional ausgestorben oder sehr selten geworden sind und<br />
nur mehr in weitgehend isolierten, geographisch weit entfernten Habitaten auftreten.<br />
In der Österreichischen Roten Liste wird Eudontomyzon mariae der Gefährdungskategorie<br />
„vulnerable“ zugeordnet (entspricht „gefährdet“; WOLFRAM & MIKSCHI, 2007). Angesichts der<br />
isolierten Vorkommen wäre die Gefährdung in Oberösterreich wahrscheinlich eine Kategorie höher<br />
Ga.ac<br />
Cy.ca<br />
Es.lu<br />
Le.de<br />
Ne.ke<br />
Ru.ru<br />
Sa.fo<br />
38
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
einzuschätzen („Endangered“, entspricht „stark gefährdet“). Sollten sich im Zuge dringend<br />
anzustrebender phylogenetischer Bearbeitungen die Hinweise bestätigen, dass die<br />
oberösterreichischen und südösterreichischen Neunaugen unterschiedlichen Taxa innerhalb der<br />
Gattung „Eudontomyzon“ angehören, so wäre auch Österreichweit eine entsprechend strengere<br />
Gefährdungskategorie angebracht. Die Einstufung von Lampetra planeri in der der Roten Liste<br />
Österreichs als „Endangered“ erscheint auch für Oberösterreich plausibel, wenngleich ein<br />
Überblick über die quantitative Bestandsituation im Mühlviertel noch zu erarbeiten wäre.<br />
Diesbezüglich sind im Rahmen der „Gewässerzustandserhebung“ wertvolle neue Daten zu<br />
erwarten.<br />
Neunaugenbestände reagieren aufgrund der wenig mobilen Lebensweise der Ammocoeten, der<br />
langen Entwicklungsdauer und der filtrierenden Ernährung sehr sensibel auch gegenüber seltenen<br />
Störereignissen (z.B. Fischsterben durch Eintrag toxischer oder sauerstoffzehrender Substanzen;<br />
Feinsedimente etc.). Dies kann insbesondere beim Vorliegen von kleinräumigen, verinselten<br />
Vorkommen fatal wirken. Besonders negativ wirken darüber hinaus wasserbauliche Eingriffe, die<br />
Strömungsmuster und Sedimentverhältnisse nachhaltig verschlechtern. Hydrologische Eingriffe<br />
(Ausleitung, Aufstau und Schwall) können sehr ungünstig auf Neunaugenpopulationen wirken.<br />
Vor diesem Hintergrund muss der Erhalt bzw. die Ausweitung des Lebensraums bestehender<br />
Bestände als oberste Priorität gelten (vgl. KIRCHHOFER, 1995; BOHL, 1995). Konfliktpotential ergibt<br />
sich dabei vor allem mit der Kleinwasserkraftnutzung und Hochwasserschutzmaßnahmen.<br />
Versuche zur künstlichen Vermehrung von Lampetra planeri wurden in der Vergangenheit bereits<br />
durchgeführt und veröffentlicht (BOHL & STROHMEIER, 1992). Im Freiland gefangene Adulte laichten<br />
erfolgreich in Langstromrinnen ab, auch ein erfolgreicher Schlupf konnte beobachtet werden. Im<br />
Anschluss zeigten die frühen Querder jedoch aus unbekannter Ursache eine hohe Mortalität. BOHL<br />
& STROHMEIER (1992) schließen daraus, dass eine künstliche Vermehrung nicht ausreichend<br />
erfolgreich ist, um Besatzmaterial in größeren Mengen erzeugen zu können und betonen, dass der<br />
Schutz und die Wiederherstellung natürlicher Lebensräume für den Erhalt der Art prioritär sind.<br />
Aufgrund der komplexen und nur teilweise abschätzbaren Beziehungen zum Lebensraum wären<br />
Versuche, Neunaugen in derzeit nicht besiedelten Gewässern anzusiedeln, als wenig Erfolg<br />
versprechend einzuschätzen. Derartige Möglichkeiten bieten sich allerdings dort, wo die Ursachen<br />
für das Verschwinden in ehemals besiedelten Gewässern bekannt sind und aktuell nicht mehr<br />
vorliegen.<br />
Dies trifft beispielsweise im Fall des Rainbaches (Zubringer der Pram; erloschenes Vorkommen,<br />
Güteprobleme aktuell weitgehend gelöst), des Zipfer Redlbaches (Fischsterben in der<br />
Vergangenheit) oder möglicherweise weiterer Vöckla-Zubringer zu. In letzteren wären jedenfalls<br />
noch detaillierte Erhebungen notwendig, auch um aktuelle Vorkommen sicher ausschließen zu<br />
können. Als Herangehensweise wäre das wiederholte Überführen von Querdern unterschiedlicher<br />
Größen aus räumlich möglichst nahe gelegenen Spenderpopulationen anzudenken. Die<br />
Populationsgröße der Spenderpopulationen muss im Vorfeld eingehender quantifiziert werden, um<br />
nachhaltige negative Einflüsse auf deren Bestand ausschließen zu können.<br />
Ähnliche Maßnahmen wurden in Kärnten durchgeführt, wo in einem revitalisierten Abschnitt der<br />
Drau (großzügige Aufweitung bei Dellach) Neunaugen nachweislich mit Erfolg aus der Gail wieder<br />
angesiedelt wurden (HONSIG-ERLENBURG et al., 2002). Allerdings ist hier nicht ganz<br />
auszuschließen, dass Neunaugen aus einer kleinen Reliktpopulation in einem Zubringer stromauf<br />
eingewandert sind (HONSIG-ERLENBURG, mündl. Mittlg.).<br />
Mit vergleichsweise geringem Aufwand können Neunaugenbestände unterstützt werden, wenn<br />
Querbauwerke entfernt oder für Neunaugen passierbar gemacht werden, die aktuell Wanderungen<br />
in Zubringer unterbinden. Das Wissen über die Fähigkeiten von Neunaugen, verschiedene<br />
Bautypen von FAHs zu überwinden, ist derzeit sehr gering, weil Aufstiege von Neunaugen so gut<br />
wie nie bei Reusenuntersuchungen oder Markierungsversuchen dokumentiert werden können<br />
(siehe ZITEK et al. 2007). Daher sind unbedingt überfallsfreie Bautypen vorzusehen<br />
(asymmetrische, überfallsfreie Rampen, Umgehungsgerinne oder als letzte Alternative Vertikal-<br />
39
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Schlitz-Pässe) anstatt Bautypen, die für Neunaugen wahrscheinlich eingeschränkt oder nicht<br />
passierbare Sohlsprünge bzw. Überfälle mit sich bringen (Tümpelpässe, mit Querriegeln<br />
aufgelöste Rampen).<br />
Die Möglichkeit der Vernetzung von Zubringern bietet sich z.T. an Zubringern der Pfuda, Pram und<br />
Vöckla an. Damit kann einerseits eine natürliche Wiederbesiedelung ermöglicht werden und<br />
andererseits die Vernetzung bestehender Reliktpopulationen oder wieder anzusiedelnder<br />
Bestände erreicht werden. Zur Präzisierung wären, in Ergänzung zu in manchen Gebieten noch<br />
anzustrebenden fischökologischen Detailerhebungen, beispielsweise Vöckla und Zubringer,<br />
Sipbach oder Krems, gewässermorphologische Kartierungen im Vorfeld vorzusehen.<br />
Darüber hinaus ist anzustreben, Gewässer die beispielsweise durch Sohlplasterung oder harte<br />
Regulierung aktuell für eine Besiedelung durch Neunaugen nicht mehr geeignet sind, durch<br />
Renaturierung wieder als Neunaugenlebensraum nutzbar zu machen. Vorwiegend in Gewässern<br />
im Sandbachsystem, im Machland und möglicherweise im Sipbach und Zubringern der Vöckla<br />
wären weitere Erhebungen und Kartierungen zweckdienlich.<br />
Auch in größeren Flüssen, die ein besonders hohes Potential als Habitate für große Bestände<br />
aufweisen, kommen aktuell noch Neunaugen vor. Das Vorkommen von Eudontomyzon im Inn-<br />
System war bereits in der Literatur beschrieben und wird aktuell für Oberösterreich inkl. Zubringer<br />
des Inns bestätigt. In diesem Zusammenhang ist die hohe Bedeutung der guten Population im<br />
Pfuda-System, das über die Pram in den Inn mündet, hervorzuheben, die in Bezug auf die<br />
Bestandsdichte einzigartig sein dürfte. Möglicherweise lebt auch in den Stauräumen des Unteren<br />
Inn, wo vereinzelte Fänge bekannt wurden (SCHOTZKO & JAGSCH, 2007; OTT, mündl. Mittlg. 2008)<br />
ein nennenswerter Bestand, der aufgrund methodischer Limitierungen aber nur schwer quantitativ<br />
zu beurteilen ist.<br />
Wie die Funde in der Donau zeigen, dürften diese Inn-Neunaugen-Populationen auch in die Donau<br />
ausstrahlen, aber auch hier sind lokal selbsterhaltende Populationen auf Feinsedimentbänken<br />
nicht auszuschließen. Die Bedeutung von Zubringern als Reproduktionsareal wäre hier zu<br />
untersuchen. Hinweise auf Einwanderungen aus der Donau in Zubringer gibt es beispielsweise an<br />
der Erlau, einem linksufrigen (bayerischen) Zubringer des Stauraums Jochenstein.<br />
Ähnliches gilt für die oberösterreichische Enns. Hier wäre günstig, bei künftigen<br />
Stauraumabsenkungen Vorkommen zu bestätigen und Hinweise auf Dichte und Definitives zur<br />
Artzugehörigkeit zu erheben.<br />
Auch in den Stauketten von Inn und Enns sind Maßnahmen mit dem Ziel denkbar, die<br />
vorhandenen Bestände zu stützen oder lokal wiederherzustellen. Limitierend für die Bestände sind<br />
hier möglicherweise weniger die Querderhabitate als vielmehr kiesige Laichhabitate, die in diesen<br />
durchgehend gestauten Gewässern weitgehend verschwunden sind. Diesbezüglich wäre im Sinne<br />
einer mit der FFH-Richtlinie synergetischen Umsetzung der EU-Wasserrahmenrichtline die<br />
Schaffung abflussstarker, dynamisch dotierter Umgehungsarme anstatt technischer<br />
Fischaufstiegshilfen, soweit dies in Bezug auf Flächenverfügbarkeit möglich ist, sowie großzügiger<br />
Stauwurzelstrukturierungen als Laichplatz für die rheoparen, kieslaichenden Neunaugen<br />
anzustreben. Bei entsprechender, überfallsfreier Ausführung sind derartige Umgehungsarme für<br />
migrierende adulte Neunaugen auffindbar, ein- und durchwanderbar. Sie können entsprechend<br />
des Leitbilds eines natürlichen Nebenarms oder Zubringers neben der wichtigen Funktion als<br />
Laichplatz auch mosaikartig verteilte Habitate für Querder und Adulte bieten.<br />
40
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5.3 Goldsteinbeißer (Sabanejewia balcanica)<br />
5.3.1 Allgemeines<br />
Merkmale: Langgestreckter, seitlich zusammengedrückter, in österreichischen Populationen<br />
maximal 8 bis 12 cm langer Körper; kleine Schuppen; unterständiges Maul mit 4 kurzen Bartfäden<br />
am Oberkiefer und 2 in den Mundwinkeln; unter jedem Auge aufrichtbarer, zweispitziger Dorn;<br />
Färbungsmerkmale (zur Unterscheidung von Cobitis): Zwei, meist deutlich getrennte, dunkle<br />
Flecken am Schwanzflossenansatz (Cobitis: 1 Fleck); nur 10 bis 11 Flecken am Rücken; nur eine<br />
Reihe mit 10 bis 12 Flecken an der Körperseite. Die zweite Gambetta-Zone (seitliche<br />
Fleckenreihe) fehlt (Abb. 19); Augendorn kräftiger als bei C. taenia, Barteln länger. Männchen von<br />
Sabanejewia verfügen über keine Canestrini-Schuppe. Der Körper des Männchens schwillt<br />
während der Laichzeit vor dem Rückenflossenansatz an (sekundäres Geschlechtsmerkmal).<br />
Abb. 19: Vergleich Goldsteinbeißer (Sabanejewia balcanica, oben) mit Steinbeißer (Cobitis sp.); beide stammen<br />
aus dem Sulzabach (Zubringer der Grenzmur). Roter Pfeil: zweiter Fleck.<br />
Taxonomie: Der Goldsteinbeißer wurde in Österreich erst 1989 entdeckt (KAINZ, 1991) und<br />
damals fälschlich als Cobitis aurata DE FILIPPI, 1863 bestimmt. Später wurden Goldsteinbeißer aus<br />
dem Mur-Einzugsgebiet als Cobitis (Sabanejewia) aurata balcanica determiniert (AHNELT &<br />
TIEFENBACH, 1994). Diese Population ist auf Basis neuerer, molekulargenetischer Arbeiten von<br />
PERDICES et al. (2003) als eigene Art, Sabanejewia balcanica KARAMAN 1922, zu führen.<br />
Sabanejewia aurata dürfte in Europa nicht vorkommen.<br />
Andere österreichische Funde aus dem Einzugsgebiet der Raab ähneln in Bezug auf die<br />
mitochondriale DNA jenen slowakischer und rumänischer Donauzuflüsse stärker als jenen des<br />
steirischen Mursystems (PERDICES et al. 2003), was anhand der weit geringeren hydrologischen<br />
Distanz zwischen den Funden im Raab-Donau-System im Vergleich mit dem Mur-Drau-Donau-<br />
System plausibel erscheint. Die wenigen bisher bekannten Vorkommen aus Niederösterreich<br />
wurden nicht untersucht, es wird aber vermutet, dass sie jenen der Raab ähneln (AHNELT &<br />
MIKSCHI, 2004).<br />
Unterschiedliche Gruppen von phänotypisch ähnlichen Goldsteinbeißern aus Mittel- und<br />
Südosteuropa stimmen nicht mit den mitochondrialen Linien überein. Daher werden diese Gruppen<br />
41
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
derzeit als Variationen einer einzigen, plastischen Art - Sabanejewia balcanica – gedeutet<br />
(BOHLEN, schriftl. Mittlg. 2009).<br />
Abb. 20: Goldsteinbeißer aus der Aschach<br />
Biologie und Ökologie: Spezifische Informationen zur Biologie und Ökologie der Gattung<br />
Sabanejewia sind nur sehr spärlich verfügbar. War bisher von Ähnlichkeiten mit Cobitis<br />
ausgegangen worden, so zeigen neue Ergebnisse erhebliche Unterschiede in Bezug auf Habitate,<br />
Temperaturoptima, Sauerstoffbedarf, Fortpflanzung und Larvalökologie (BOHLEN, schriftl. Mittlg.<br />
2009).<br />
Bei Sabanejewia wurde ein von anderen Cobitiden abweichendes Laichverhalten beobachtet.<br />
Anders als bei Cobitis bildet das Männchen beim Ablaichen keinen Ring, sondern legt sich<br />
V-förmig um das Weibchen. Funktionell ist daher ein Geschlechtsdimorphismus (z.B. Cobitis:<br />
Männchen kleiner, mit Canestrini-Schuppe und verdickten Brustflossenstrahlen) nicht notwendig<br />
und fehlt. Anders als bei Cobitis fand BOHLEN (2000) bei Sabanejewia klebrige Eier und keine<br />
ausgeprägte Präferenz in Bezug auf das Laichsubstrat. Sowohl Sand, Kies, Moos als auch<br />
Hartsubstrat wurden angenommen, Informationen zur Wahl von Laichplätzen im Freiland fehlen.<br />
Im Vergleich zu den untersuchten Cobitis - Arten und zu Misgurnus fossilis bilden Embryos des<br />
Goldsteinbeißers keine externen Kiemenfilamente und keine Vaskularisation der Flossensäume<br />
aus. Dies kann als Anpassung an vergleichsweise sauerstoffreichere bzw. stärker durchströmte<br />
Habitate gedeutet werden (BOHLEN, 2000; vgl. BOHLEN, 2003).<br />
Diese reproduktionsbiologischen Charakteristika sind in Hinblick auf die Ökologie der Arten<br />
plausibel und stimmen mit Beobachtungen im Freiland überein. Beispielsweise schätzen WOLFRAM<br />
et al. (2008) den Goldsteinbeißer in der Lafnitz als „litho-rheophiler“ ein als Cobitis. Sabanejewia<br />
besiedelt hier kleine Nebengewässer weit weniger als der gewöhnliche Steinbeißer, und wird im<br />
Gegensatz zu jenem nie in stagnierenden Altarmen nachgewiesen.<br />
Beide Gattungen gelten als dämmerungs- und nachtaktive Bodenfische, die am Tag versteckt<br />
leben und sich von kleinen, benthischen Evertebraten ernähren. AHNELT & TIEFENBACH (1994)<br />
konnten an einem Fundpunkt beobachteten, dass Goldsteinbeißer selbst angelegte Höhlen im<br />
Sand besiedeln und diese bei einer Flucht gezielt wieder aufsuchen.<br />
Bereits KARAMAN (1922) betonte bei der Erstbeschreibung von Sabanejewia balcanica, dass die<br />
Art in deutlich anderen Habitaten vorkommt als die in der Nähe lebenden Cobitis. Eine hohe<br />
Bindung des Goldsteinbeißers an sandiges bis feinkiesiges Substrat wird von mehreren Autoren<br />
42
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
betont, während Cobitis eher sandige bis schlammige Fraktionen bevorzugt (HARKA, 1986; ZAUNER<br />
& WOSCHITZ, 1991; AHNELT & TIEFENBACH, 1994). Juvenile Goldsteinbeißer dürften etwas feineres<br />
Substrat bevorzugen als Adulte. Mikrohabitate mit starker Sedimentbedeckung durch Detritus und<br />
Schlamm werden gemieden. In Übereinstimmung mit den Ergebnissen in Österreich berichten<br />
POVZ & SUMER (2000), dass die Art in Slowenien vorwiegend große Bäche und kleine Flüsse<br />
besiedelt und weniger die großen Flüsse. In Bezug auf die Verbreitung im<br />
Fließgewässerkontinuum in Österreich wird übereinstimmend für Sabanejewia und Cobitis ein<br />
ausgeprägter Schwerpunkt im Epipotamal (Barbenregion) angenommen (Fischregionsindex 6,3;<br />
SCHMUTZ et al. 2001).<br />
5.3.2 Historische Verbreitung<br />
Das historische Verbreitungsgebiet von Goldsteinbeißern, Sabanejewia sp. VLADYKOV 1929, ist auf<br />
Basis von historischen Literaturangaben nicht rekonstruierbar, weil diese Gattung erst im 20.<br />
Jahrhundert erstmals beschrieben wurde und erst seit den 1990er Jahren aus Österreich bekannt<br />
ist. Es umfasst vermutlich die Potamalgewässer des Raab-/Lafnitz- und Mur-Systems sowie die<br />
Unterläufe einiger Donauzubringer in Nieder- und Oberösterreich (vgl. WOLFRAM & MIKSCHI, 2007).<br />
Die heutigen Vorkommen dürften nur einen Teil des ursprünglich besiedelten Areals umfassen und<br />
sind stark fragmentiert.<br />
Die Hypothese von KAINZ (1991), dass sich der Goldsteinbeißer erst in den letzten Jahrzehnten bis<br />
Österreich ausgebreitet hätte, wurde von einer Reihe von Autoren als unwahrscheinlich bezeichnet<br />
und kann heute mit Sicherheit als widerlegt gelten – auch vor dem Hintergrund, dass entlang der<br />
österreichischen Donau mehrere isolierte Populationen gefunden wurden, die oberhalb von<br />
unpassierbaren Querbauwerken auftreten.<br />
5.3.3 Aktuelle Verbreitung<br />
Gesamtverbreitung: Goldsteinbeißer aus der Sabanejewia balcanica Gruppe sind<br />
schwerpunktmäßig in Südosteuropa verbreitet und kommen vom Unteren Donau- und<br />
Pannonischen Becken bis Griechenland, Kroatien, die Slowakei und Österreich vor.<br />
Österreich: Aus Österreich sind Goldsteinbeißer im Mur-System aus der Sulm und dem<br />
Gamlitzbach sowie den westlichen Grabenlandbächen bekannt (AHNELT & TIEFENBACH, 1994;<br />
ZAUNER & RATSCHAN, 2004; ZITEK et al. 2004). Im Raab-System im Südburgenland und der<br />
Oststeiermark kommen sie in der Lafnitz mit Rittschein und Safen, in der Pinka und in der Raab<br />
selbst vor (ZAUNER & WOSCHITZ, 1992; WOSCHITZ et al. 2001; WOLFRAM & MIKSCHI, 2002;<br />
WOLFRAM et al. 2008).<br />
Nördlich der Alpen sind nur ganz vereinzelte Vorkommen bekannt, nämlich aus der Leitha bei<br />
Pachfurth (WANZENBÖCK & SPINDLER, 1995), dem Kamp (SPINDLER, 1997; WIESNER & GUMPINGER,<br />
2005) und als bisher westlichstem Nachweis der Melk (ZITEK et al. 2004b), die bei Strom-km 2036<br />
in das Donau-Begleitgerinne mündet. In Wien und den westlichen Bundesländern fehlt die Art.<br />
Der Nachweis aus der Aschach, einem rechtsufrigen Donauzubringer (historische Mündung bei<br />
Strom-km 2157), stellt mit Abstand den nordwestlichsten Fundort dieser Art in Österreich (ca.<br />
120 Donau-Kilometer stromauf der Melk-Mündung) bzw. den nordwestlichsten Fund der Gattung<br />
Sabanejewia überhaupt dar. Gleichzeitig handelt es sich dabei um den Erstnachweis des<br />
Goldsteinbeißers für das Bundesland Oberösterreich (Abb. 22).<br />
43
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 21: Verbreitung von Goldsteinbeißern in Österreich. Rot: Funde 2008. Grün: Stand 2007. Blau: Böhmische<br />
Masse.<br />
Abb. 22: Goldsteinbeißer-Nachweise in Oberösterreich<br />
5.3.4 Diskussion<br />
Im Rahmen des vorliegenden Projektes konnte der Goldsteinbeißer als für Oberösterreich neue Art<br />
in einer Restwasserstrecke der Aschach im Bereich Pupping nördlich von Eferding nachgewiesen<br />
werden. Der Nachweis gelang an zwei befischten Stellen, wobei allerdings nur fünf Individuen<br />
gefangen wurden. Bevorzugte Mikrohabitate sind Zonen mit sandig bis leicht schlammigem<br />
44
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Substrat und liegen in Bereichen verminderter Strömung vor allem an den Gleithängen des mäßig<br />
strukturreichen Laufes der Aschach in diesem Bereich.<br />
Zwei weitere Befischungen der Aschach im Zuge der GZÜV (Messstellen Aschach Pfaffing, 32 Ind.<br />
und Aschach 2, 3 Ind.) im Bereich Karling lieferten weitere Funde der Art. Diese<br />
Befischungsstrecken liegen ca. 3 - 4 km flussauf des Erstfundpunktes in einer kurzen<br />
Ausleitungsstrecke bzw. der Stauwurzel einer Rampe. Hier konnten auf einer großen Sandbank<br />
die größten Dichten im Gebiet gefunden werden, 31 Individuen auf etwa 50 m befischter Strecke<br />
(Abb. 23).<br />
Abb. 23: Sandbank, auf der die höchste Dichte an Goldsteinbeißern gefunden wurde (rechts unten)<br />
Intensive Befischungen der flussabwärtigen Bereiche der Aschach (Aschach-Mühlbach und<br />
Entlastungsgerinne) lieferten keine weiteren Funde. Auch in zwei befischten Stellen im Sandbach<br />
Ost, der bei Eferding in die Aschach mündet, sowie im Zuge einer Reihe von Bestandserhebungen<br />
im Innbach-Aschach-Gerinne bzw. im Innbach selbst konnten keine weiteren Nachweise erbracht<br />
werden.<br />
Flussauf stehen die nächsten Befischungsergebnisse erst oberhalb des Aschach-Durchbruchs zur<br />
Verfügung. Im Aschach-Durchbruch selbst ist allerdings aufgrund des hohen Gefälles und des<br />
damit weitgehenden Fehlens sandiger Anlandungen nicht von geeigneten Habitatbedingungen für<br />
den Goldsteinbeißer auszugehen. Weder in der Aschach weiter stromauf des Durchbruchs noch in<br />
den Zubringern Leitenbach und Sandbach konnten bei aktuellen, umfangreichen Erhebungen<br />
Goldsteinbeißer gefunden werden (SILIGATO & GUMPINGER, 2004; HAUNSCHMID & PETZ-GLECHNER,<br />
2007).<br />
Es zeigt sich also, dass der besiedelte Abschnitt maximal von etwa Höhe Brandstatt bis Hilkering<br />
reicht, dies sind lediglich 7,5 km Gewässerstrecke. Dabei ist weiters einzuschränken, dass diese<br />
Strecke durch eine Abfolge von Staubereichen gekennzeichnet ist. In gestauten Abschnitten der<br />
Aschach können im Zuge der GZÜV-Erhebungen keine Goldsteinbeißer gefunden werden,<br />
während in einem kurzen Stauwurzelbereich, wo am Ufer sandiges Material anlandet, hohe<br />
Dichten zu beobachten waren.<br />
45
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Der Staueinfluss wirkt in der ausgesprochen gefällearmen Aschach (nur ca. 0,6 ‰) besonders<br />
fatal, weil bereits Querbauwerke mit geringer Fallhöhe zu kilometerlangen Rückstauen führen<br />
können (Abb. 27). Damit reduzieren sich attraktive Habitate für Goldsteinbeißer in der Aschach auf<br />
einige, wenige hundert Meter kurze Stauwurzelbereiche sowie zwei Restwasserstrecken.<br />
Die Kleinkraftwerke und energiewirtschaftlich nicht genutzten Rampen im potentiell besiedelten<br />
Abschnitt sind nicht bzw. nicht mit für Goldsteinbeißer passierbaren Migrationshilfen ausgestattet.<br />
Es ist daher davon auszugehen, dass es sich bei dem einzigen in Oberösterreich bekannten<br />
Goldsteinbeißerbestand um eine kleine, lediglich durch Abdrift bzw. Abwanderung stromab<br />
verbundene Metapopulation handelt, deren Subpopulationen klein und stark durch kaum<br />
besiedelte Staubereiche bzw. unpassierbare Querbauwerke fragmentiert sind.<br />
Vor diesem Hintergrund, auch in Hinblick auf die Güteentwicklung in der Aschach in der<br />
Vergangenheit (siehe unten), erscheint bemerkenswert, dass sich die Art überhaupt bis heute<br />
halten konnte. Für die Zukunft besteht ein hohes Risiko, dass die Population nicht auf<br />
Veränderungen oder Verschlechterungen des Lebensraums reagieren oder durch Schadeinflüsse<br />
(Fischsterben, toxische Einleitungen etc.) aussterben könnte und die Art damit aus Oberösterreich<br />
verschwindet.<br />
Die generellen Habitatbedingungen in der Aschach ähneln deutlich jenen der übrigen aus<br />
Österreich bekannten Vorkommen (Abb. 21). Es handelt sich durchwegs um epipotamale,<br />
sommerwarme Gewässer mit zumindest lokal hohen Anteilen von sandigen Fraktionen (Abb. 24,<br />
links). Bereits ZAUNER & WOSCHITZ (1992), aber auch WOLFRAM et al. (2008) betonen, dass für den<br />
Goldsteinbeißer eher „sandig/feinkiesige“ als „schlammig/feinsandige“ Fraktionen von Bedeutung<br />
sind und stufen die Art als „litho-rheophiler“ ein als Cobitis. Wie aus dem Lafnitz- und Mur-System<br />
berichtet, handelt es sich auch nördlich der Alpen um kleine bis mittelgroße, sommerwarme<br />
Fließgewässer. Auch in der Aschach finden sich hohe Dichten von Sabanejewia lokal vor allem im<br />
Bereich von Gleithängen und Sandablagerungen im Strömungsschatten von Abflusshindernissen.<br />
Abb. 24: Vergleich des von Goldsteinbeißern besiedelten Sohlsubstrates in der Aschach (links) und im Gamlitzbach<br />
in der Südsteiermark (rechts).<br />
In Bezug auf die aktuell bekannten Vorkommen fällt ein Zusammenhang mit dem geologischen<br />
Untergrund im Einzugsgebiet auf (Abb. 24). Im Fall von Aschach, Kamp und Melk (Dunkelsteiner<br />
Wald) weist dieses große Anteile der Böhmischen Masse auf. Auch in der Leitha (Leitha-Gebirge)<br />
liegt kristallines Material vor. Bei der Verwitterung eines derartigen geologischen Untergrunds<br />
entstehen die für den Goldsteinbeißer wichtigen psammalen Fraktionen. Auch das besiedelte<br />
Sohlsubstrat in der Südsteiermark ähnelt jenem der Aschach stark (Abb. 24, rechts).<br />
Die Goldsteinbeißer der Aschach ähneln jenen des Kamp und auch jenen aus der Lafnitz und<br />
Raab äußerlich sehr stark. Im Vergleich zu den Steinbeißern aus dem Mur-System fällt als<br />
46
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Unterschied auf, dass bei den ober- und niederösterreichischen Goldsteinbeißern der feine<br />
Pigmentsaum oberhalb der groben Fleckenreihe deutlich feiner marmoriert ist als bei den<br />
südsteirischen Exemplaren. Dieses Merkmal tritt bei Aschach-Goldsteinbeißern konstant auf (Abb.<br />
25). Darüber hinaus scheint der Schwanzstiel der Goldsteinbeißer aus der Aschach schmäler zu<br />
sein als bei den südsteirischen. Auch in Bezug auf die Körpergröße dürfte es Unterschiede<br />
zwischen diesen Populationen geben (Abb. 25).<br />
Derzeit werden unterschiedliche Gruppen von Phänotypen von Sabanejewia als Variationen einer<br />
einzigen Art gedeutet, S. balcanica. Zur weiteren Aufklärung der unklaren Taxonomie ist ein<br />
Forschungsprojekt in Vorbereitung (BOHLEN, schriftl. Mittlg. 2009).<br />
Abb. 25: Goldsteinbeißer aus Aschach (oben), Kamp (Mitte) und Gamlitzbach (unten).<br />
Aschach<br />
Kamp<br />
Gamlitzbach<br />
Bei einer maximalen Länge von 85 mm sind die Aschach-Goldsteinbeißer im Vergleich mit<br />
Populationen aus der Lafnitz (TLmax = 110 mm) oder den südsteirischen Grabenlandbächen mit<br />
Gamlitzbach (TLmax = 110 mm) als ausgesprochen kleinwüchsig anzusprechen (Abb. 26). Dies<br />
könnte mit dem kühleren Klima in Oberösterreich oder genotypischen Unterschieden erklärt<br />
werden. Erwähnenswert ist der Fang eines 0+ Individuums in der Aschach, das Mitte September<br />
25 mm misst. Derartig kleine Steinbeißer sind aufgrund methodischer Einschränkungen (Wirkung<br />
des elektrischen Feldes, Maschenweite der Kescher etc.) schwer nachweisbar und im Fang stark<br />
unterrepräsentiert.<br />
47
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Individuenzahl<br />
Individuenzahl<br />
Individuenzahl<br />
20<br />
15<br />
10<br />
5<br />
0<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
Sabanejewia sp., Aschach<br />
Sabanejewia balcanica, Mur-Zubringer<br />
n = 76<br />
Sabanejewia sp., Lafnitz und Zubringer<br />
n = 47<br />
GZÜV, n=35<br />
Kleinfisch, n=5<br />
0 20 40 60 80 100 120 140<br />
Totallänge [mm]<br />
Abb. 26: Größenstruktur von Goldsteinbeißern aus der Aschach (oben) im Vergleich mit Grabenlandbächen und<br />
Gamlitzbach (Mitte; ZAUNER & RATSCHAN, 2004; ZAUNER et al., 2009) sowie der Lafnitz (WOLFRAM et al.<br />
2008.)<br />
5.3.5 Defizitanalyse und Maßnahmenvorschläge<br />
Um die lokale Verbreitung in der Aschach sowie Bestandsdichten des Goldsteinbeißers besser<br />
abschätzen zu können ist eine verdichtende Bestandsuntersuchung im Fundgebiet sowie die<br />
Befischung der Aschach an weiteren Stellen nötig. Dies vor allem, um die derzeit unbekannte<br />
Bestandssituation in der Strecke zwischen Hilkering und Karling abzuklären, sowie um die<br />
gesamte Populationsgröße abschätzen zu können.<br />
Aktuell muss von einer extrem kleinräumigen Verbreitung dieser Fischart in Oberösterreich<br />
ausgegangen werden. Das neu entdeckte Vorkommen dieser in Österreich seltenen Art in der<br />
Aschach scheint aufgrund der hydromorphologischen Situation des Gewässers in diesem Bereich<br />
wenig individuenreich zu sein. Es kommt zu einer starken Konzentration der Tiere auf die wenigen<br />
verfügbaren Mikrohabitate.<br />
Wegen der Kleinräumigkeit des besiedelten Gewässerbereichs geht hier von punktuellen<br />
Gewässerbelastungen eine große Gefahr aus. Geeignete Strategien, um dieses Risiko zu<br />
vermindern, sind die Verbesserung der aktuellen Bestände, eine Ausweitung und Vernetzung der<br />
besiedelbaren Gewässerabschnitte, sowie die Etablierung von Beständen in Zubringern. Letztere<br />
können im Fall von Fischsterben als Rückzugsgebiet dienen.<br />
Vorweg scheint angebracht, einige Individuen zur beobachtenden Hälterung in künstliche<br />
Bachsysteme zu überführen. Auf diese Weise können erste Erfahrungen für die Etablierung einer<br />
Erhaltungsnachzucht gewonnen werden. Eine darauf aufbauende erfolgreiche Nachzucht der<br />
48
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Aschachpopulation könnte möglicherweise den Fortbestand der oberösterreichischen Population<br />
im Falle eines Fischsterbens sichern und ggf. Material für den Besatz weiterer Bereiche in der<br />
Aschach liefern.<br />
Um die Notwendigkeit für eine künstliche Vermehrung zu prüfen, ist die Populationsgröße<br />
detaillierter zu erheben. Es ist nicht auszuschließen, dass wider Erwarten zumindest lokal große<br />
Bestände, etwa zwischen Hilkering und Karling, entdeckt werden können, was allerdings auf Basis<br />
der vorliegenden Ergebnisse eher als unwahrscheinlich einzuschätzen ist. In diesem Fall wäre<br />
eine künstliche Nachzucht nicht notwendig und es könnten Ansiedelungsversuche mit aus dem<br />
Wildbestand entnommenen Individuen durchgeführt werden.<br />
Ansiedelungsbestrebungen versprechen vor allem in der Aschach zwischen Durchbruch und<br />
Leitenbachmündung sowie im Unterlauf von Sandbach und Leitenbach Erfolg. Hier treten für<br />
Goldsteinbeißer günstige Substratverhältnisse auf großen Flächen auf. Auch die qualitative<br />
Wasserbeschaffenheit dürfte kaum vom Aschach-Unterlauf abweichen, sodass initialen<br />
Besatzmaßnahmen eine gute Erfolgschance eingeräumt werden können. Eine Ansiedelung in der<br />
Aschach oberhalb des Durchbruchs wäre unabhängig von der nicht mehr lösbaren Frage, ob die<br />
Art hier ursprünglich heimisch war oder nicht, angesichts des hohen Gefährdungsgrads in<br />
Oberösterreich und der günstigen Erfolgsprognose derartiger Maßnahmen gerechtfertigt.<br />
In vielen südösterreichischen Gewässern liegt heute in von Goldsteinbeißern besiedelten<br />
Abschnitten die biologische Gewässergüte II-III vor, dementsprechend wird von AHNELT &<br />
TIEFENBACH (1994) eine hohe Toleranz gegenüber organischen Wasserverschmutzungen<br />
angenommen. Allerdings dürfte die Art eine noch schlechtere Wassergüte nicht mehr vertragen,<br />
wie Ergebnisse aus Kroatien zeigen (DELIC et al. 2003). Der Aschach-Oberlauf war bis in die 70er<br />
Jahre eines der am meisten belasteten Gewässer Oberösterreichs (Güteklasse IV; Quelle:<br />
Gütebild der Fließgewässer Österreichs, BMLFUW). Erst stromab des Aschachdurchbruches war<br />
durch die hohe Selbstreinigung auch in Zeiten der intensivsten Belastung Güteklasse II-III<br />
gegeben. Mit Stand 2005 ist die Güte auch oberhalb des Durchbruchs auf II-III saniert, der<br />
Unterlauf wird jetzt mit II eingestuft. Somit wäre durchaus plausibel, dass ursprünglich auch<br />
oberhalb des Durchbruchs ein Bestand an Goldsteinbeißern vorhanden war, dieser aber<br />
möglicherweise durch die schlechte Gütesituation verschwunden ist. Dies kann als Argument für<br />
initiale Besatzmaßnamen im Sinne einer Wiederansiedelung im Oberlauf ins Treffen geführt<br />
werden.<br />
Eine Ansiedelung in anderen, potentiell geeignete Flusssystemen in Oberösterreich (z.B. Naarn<br />
Unterlauf, Schwemmnaarn) ist noch detailliert zu prüfen und in Bezug auf Erfolgsaussichten und<br />
Sinnhaftigkeit zu diskutieren.<br />
Die Aschach weist im gegenständlichen Bereich eine hohe Feinsedimentbelastung vor allem aus<br />
landwirtschaftlichen Quellen auf. Starke Feinsedimentablagerungen beeinträchtigen bzw.<br />
zerstören die bevorzugten Habitate des Goldsteinbeißers. Im Fall hoher organischer Anteile kommt<br />
es zu Sauerstoffzehrungen, die in Analogie zum Steinbeißer besonders auch für den<br />
Goldsteinbeißer ungünstig wirken (vgl. ZAUNER & RATSCHAN, 2005).<br />
Die Etablierung bzw. Ausdehnung von Uferschutzstreifen und eine Intensivierung der<br />
Winterbegrünung im landwirtschaftlich genutzten Bereich um Hilkering, Hacking, Karling und<br />
Pupping könnten die angespannte Feinsedimentsituation im unmittelbaren Verbreitungsgebiet des<br />
Goldsteinbeißers verbessern.<br />
Grundsätzlich kann auch eine verfehlte fischereiliche Bewirtschaftung, wie zum Beispiel der in der<br />
Aschach langjährig durchgeführte Besatz mit Aalen Steinbeißerbestände negativ beeinflussen.<br />
Umgekehrt wird beispielsweise an Rhein und Weser diskutiert, dass eine beobachtete Steinbeißer-<br />
Expansion (Cobitis) mit den zurückgehenden Aalbeständen in Zusammenhang stehen könnte<br />
(DÜMPELMANN, 2008).<br />
Zahlreiche Querbauwerke unterbrechen den Fließgewässercharakter und die longitudinale<br />
Durchgängigkeit der Aschach nach dem Aschachdurchbruch bis zur Mündung in den Innbach. Der<br />
49
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Fluss wird in diesem Bereich trotz des geringen Potentials seit jeher intensiv energiewirtschaftlich<br />
genutzt. Kurz vor Pupping wird die Aschach zudem in zwei Gerinne geteilt. Das<br />
Entlastungsgerinne verfügt über einen Restwasserabfluss mit dynamischen<br />
Abflussschwankungen. Das künstlich geschaffene, weitgehend monotone Gewässer dürfte vor<br />
allem durch einen deutlichen Einfluss von kalten Qualmwasseraustritten (siehe ZAUNER et al.<br />
2009) nicht für die Besiedelung mit Goldsteinbeißern geeignet sein.<br />
Im Mühlbach sind aufgrund der fehlenden Abflussdynamik und eines massiven<br />
Feinsedimenteintrags bei Donauhochwässern sehr starke Sedimentationen zu beobachten, die zu<br />
ungünstigen Substratverhältnissen und einer Gerinnemorphologie führen, die ebenfalls über weite<br />
Strecken nicht für Goldsteinbeißer geeignet ist. Sowohl im Entlastungsgerinne, als auch im<br />
Aschach-Mühlbach stromab Leumühle können dementsprechend trotz intensiver Erhebungen<br />
keine Goldsteinbeißer gefunden werden.<br />
Die Habitatverfügbarkeit für Goldsteinbeißer in der Aschach zwischen Pupping und Hilkering muss<br />
als sehr gering bewertet werden. Geeignete Mikrohabitate sind zumeist nur sehr kleinräumig<br />
vorhanden und oft mehrere hundert Meter voneinander getrennt. Diese als angespannt zu<br />
bezeichnende Lebensraumsituation könnte durch Abtrag derzeit ungenutzter Querbauwerke<br />
(Wehre, Sohlrampen) und entsprechende Eliminierung von Staubereichen deutlich ausgeweitet<br />
werden. Bereits eine teilweise Absenkung von Rampen kann hier deutliche Verbesserungen<br />
bringen. Allfällige, dadurch notwendige Uferbefestigungen sind im Vergleich zu angesichts des<br />
geringen Gefälles enorm langen Stauen aus gewässerökologischer Sicht das deutlich geringere<br />
Übel.<br />
Abb. 27: Die Sohlrampe in Karling (links) als Beispiel für ein energiewirtschaftlich nicht genutztes, unpassierbares<br />
Querbauwerk, das einen für Goldsteinbeißer und rheophile Fischarten kaum besiedelbaren, etwa einen<br />
Kilometer langen Stau bildet (rechts).<br />
In Bezug auf eine anzustrebende Vernetzung der fragmentierten Subpopulationen bestehen bei<br />
einer schwimmschwachen, sohlgebundenen Art wie dem Steinbeißer besondere Anforderungen<br />
an Fischaufstiegshilfen. Es sind unbedingt absturzfreie Bautypen (asymmetrische, überfallsfreie<br />
Rampen oder Umgehungsgerinne, Vertikal-Schlitz-Pässe) anderen Lösungen wie Tümpelpässen<br />
oder mit Querriegeln aufgelösten Rampen vorzuziehen (vgl. WOLFRAM et al. 2008). Dies sollte im<br />
Zuge von Genehmigungsverfahren im Verbreitungsgebiet dieser extrem seltenen Art berücksichtigt<br />
werden.<br />
In der Aschach wurde in jüngster Zeit eine Reihe weiterer FFH-Fischarten bzw. Arten mit hohem<br />
Gefährdungsgrad nachgewiesen. Besonders erwähnenswert ist der Bestand an Frauennerflingen<br />
(Rutilus pigus), der in Hinblick auf die Dichte gemeinsam mit dem Marchfeldkanal in<br />
50
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Niederösterreich einzigartig sein dürfte. Weiters sind Weißflossengründling (Romanogobio<br />
vladykovi), Schied (Aspius aspius) und Bitterling (Rhodeus amarus) dokumentiert, sowie im<br />
Mündungsbereich in die Donau fast das gesamte Donau-Artenspektrum (47 Fischarten; ZAUNER et<br />
al. 2009). Zudem wurden im gegenständlichen Bereich der Aschach Vorkommen der vom<br />
Aussterben bedrohten Gemeinen Flussmuschel Unio crassus sowie der gefährdeten Donau-<br />
Flussdeckelschnecke Viviparus acerosus gefunden (SCHAUER & LUGMAIR in prep.).<br />
Wie der Goldsteinbeißer würden auch diese Arten von der Vernetzung, Ausweitung und<br />
qualitativen Verbesserung ihres Lebensraums in der Aschach massiv profitieren. Das betrifft in<br />
besonderem Maß den rheophilen, stark gefährdeten Frauennerfling.<br />
5.4 Steinbeißer (Cobitis elongatoides)<br />
5.4.1 Allgemeines<br />
Merkmale: Langgestreckter, seitlich zusammengedrückter, 8 bis 11, max. 14 cm langer Körper;<br />
kleine Schuppen; unterständiges Maul mit 4 kurzen Bartfäden am Oberkiefer und 2 in den<br />
Mundwinkeln; unter jedem Auge aufrichtbarer, zweispitziger Dorn; Männchen mit „Canestrini-<br />
Schuppe“ am Brustflossenansatz; Saum der Schwanzflosse ausgebuchtet, deutliche dunkle Binde<br />
von Oberlippe quer über Auge, Färbungsmerkmale im Unterschied zu Sabanejewia sp.: nur 1<br />
dunkler Fleck auf dem Schwanzflossenansatz; 2 dunkle Fleckenreihen an der Körperseite, untere<br />
mit 15 bis 20 großen Flecken; obere mit 12 bis 20 Flecken; 4 sog. „Gambetta-Zonen“<br />
(Pigmentierungsreihen) auf der Körperseite, alle Bartfäden kurz, erreichen maximal den<br />
Augenvorderrand (Abb. 28).<br />
Abb. 28: Steinbeißer aus dem Machland (oben) und aus der Enknach (unten).<br />
51
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Biologie: Die Geschlechtsreife dürfte mit 1 bis 2 Jahren bei einer Länge von 5 bis 8 cm erreicht<br />
werden. Das Maximalalter wird mit 5 Jahren angegeben, wobei Männchen in der Regel um ein<br />
Jahr weniger alt werden. Als Laichzeit wird in Mitteleuropa April bis Juli angegeben. Entgegen oft<br />
weit geringerer Angaben in der Literatur dürfte die Eizahl bei maximal etwa 3000 – 4000 pro<br />
Weibchen liegen, wobei diese in Portionen von einigen hundert Eiern über Tage bis Wochen<br />
verteilt abgegeben werden können (Portionslaicher; BOHLEN, 1999a). Zum Laichsubstrat gibt es<br />
widersprüchliche Angaben, einerseits wird Sand und auch steiniges Substrat angegeben<br />
(STEINBACH, 2002), wahrscheinlich dürfte aber pflanzliches Material, beispielsweise filamentöse<br />
Algen oder Moos bevorzugt werden (z.B. BOHLEN, 1999; RITTERBUSCH & BOHLEN, 2000).<br />
Der Name „Steinbeißer“ nimmt Bezug auf die besondere Ernährungsweise: Er erzeugt durch<br />
pumpende Bewegungen in der Mundhöhle einen Wasserstrom, durch den Sediment durch das<br />
Maul eingesogen und durch die Kiemenöffnungen wieder ausgestoßen wird. Durch spezielle<br />
morphologische Strukturen in der Mundhöhle werden leichte, organische Nahrungspartikel von<br />
schweren anorganischen Sedimentbestandteilen getrennt (ROBOTHAM, 1982). Als Nahrung dienen<br />
vor allem benthische Crustaceen, Chironomiden, Oligochaeten, Rädertiere und Detritus.<br />
Diese Ernährungsweise bestimmt auch die Mikrohabitatwahl dieses Fisches (ROBOTHAM, 1978)<br />
mit einer Bevorzugung feiner Sandfraktionen. Zusätzlich ermöglicht dieses Sediment dem<br />
vorwiegend dämmerungs- und nachtaktiven Steinbeißer, sich unter Tags und bei Gefahr<br />
einzugraben. Frühe Larven leben nach dem Schlupf aus dem Ei zuerst versteckt in dichter<br />
Vegetation, um das Prädationsrisiko zu vermindern. Juvenile Steinbeißer gehen zu einer<br />
Lebensweise auf offenerem, sandigem Untergrund über (BOHLEN, 1999b). Zumindest in stehenden<br />
Gewässern wurde eine hohe Standorttreue von Steinbeißern beobachtet (RITTERBUSCH & BOHLEN,<br />
2000).<br />
Der Steinbeißer ist wie viele Cobitiden zur Darmatmung durch Verschlucken von Luft befähigt, was<br />
ihm das Überleben in Gewässern mit zeitweise geringer Sauerstoffsättigung ermöglicht. Auch die<br />
Embryos sind durch externe Kiemenfilamente und eine Vaskularisation der Flossensäume an<br />
geringe Sauerstoff- bzw. Strömungsverhältnisse angepasst.<br />
Autökologie: Der Steinbeißer ist im europäischen Verbreitungsgebiet hinsichtlich der besiedelten<br />
Gewässer als recht plastisch zu beschreiben, er besiedelt sowohl nicht allzu rasch fließende<br />
Fließgewässer selbst, deren Lahnbäche wie auch stagnierende, meist aber einseitig angebundene<br />
Altwässer. Dichte Bestände treten in Österreich vor allem in sommerwarmen, kleinen und<br />
mittelgroßen Bächen und Flüssen mit feinsandigen bis schlammigen Anlandungen auf. Optimal für<br />
die Entwicklung früher Stadien sind Temperaturen von ca. 18 - 26°C (BOHLEN, 2003). Als<br />
Verbreitungsschwerpunkt in österreichischen Fließgewässern wird das Epi- und Metapotamal<br />
angegeben (Fischregionsindex 6,3; SCHMUTZ et al. 2001). In der Literatur werden auch Uferzonen<br />
von Seen genannt, wenngleich in Österreich mit Ausnahme eines angesiedelten Vorkommens in<br />
einem Baggersee (SAMEK, 2000) kein derartiges Vorkommen bekannt ist. Das Vorkommen des<br />
Steinbeißers ist streng an spezifische Substratverhältnisse gekoppelt: Nur das Vorliegen von<br />
feinsandigen bis schlammigen Fraktionen ermöglicht seine spezialisierte Ernährungs- und<br />
Lebensweise. Dabei ist er im Gegensatz zum Goldsteinbeißer auch noch in stark verschlammten,<br />
stagnierenden Gewässern mit einer gewissen Sauerstoffzehrung zu finden und verfügt zudem im<br />
Gegensatz zum Goldsteinbeißer über eine akzessorische Darmatmung. In Gewässern die kaum<br />
geeignete Substratverhältnisse aufweisen werden manchmal ufernahe Makrophytenpolster als<br />
Verstecke genutzt.<br />
Taxonomie: Die Taxonomie der europäischen Arten der Gattung Cobitis ist sehr kompliziert und<br />
unausgereift. Die von Linné beschriebene Art C. taenia ist vermutlich auf Zuflüsse der Nord- und<br />
Ostsee sowie der Wolga beschränkt, außerhalb vorkommende Steinbeißer gehören<br />
wahrscheinlich anderen Arten an (VASILEV et al. 1989; BOHLEN & RAB, 2001). Die im<br />
Donaueinzugsgebiet vorkommenden Steinbeißer, und damit der Großteil der österreichischen<br />
Population, werden aktuell der Art Cobitis elongatoides zugeordnet (FREYHOF, 1999). Zusätzlich<br />
52
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
wird die Taxonomie durch die Möglichkeit der gynogenetischen Fortpflanzung und des Auftretens<br />
polyploider Individuen in Steinbeißerpopulationen verkompliziert.<br />
Innerhalb der Gattung Cobitis gibt es in Osteuropa verschiedene Arten oder Arten-Hybrid-<br />
Komplexe mit unterschiedlichen Reproduktionsweisen, die sich unter anderem im Ploidie-Grad<br />
unterscheiden. In Mitteleuropa wiesen erstmals BOHLEN et al. (2002) sechs verschiedene Arten-<br />
Hybrid-Komplexe nach, und zwar in Fließgewässern der Einzugsgebiete der Oder, Elbe, Weser,<br />
Issel und des Rheins. Neben C. taenia dürften in Mitteleuropa zumindest zwei weitere Arten<br />
vertreten und an der Hybridbildung beteiligt sein: C. elongatoides und C. tanaitica. Laut RÁB (in<br />
litt.) kommt C. taenia in Österreich gar nicht vor, dafür jedoch C. tanaitica und C. elongatoides.<br />
Angesichts der offenen Diskussion wird der Steinbeißer in der Roten Liste Österreichs als Cobitis<br />
sp. geführt (WOLFRAM & MIKSCHI, 2007).<br />
5.4.2 Historische Verbreitung<br />
Historische Angaben zum Steinbeißer sind generell immer mit Vorsicht zu interpretieren, fällt Laien<br />
doch teils heute noch die Unterscheidung zur Bachschmerle („Grundl“), dem Schlammpeitzger<br />
(„Bißgurn, Stein- oder Schlammbeißer, Wetterfisch“) und zu den Gründlingen („Grundl, Greßling,<br />
Weber“) schwer. In der wissenschaftlichen Literatur des frühen 19. Jahrhunderts werden diese<br />
Arten allerdings bereits differenziert abgehandelt, sodass Angaben zur Verbreitung und Ökologie<br />
sich mit hoher Sicherheit tatsächlich auf das Taxon Cobitis sp. beziehen.<br />
In historischen Abhandlungen über die Fischfauna Bayerns bzw. Österreichs wird allgemein<br />
angegeben, dass der Steinbeißer in Flüssen und Bächen mit Sand- oder Schlammgrund weit<br />
verbreitet war (SCHRANK, 1798; FITZINGER, 1832; JÄCKEL, 1864).<br />
HECKEL & KNER (1858) geben als innerösterreichische Fundorte „…Wien, Aspern und Piesting …“<br />
an. In KUKULAS Fischfauna Oberösterreichs (1874) trifft man leider auf ein wenig differenziertes<br />
Bild, was die Verbreitung des Steinbeißers betrifft. Hier heißt es sehr knapp „… lebt in allen<br />
Flüssen, Bächen und Seen …“. Dies lässt allerdings zumindest den Schluss zu, dass der<br />
Steinbeißer zu dieser Zeit oberösterreichweit keine seltene Art war.<br />
Der Steinbeißer wird bei HELLER (1871) für den Tiroler Inn genannt. Aktuelle Funde im Tiroler<br />
Inntal (SPINDLER et al. 2002) legen nahe, dass sich diese historische Angabe tatsächlich auf<br />
Cobitis bezieht. Für den Unteren Inn wird der Steinbeißer bei REICHHOLF (1989) gelistet.<br />
Vereinzelte jüngere Funde in Nebengewässern des Unteren Inn wie Enknach (KAINZ & GOLLMANN,<br />
2000) und Pram (JUNGWIRTH, 1984) zeigen, dass der Steinbeißer zweifellos zur historischen<br />
Fauna des Unteren Inn und seiner Zubringer zu zählen ist.<br />
Aus der Salzach selbst fehlen historische wie aktuelle Nachweise (SCHMALL, 2008). KOLLMANN<br />
(1898) war er für Salzburg bekannt, jedoch fehlen in seiner Fischereikarte ortsbezogene Angaben.<br />
Der Steinbeißer wurde 1992 im Rötelbach nachgewiesen, einem Zubringer der Saalach bei<br />
Reichenhall (LEUNER et al. 2000) wenige Kilometer von der österreichischen Grenze entfernt.<br />
Daher kann die Art zur potentiell historischen Fauna des Salzachgebiets gezählt werden.<br />
Darüber hinaus finden sich Angaben, die leider nicht als sichere Hinweise für konkrete Gewässer<br />
in Oberösterreich dienen können. Beispielsweise nennt WEIMAIER (1859) den Steinbeißer neben<br />
der Schmerle für Zubringer der steirischen Enns, sodass Vorkommen auch stromab im<br />
oberösterreichischen Ennsgebiet nicht auszuschließen sind. KERSCHNER (1956) listet im Jahr 1904<br />
vom Linzer Fischmarkt acht Individuen von Steinbeißern auf, deren Herkunft unbekannt bleibt.<br />
Weiters merkt er zu SCHEIBERS (1930) Anmerkungen zu einem "Steinparbl" aus der Traun an,<br />
dass es sich "höchst wahrscheinlich" nicht um die Schmerle, sondern um den Steinbeißer handle.<br />
Mit Sicherheit war der Steinbeißer zu keiner Zeit ein wirtschaftlich interessanter Fisch. Diese<br />
Tatsache zusammen mit der sehr versteckten Lebensweise des Tieres spiegelt sich in den äußerst<br />
seltenen Erwähnungen in historischer Literatur wieder. Dies führt zu einer sehr lückenhaften<br />
53
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abgrenzung des ursprünglichen Verbreitungsgebietes dieser Art für Österreich im gesamten und<br />
Oberösterreich im speziellen.<br />
Interessant scheint jedoch, dass auch aus Nebengewässern alpin geprägter Flüsse wie Inn,<br />
Salzach oder Enns oder aktueller auch der Drau in Osttirol (KOFLER, 1980) recht weit stromauf<br />
gelegene Funde aufscheinen, sodass ein großes potentielles Verbreitungsgebiet auch in<br />
Oberösterreich angenommen werden kann.<br />
5.4.3 Aktuelle Verbreitung<br />
Bis vor wenigen Jahren war man der Meinung, dass der Steinbeißer eine einzige, fast in der<br />
gesamten Paläarktis von Marokko bis Japan verbreitete Art sei (LADIGES & VOGT, 1979). Aufgrund<br />
der ungeklärten Auftrennung in verschiedene Arten ist eine Abgrenzung der Gesamtverbreitung<br />
zum derzeitigen Wissensstand nicht möglich.<br />
Der Steinbeißer ist europaweit mit Ausnahme von Nordskandinavien, Irland, Schottland und dem<br />
Südbalkan vertreten. Aufgrund der neueren Erkenntnis, dass sich hinter der taxonomischen Einheit<br />
Cobitis taenia eine Vielzahl von Arten verbergen, teilt sich das Verbreitungsgebiet<br />
dementsprechend unter den jeweiligen Arten auf (Review von BOHLEN & RÁB, 2001). Cobitis<br />
elongatoides sensu BOHLEN & RÁB dürfte in Mitteleuropa in Österreich im Osten Deutschlands und<br />
in Tschechien auftreten, der Verbreitungsschwerpunkt liegt in Osteuropa.<br />
Gute Bestände gibt es in vielen südoststeirischen Zubringern zur Mur, im „Copacabana“-<br />
Freizeitsee und in der Lafnitz. Auch einige südburgenländische Fließgewässer weisen<br />
Steinbeißerbestände auf. Aktuelle Nachweise fehlen aus Wien, Salzburg, Vorarlberg und, mit<br />
Ausnahme eines Wiederansiedelungsversuches, in Kärnten. In Niederösterreich wurden einige<br />
Nachweise aus kleinen und mittleren Fließgewässern beiderseits der Donau erbracht. Dabei<br />
befinden sich die Oberösterreich am nächsten liegenden Vorkommen in der Url und in der Melk<br />
(ZAUNER, 1995; ZITEK et al. 2004). Erst 2007 tauchte bei einer Fischbestandserhebung in einem<br />
Seitenarm der Ybbs bei Leutzmannsdorf ein Steinbeißer auf (HOLZER et al., 2007).<br />
In Oberösterreich liegen für diese Fischart nur einzelne Meldungen unterschiedlicher Aktualität aus<br />
dem Inn- und Mühlviertel vor.<br />
In der Pram gelang 1982 bei Kapelln ein Einzelfund eines Steinbeißers (JUNGWIRTH, 1984). Im<br />
Rahmen von Elektrobefischungen an der Enknach (KAINZ 2000) wurden Steinbeißer im Bereich<br />
des Zusammenflusses von Engelbach, Fillmannsbach und Hartbach gefunden.<br />
Elektrobefischungen im Rahmen von Hochwasserschutzprojekten im Machland erbrachten<br />
einzelne Individuen des Steinbeißers aus dem Mitterwasser und der Schwemmnaarn (GUMPINGER<br />
2002, 2005).<br />
Im Rahmen des vorliegenden Kleinfischprojektes wurden in Oberösterreich 45 Befischungsstellen<br />
in zahlreichen Gewässern auf das Vorkommen von Steinbeißern hin untersucht, wobei gezielt vor<br />
allem Gewässerstrecken ausgewählt wurden, aus denen entweder ältere Nachweise bekannt<br />
waren, oder die in der Nähe früherer Fundorte lagen. In fünf der untersuchten Gewässer konnte<br />
diese für Oberösterreich seltene Fischart nachgewiesen werden. Die Funde verteilen sich auf<br />
mehrere Gewässer des Machlandes und ein Gießen-System der Enknach (Abb. 29).<br />
54
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 29 Steinbeißer-Nachweise in Oberösterreich<br />
Abb. 30: Steinbeißer-Nachweise in Österreich, Stand 2007; Daten aktualisiert aus: ZAUNER & RATSCHAN, 2005.<br />
55
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Die Steinbeißerpopulation im kleinen Naarnkanal im Machland ist von Individuen mit einer<br />
Körperlänge um 70 mm dominiert, die als Altersklasse 2+ interpretiert werden kann (vgl.<br />
RITTERBUSCH & BOHLEN, 2000). Sie ist damit im Durchschnitt jünger als die Population, die an der<br />
Enknach gefunden wurde. Hier dominieren ältere Individuen mit Längen zwischen 100 und<br />
110 mm (Abb. 31). Interessant ist dieser Umstand vor allem vor dem Hintergrund regelmäßiger<br />
Sohlräumungen der Bäche im Machland.<br />
Individuezahl<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
Steinbeißer, Cobitis elongatoides<br />
Machland (n = 25)<br />
Enknach (n = 22)<br />
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140<br />
Totallänge [mm]<br />
Abb. 31 Längen-Frequenz-Diagramm der Steinbeißerpopulationen aus dem Machland und der Enknach<br />
Die mit dem Steinbeißer sympatrisch vorkommenden Arten zeigen schon das breite Spektrum der<br />
von dieser Art besiedelten Habitate. In den Bächen des Machlands kommt der Steinbeißer meist<br />
zusammen mit rheophilen Arten wie Gründling, Bachforelle, Schneider, Bachschmerle, Barbe,<br />
Koppe und Äsche vor. Dazu mischen sich noch indifferente Arten wie Aitel und Hasel. In<br />
langsamer durchflossenen bzw. stehenden Gewässern wie dem Mitterwasser im Machland oder<br />
dem Gießen-System in der Enknach tritt der Steinbeißer hauptsächlich gemeinsam mit<br />
indifferenten Arten wie Hecht, Flussbarsch, Aitel, Hasel und Elritze auf. Hier kommen in<br />
Einzelfällen auch limnophile Arten wie Stichling und Schleie hinzu (Abb. 32).<br />
56
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Stellen<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
Co.ta<br />
Le.ce<br />
Go.go<br />
Le.le<br />
Sa.tr<br />
Al.bi<br />
Ba.br<br />
Ba.ba<br />
Co.go<br />
Th.th<br />
Es.lu<br />
Steinbeißer, Cobitis elongatoides<br />
Pe.fl<br />
Ph.ph<br />
Al.al<br />
Abb. 32 Sympatrisches Auftreten mit Steinbeißern. Blau … rheophil; grau ... oligorheophil; grün ... indifferent; rot ...<br />
limnophil<br />
5.4.4 Diskussion<br />
Im Machland konnten Steinbeißer sowohl im künstlichen Unterlauf der Naarn wie auch im alten<br />
Naarn-Unterlauf, der heutigen Schwemmnaarn, nachgewiesen werden. In beiden<br />
Gewässerbereichen sind jedoch die Dichten als äußerst gering zu bewerten. Es wurden jeweils nur<br />
einzelne Individuen im Bereich ufernaher Wasserpflanzenbestände (Ranunculus fluitans)<br />
gefangen.<br />
In der morphologisch über weite Bereiche sehr naturnahen Schwemmnaarn konnten trotz<br />
intensiver Befischungen in mehreren Teilbereichen Steinbeißer nur unmittelbar nach der<br />
Ausleitung aus der Naarn bei Labing nachgewiesen werden. Weitere Befischungen im naturnahen<br />
Unterlauf der Schwemmnaarn im Bereich der Entenlacke sowie im Mündungsbereich des<br />
Klambachs in die Schwemmnaarn brachten keine weiteren Steinbeißerfunde.<br />
Dichtere Bestände wurden im Kleinen Naarnkanal nahe der Mündung in den Tobrabach gefunden.<br />
Dieses Gerinne ist stark begradigt und weist durch die dichte, krautige Ufervegetation nur im<br />
Sommer ein erhebliches Maß an Beschattung auf (Abb. 33). Nach der Mündung in den Tobrabach<br />
werden beide Bäche in einem betonierten Gerinne geführt.<br />
Ca.au<br />
Ga.ac<br />
Lo.lo<br />
Pr.ma<br />
Ps.pa<br />
Sa.fo<br />
Ti.ti<br />
57
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 33: Fundstelle im überwachsenen Bereich des Kleinen Naarnkanals vor der Mündung des Tobrabachs (links)<br />
und auf verbliebenen Schlammbänken (links unten) im Mündungsbereich zur Naarn (rechts). Die Felder<br />
grenzen unmittelbar an den Bachlauf.<br />
Dieses Gerinne wird in regelmäßigen Abständen geräumt und wies zum Befischungszeitpunkt<br />
keinerlei Strukturen auf. In dem weiten Trapezprofil kommt es durch fehlende Beschattung zu einer<br />
starken Erwärmung des Wassers. Im unmittelbaren Mündungsbereich des Kanals in die Naarn<br />
wurde die Räumung aufgrund von Hindernissen in der Uferböschung nicht vollständig ausgeführt.<br />
Hier blieben wenige Zentimeter starke Feinsedimentauflagen, Totholz und semiaquatische<br />
Vegetation erhalten. In diesem wenige Quadratmeter großen Bereich konnten mehrere Individuen<br />
des Steinbeißers nachgewiesen werden.<br />
Offensichtlich stellen hier einige Monate alte Sedimentablagerungen in einem kanalisierten<br />
Bachbett mangels naturnaher Bachabschnitte noch das geeignetste Mikrohabitat für diese seltene<br />
Fischart dar.<br />
Der Lauf der Enknach wurde an mehreren Stellen befischt. An dem bekannten Steinbeißer-<br />
Fundort am Zusammenfluss von Engelbach, Fillmannsbach und Hartbach konnten im Zuge dieser<br />
Befischungen keine Individuen nachgewiesen werden. Nur knapp 1 km flussab dieser Stelle wurde<br />
in einem Gießen-System der Enknach ein dichter Bestand an Steinbeißern gefunden. Dieser<br />
Graben verfügt über einen sehr geringen Abfluss und kaum Strömungsgeschwindigkeit. Die<br />
Makrophytenbestände sind teilweise sehr dicht, die Sohle ist von einer dicken Feinsedimentschicht<br />
bedeckt. Unterseitig ist der Graben frei an die Enknach angebunden (Abb. 34).<br />
58
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 34: Anbindung des Gießen-Systems (links) an die Enknach (rechts) bei Dietzing.<br />
In der Enknach selbst, unmittelbar am Zusammenfluss mit der beschriebenen Gieße, konnte<br />
lediglich ein Exemplar eines Steinbeißers gefangen werden. Die Enknach weist hier eine höhere<br />
Strömungsgeschwindigkeit auf, weshalb feinsandige bzw. schlammige Substrate kaum vorhanden<br />
sind. Weitere Befischungen im Verlauf der Enknach führten zu keinen weiteren Steinbeißerfunden.<br />
Der Steinbeißer, eine sehr kleinwüchsige Art wird verbreitungsmäßig dem Epi- und Metapotamal<br />
unserer Fließgewässer zugeordnet (Fischregionsindex 6,3; SCHMUTZ et al. 2001). Das Tier ist<br />
hauptsächlich dämmerungs- und nachtaktiv und verbringt den Tag eingegraben im Feinsediment<br />
bzw. versteckt in makrophytenbewachsenen Bereichen seiner Wohngewässer. Diese<br />
Schmerlenart ist aufgrund ihrer Lebens- und Ernährungsweise stark an spezielle, oft nur sehr<br />
kleinräumig gegebene Substratverhältnisse angepasst. Die Verteilung in den Gewässern ist somit<br />
sehr stark an solche, geeignete Mikrohabitate gebunden.<br />
Angesichts des großen potentiellen Verbreitungsgebiets in Oberösterreich stellt sich die Frage,<br />
wieso nur eine derart kleine Zahl von Funden vorliegt. Unweigerlich drängt sich der Verdacht auf,<br />
dass diese benthische Kleinfischart bei diversen Bestandserhebungen in der Vergangenheit<br />
übersehen oder nicht erkannt worden wäre. Führt man sich aber die dichten Nachweise in<br />
Südostösterreich vor Augen, wo ebenfalls kaum spezifische Steinbeißer-Erhebungen, sondern<br />
Elektrobefischungen mit anderen Fragestellungen durchgeführt wurden (Abb. 30), so zeigt sich,<br />
dass dies nicht der Hauptgrund für die geringe Nachweiszahl in Oberösterreich sein dürfte. Dazu<br />
ist zu ergänzen, dass diverse Institutionen bzw. handelnde Personen, die in den letzten Jahren in<br />
Oberösterreich kaum minder dichte Erhebungen als in anderen Bundesländern durchgeführt<br />
haben, den Steinbeißer aus anderen Gebieten kennen und daher auch in Oberösterreich richtig<br />
bestimmt hätten.<br />
Der Blick ins benachbarte Bayern sowie nach Niederösterreich ist in diesem Zusammenhang<br />
aufschlussreich: In Bayern wurde intensiv speziell nach Steinbeißern gesucht, aber nur an 2<br />
Standorten gelang ein Fund (BOHL, 1992: LEUNER et al. 2000). Dem entsprechend wird die Art in<br />
Südbayern als „vom Aussterben bedroht“ eingestuft, in Nordbayern gilt sie als verschollen. Auch<br />
im Most- und Waldviertel gibt es nur wenige Vorkommen, weiter im Osten (Wein- und<br />
Industrieviertel) wurde die Art jedoch deutlich häufiger gefunden.<br />
59
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Dies spricht dafür, dass auch in Oberösterreich nicht eine geringere Dichte oder Intensität an<br />
Erhebungen, sondern eine tatsächlich sehr lückige oder reliktäre Verbreitung des Steinbeißers<br />
vorherrscht. Nichts desto trotz ist aber zu erwarten, dass noch einige weitere Fundorte auftauchen.<br />
Zweifelsohne liegt Oberösterreich innerhalb des überregionalen Verbreitungsgebiets der Art,<br />
sodass außerhalb des ökologischen Optimums des Steinbeißers liegende, nicht im Detail<br />
bekannte Habitatfaktoren bzw. Gefährdungsfaktoren für die hiesige Seltenheit der Art<br />
verantwortlich sein dürften. Diesbezüglich wären klimatische, naturräumliche bzw. geologische<br />
Faktoren plausibel. BOHLEN (2003) beschreibt das Vorhandensein von geeigneten Mikrohabitaten<br />
mit warmem Wasser als Schlüsselfaktor für die erfolgreiche Reproduktion von Cobitis. Betrachtet<br />
man die Funde in Ober- und im westlichen Niederösterreich, so zeigt sich, dass es sich um<br />
ausgesprochen sommerwarme, gefällearme Flüsse mit zumindest abschnittsweise starker<br />
Besonnung infolge harter Regulierung (Machland, Pram, Url, Mank, Melk) oder um stagnierende<br />
Gewässerabschnitte handelt (Enknach). Funde aus stark beschatteten, rascher fließenden Ober-<br />
und Mittelläufen, wie sie etwa in der Südsteiermark vorkommen, sind derzeit aus Oberösterreich<br />
nicht bekannt. Typische Steinbeißergewässer in Südösterreich, flussbegleitende Lahnbäche,<br />
fehlen in Oberösterreich weitgehend und an kleinere Fließgewässer angebundene Altarme sind<br />
sehr selten.<br />
Möglicherweise bildet der Steinbeißer derzeit in Oberösterreich nur dort Bestände, wo er lokal<br />
außerordentlich günstige Bedingungen vorfindet. Diese sind derzeit eher in anthropogenen<br />
Sekundärhabitaten realisiert (vgl. TATENHORST et al. 2002), während die ursprünglichen<br />
Lebensräume der Art in Oberösterreich weitgehend verschwunden sein dürften. Natürliche Fluss-<br />
Au-Systeme zeichneten sich beispielsweise durch weit heterogenere Temperaturverhältnisse aus<br />
als regulierte Fließgewässer (ARSCOTT et al. 2001), sodass auch für die Reproduktion des<br />
Steinbeißers geeignete Mikrohabitate vielerorts verloren gegangen sind.<br />
Jedenfalls dürfte es sich beim Steinbeißer um eine der am stärksten gefährdeten Fischarten in<br />
Oberösterreich handeln. Es besteht massiver Handlungsbedarf, die bestehenden Lebensräume<br />
und Bestände zu erhalten und auszuweiten, auch um allfällig lokal angepasste Stämme nicht zu<br />
verlieren.<br />
5.4.5 Defizitanalyse und Maßnahmenvorschläge<br />
Auch beim Steinbeißer handelt es sich um eine Fischart, die im Anhang II der FFH-Richtlinie<br />
ausgewiesen ist. Mehr noch als bei anderen gefährdeten Arten scheint hier eine äußerst dünne<br />
Datenlage in Bezug auf Verbreitung und Bestandsdichten zu herrschen.<br />
Nicht zuletzt aus diesem Grund scheint es wichtig, dass die aktuell bekannten Vorkommen des<br />
Steinbeißers in Oberösterreich besonderen Schutzstatus genießen. Möglich wäre dies unter<br />
anderem durch die Ausweisung des Steinbeißers als Schutzgut im geplanten Natura2000-<br />
Schutzgebiet Machland sowie die Nachführung als Schutzgut im Gebiet Wiesengebiete und Seen<br />
des Alpenvorlandes. Letzteres würde die Ausweitung des Schutzgebietes auf den aktuellen<br />
Fundort des Steinbeißers in der Enknach bei Dietzing notwendig machen.<br />
Obwohl man im Fall des versteckt lebenden und stark an spezifische Mikrohabitate gebundenen<br />
Steinbeißers davon ausgehen kann, dass manche Bestände in der Vergangenheit trotz<br />
Aufnahmen in entsprechenden Gewässern übersehen wurden und auch aktuell noch werden, sind<br />
dramatische Bestandsrückgänge hauptsächlich aufgrund von flussbaulich bedingten<br />
Lebensraumverlusten die Hauptursache für seinen Gefährdungsstatus in Oberösterreich.<br />
Der Unterlauf der Naarn wurde in den 70er Jahren des vergangenen Jahrhunderts massiv reguliert<br />
und begradigt. Die Naarn verfügt in diesem etwa 10 km langen Bereich über keinerlei<br />
nennenswerte Strukturen. Das Gewässer zeigt eine erheblich verringerte Breiten-Tiefen-Varianz,<br />
auch Strömungsgeschwindigkeit und damit Sohlbeschaffenheit variieren kaum. Dieser rithralisierte<br />
Bereich der Naarn bietet dem Steinbeißer offensichtlich keinen geeigneten Lebensraum mehr<br />
60
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
(Abb. 35). Elektrobefischungen ergaben ein sehr eingeschränktes Artenspektrum (6 Arten) für<br />
diesen Bereich der Naarn (SCHEDER & GUMPINGER 2007)<br />
Die Schwemmnaarn, der ehemalige Naarn Unterlauf, wird auf Höhe der Ortschaft Labing aus der<br />
Naarn über ein Schlauchwehr mit 150 bis 500 l/s dotiert. Mehrere kleine Zuflüsse liefern<br />
beträchtliche Mengen an Feinsediment aus der landwirtschaftlich intensiv genutzten Ebene des<br />
Machlandes. Unterseitig muss die Schwemmnaarn über ein Pumpwerk auf das Niveau der, hier<br />
infolge Rückstaus vom unterliegenden Kraftwerk mehrere Meter über der Au liegenden Donau<br />
gehoben werden. Eine direkte Anbindung fehlt auch hier.<br />
Die fehlende hydrologische Dynamik (keine Hochwasserspitzen mit Ausnahme des kleinen<br />
Resteinzugsgebietes der Zubringer) führt dazu, dass starke Ablagerungen von Feinsedimenten im<br />
morphologisch über weite Strecken sehr naturnahen und strukturreichen Gewässerbett stattfinden,<br />
die auch nicht mehr erodiert und abtransportiert werden können (Abb. 35).<br />
Abb. 35: Strukturfreier Unterlauf der Naarn (links) und feinsedimentbelastete Bereiche in der Schwemmnaarn<br />
(rechts).<br />
Die bereits angesprochenen Zuflüsse zur Schwemmnaarn, namentlich Tobrabach, Arbinger Bach,<br />
Deiminger Bach, Starzenbach und Gassoldinger Bach durchfließen den Beckenbereich des<br />
Machlandes und stellen ähnliche Lebensraumbedingungen wie der untersuchte Bereich des<br />
Kleinen Naarnkanals dar. Diese Gewässer konnten in vorliegendem erstem Modul des Projektes<br />
aber aus Budget- und Zeitgründen nicht weiter untersucht werden.<br />
Die Unterläufe dieser Bäche im Bereich der Ebene des Machlands wurden umgelegt, begradigt<br />
und kreuzen sich an einer Stelle sogar. Diese Gerinne sind über weite Bereiche naturfern gestaltet,<br />
werden in Trapezprofilen geführt, die Sohle ist zum Teil gepflastert, Beschattung fehlt fast<br />
durchgängig und die Feinsedimentbelastung ist hoch. Nichtsdestotrotz wurden im Unterlauf des<br />
kleinen Naarnkanal auf kleinräumigen Feinsedimentablagerungen die dichtesten<br />
Steinbeißerbestände des Machlands gefunden.<br />
Großflächige Betträumungen zur Abflussverbesserung in diesen Gerinnen vernichten den ohnehin<br />
lediglich als dürftigen Ersatz einzustufenden Ersatzlebensraum für den Steinbeißer in<br />
regelmäßigen Abständen (Abb. 36). Es muss davon ausgegangen werden, dass die Tiere durch<br />
diese Räumungen nicht nur an Lebensraum verlieren sondern auch direkt aus dem Gewässer<br />
entfernt werden (TATENHORST, 2002). Diesen Eindruck bestätigt auch der hohe Anteil an jüngeren<br />
Individuen an der Steinbeißerpopulation im Machland, verglichen mit dem Fund an dem<br />
ungestörten Gießen-System der Enknach.<br />
61
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 36: Kleiner Naarnkanal kurz nach einer Bachbetträumung.<br />
Durch eine eingehendere und verdichtende Untersuchung der Gewässer im Machland könnten<br />
Daten über die Verbreitung, Bestandsgrößen und die Verteilung des Steinbeißers in<br />
unterschiedlich degradierten Gewässerbereichen erhoben werden. Diese Einsichten sollten als<br />
Basis für ein Konzept zur Lebensraumschaffung und -revitalisierung für diese bedrohte Fischart im<br />
Machland dienen.<br />
Darüber hinaus sollten im Vorfeld der regelmäßig wiederkehrenden Bachräumungen in diesem<br />
Bereich Tiere für die Nachzucht in künstlichen Bachläufen bzw. den Versatz in geeignete<br />
Gewässer im Machland entnommen werden. Kurzfristig könnte auch ein ökologisch orientiertes<br />
Konzept zur „steinbeißerschonenden“ Räumung von Bächen eine Verbesserung der<br />
Bestandssituation im Machland bringen. Mittel- und langfristig kann jedoch nur eine umfassende<br />
Renaturierung der Unterläufe der genannten Bäche in der Ebene des Machlandes sowie des<br />
künstlichen Unterlaufs der Naarn und die Verbesserung der Anbindungssituation der<br />
Schwemmnaarn wertvolle Lebensräume für den Steinbeißer schaffen und die Bestandsgrößen<br />
dieser seltenen Art sichern und erhöhen.<br />
Im Pram-Mittellauf wurde Mitter der 1980er Jahre ein Steinbeißer dokumentiert (JUNGWIRTH et al.<br />
1984). In der ersten Projektsperiode war aus Zeitgründen nur eine sondierende Befischung an<br />
einer Stelle der Pram möglich. Detaillierte Erhebungen entlang der Pram scheinen aber nötig.<br />
Sollte sich bei diesen weiterführenden Untersuchungen bestätigen, dass in der Pram keine<br />
Steinbeißer mehr vorkommen, so könnte eine Wiederansiedelung in diesem Fluss Erfolg<br />
versprechen. Die Wassergüte hat sich seit den 1990ern etwas verbessert, und auch die<br />
besatzbedingt vormals sehr hohen Aaldichten in den 70er und 80er Jahren des letzten<br />
Jahrhunderts gehören in der Pram der Vergangenheit an.<br />
Die Enknach wird seit mehr als 800 Jahren energiewirtschaftlich genutzt. Dies führte schon früh zu<br />
massiven hydromorphologischen Veränderungen im Gewässer. Das Bett wurde über weite<br />
Strecken aus der Tiefenlinie des Tales gehoben, begradigt und durch verschiedenste<br />
Uferverbauungen und –wälle gesichert. Durch diese Veränderungen kam es neben der<br />
dramatischen Abnahme der Strukturausstattung und Breiten-Tiefen-Varianz auch zu einer starken<br />
Rithralisierung der Enknach. Die vereinheitlichte und durchwegs höhere<br />
62
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Strömungsgeschwindigkeit bedingt heute über weite Strecken Substratverhältnisse, die keinen<br />
geeigneten Lebensraum für den Steinbeißer bieten.<br />
Aus aktueller Sicht kommen im ökologisch massiv degradierten Lauf der Enknach lediglich einige<br />
wenige Stellen im Stauwurzelbereich der Wasserkraftanlagen sowie der Mühlen und Sägewerke<br />
bzw. im Mündungsbereich von unterseitig angebundenen Gießen-Systemen als geeigneter<br />
Lebensraum für den Steinbeißer infrage. Diese Areale sind jedoch sehr kleinräumig und oft<br />
mehrere Kilometer voneinander entfernt. Wanderbewegungen zwischen diesen Bereichen sind<br />
zusätzliche durch zahlreiche unpassierbare Querbauwerke unmöglich.<br />
Für den langfristigen Erhalt einer Steinbeißerpopulation in der Enknach ist anzustreben, potentielle<br />
Habitate über den gesamten Lauf des Flusses anzubieten und diese durch geeignete Maßnahmen<br />
auch erreichbar zu machen. Möglichkeiten hierzu bieten die Wiederanbindung bzw. Revitalisierung<br />
von ehemaligen Laufbereichen der Enknach, die Anbindung und Dotation von Gießen-Systemen<br />
sowie eine umfassende ökologisch orientierte Umgestaltung des Flusslaufes in mehreren<br />
Bereichen. Die Installation von Organismenwanderhilfen an den zahlreichen, zumeist<br />
unpassierbaren Querbauwerken würde Wanderbewegungen und damit in einem ersten Schritt die<br />
Erreichbarkeit von und im Weiteren den Austausch zwischen den geschaffenen Habitaten<br />
ermöglichen.<br />
Eine nicht unbeträchtliche Gefahr für die wenigen, verbliebenen Steinbeißerpopulationen in<br />
oberösterreichischen Gewässern geht zudem von einer verfehlten fischereilichen Bewirtschaftung<br />
aus. Diesbezüglich dürfte der Besatz des gebietsfremden Aals besonders negativ wirken und muss<br />
daher im gesamten Einzugsgebiet unterbleiben. Auch der Besatz von fangfähigen Forellen kann<br />
Steinbeißer einem stark erhöhten Räuberdruck aussetzen.<br />
Des Weiteren fehlen an von Steinbeißern besiedelten Gewässern oft Uferschutzstreifen.<br />
Landwirtschaftlich genutzte Flächen reichen oft bis unmittelbar an die Gewässer heran. Dieses<br />
Fehlen von Gehölz bedingt zwar eine höhere Wassertemperatur in den stark rithralisierten<br />
Gewässern durch vermehrte Sonneneinstrahlung, was dem Steinbeißer zugute zu kommen<br />
scheint. Problematisch in diesem Zusammenhang ist jedoch der direkte bzw. indirekte<br />
Nährstoffeintrag aus der Landwirtschaft der die Fließgewässer durch diese Bedingungen<br />
unverhältnismäßig stark in Mitleidenschaft zieht.<br />
Revitalisierungen, die zu morphodynamischen Umlagerungen führen, können den negativen Effekt<br />
übermäßiger Feinsediment- und Nährstoffeinträge wirkungsvoll reduzieren. Durch die dynamische<br />
Sortierung und Umlagerung von Sedimenten entstehen für substratgebundene Fischarten wie<br />
Steinbeißer (aber auch Goldsteinbeißer, Neunaugen etc.) hochwertige Mikrohabitate laufend neu.<br />
5.5 Schlammpeitzger (Misgurnus fossilis)<br />
5.5.1 Allgemeines<br />
Merkmale: Bis 30 cm langer, vorne fast drehrunder, walzenförmiger Körper; unterständiges Maul<br />
mit 6 Bartfäden am Oberkiefer und 4 Bartfäden am Unterkiefer; Bauch- und Rückenflossen nach<br />
hinten verlagert; Rand der Schwanzflosse abgerundet; deutliche Fettkiele an der Schwanzwurzel,<br />
unvollständige Seitenlinie; sehr kleine Schuppen; kein Dorn unter dem Auge; Nasenöffnungen<br />
röhrenförmig verlängert; Grundfärbung meist rotbraun mit am Rücken und an den Flanken zu<br />
Längsbinden vereinigten dunklen Flecken und Punkten; Sekundärer Geschlechtsdimorphismus:<br />
Männchen kleiner, Brustflossen länger, spitz endend; zweiter Brustflossenstrahl verdickt;<br />
Männchen zeigen zur Laichzeit rötlich gefärbte laterale Wülste zwischen Rücken- und Afterflosse<br />
(Abb. 37).<br />
63
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 37: Geschlechtsdimorphismus beim Schlammpeitzger: oben Männchen (TL 185 mm) mit größerer Brustflosse,<br />
verdicktem 2. Flossenstrahl und rötlichem Wulst im Schwanzbereich; unten Weibchen (TL 195 mm) mit<br />
kleinerer Brustflosse.<br />
Biologie: Der Schlammpeitzger gilt als langlebiger Fisch, dem eine Lebensdauer bis über 21<br />
Jahre nachgesagt wird. Die Geschlechtsreife erreicht er mit 2 bis 3 Jahren (STEINBACH, 2002). Für<br />
eine erfolgreiche Fortpflanzung ist eine Wassertemperatur von mehr als 19°C notwendig<br />
(KOTTELAT et al. 2007), wahrscheinlich aber eher von mindestens 24°C (BOHLEN, schriftl. Mittlg.).<br />
In der Zeit von April bis Juli legt das Weibchen etwa 4500 bis 13000 (KOURIL et al. 1996) klebrige,<br />
1,3 bis 1,5 mm große Eier über Wasserpflanzen ab. Die Larven verfügen über eine<br />
morphologische Besonderheit, sie bilden äußere Kiemen in Form von Kiemenfäden, die während<br />
der Metamorphose vom Operculum überdeckt werden. Diese Bildung wird als eine Anpassung an<br />
den geringen Sauerstoffgehalt der bevorzugt besiedelten Gewässer gedeutet. Dem entsprechend<br />
können die Adulttiere atmosphärischen Sauerstoff nutzen, indem sie Luft schlucken, die den Darm<br />
passiert und durch den Anus wieder ausgeschieden wird. Im Schlamm vergraben können sie<br />
dadurch sogar eine temporäre Austrocknung des Gewässers überdauern.<br />
Die Jungfische können unter guten Bedingungen bis zum Ende des ersten Jahres (0+) auf eine<br />
durchschnittliche Länge von 120 mm, am Ende des zweiten Jahres (1+) auf durchschnittlich<br />
193 mm und am Ende des dritten Jahres (2+) auf durchschnittlich 223 mm (KÄFEL, 1993)<br />
heranwachsen.<br />
Der Schlammpeitzger nimmt Schwankungen des Luftdrucks wahr und zeigt vor Gewittern zum Teil<br />
auch unter Tags erhöhte Aktivität. Aus diesem Grund wird er im Volksmund auch als „Wetterfisch“<br />
bezeichnet. Weitere zum Teil nur lokal gebräuchliche Namen sind Schlammbeißer, (Schlamm-<br />
)Bisgurn und Grunzgrundel. Letzerer bezieht sich auf die Laute, die der Schlammpeitzger oft<br />
ausstößt, wenn er gefangen wird.<br />
Autökologie: KÄFEL (1993) beschreibt den ursprünglichen Lebensraum des Schlammpeitzgers als<br />
naturbelassene, dynamische, stehende bis langsam fließende Gewässer mit Schlammgrund.<br />
Dieser Gewässertyp ist heute häufig in verlandenden Altwässern, Grabensystemen und<br />
abgeschnittenen Mäandern realisiert. Früher soll der Schlammpeitzger in seinem osteuropäischen<br />
Verbreitungsgebiet häufig mit dem Hundsfisch Umbra krameri vergesellschaftet vorgekommen<br />
sein (GEYER, 1940). Bereiche mit Makrophytenbewuchs werden von allen Größenstadien deutlich<br />
bevorzugt (MEYER& HINDRICHS, 2000), was als Verhaltensweise gedeutet wird, die Schutz vor<br />
64
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Prädation bietet. Auffallend war im Zuge der vorliegenden Befischungen die Konzentration von<br />
Individuen in Totholzansammlungen in ansonsten strukturarmen Gewässern.<br />
Gegen sommerliche Sauerstoffarmut und Austrocknung der Wohngewässer ist Misgurnus<br />
aufgrund seiner morphologischen Besonderheiten und der Fähigkeit sich tief im schlammigen<br />
Grund seiner Wohngewässer zu vergraben gut gewappnet. Die Besiedelung nicht ständig<br />
angebundener Augewässer(-reste) erfolgt durch aktive Einwanderungen bzw. passive<br />
Verfrachtung während Hochwasserereignissen.<br />
5.5.2 Historische Verbreitung<br />
Österreichweit galten vor allem flussbegleitende Augewässer entlang mäandrierender und<br />
furkierender Fließgewässer wie Donau, Unterer Inn, Untere Salzach, March, Thaya, Mur, Leitha,<br />
Raab, Lafnitz, Strem als Verbreitungsgebiet des Schlammpeitzgers. Auch im Neusiedler See und<br />
im Seewinkel gab es Nachweise dieser Art. In den westlichen Bundesländern Vorarlberg, Tirol und<br />
Kärnten gibt es keine historischen Nachweise des Schlammpeitzgers.<br />
Die älteste verfügbare Quelle in Bezug auf Vorkommen von Schlammpeitzgern in Oberösterreich<br />
führt die Art generell für die Donau und den Inn an (SCHRANK, 1798). FITZINGER (1832) gibt<br />
Hinweise auf bevorzugte Lebensräume der Art und nennt „Flüsse, schlammige Bäche und<br />
Wassergräben“. Ähnliches findet man für Oberösterreich bei KUKULA (1874), der die Art in der<br />
„Donau und ihren sumpfigen Ausbreitungen“ und speziell für die ehemalige Zizlau (Standort der<br />
heutigen VÖST) anführt. HECKEL UND KNER (1858) geben Fundorte an der Donau bei Wien und<br />
Linz an. Daneben soll der Schlammpeitzger auch in der Lainsitz bei Weitra vorgekommen sein.<br />
Auch SIEBOLD (1863), JÄCKEL (1864) und KRAFFT (1874) nennen schlammige Lacken, Altwässer<br />
und „Aulacken der Donau“ als Lebensräume des Schlammpeitzgers.<br />
Die einzige historische Angabe aus dem Einzugsgebiet der Salzach liefert FRAAS (1854), der<br />
Schlammpeitzger auch für den Inn nennt. Die Fischereikarte von KOLLMANN (1898) zeigt die Art<br />
ausschließlich im Plainbach, einem Nebenbach der Fischach stromab von Salzburg. TÜRK et al.<br />
(1996) berichten aus dem Flachgau nahe der Landesgrenze, dass bis in die 1940er Jahre sowohl<br />
der Wallersee als auch die umliegenden Bäche vom Schlammpeitzger besiedelt wurden. Weitere<br />
historische Fundorte sind im Einzugsgebiet der Salzach derzeit nicht bekannt. Bislang konnte nur<br />
BOHL (1995) in einem Altwasser auf bayerischer Salzachseite ein Einzelexemplar belegen, was<br />
darauf schließen lässt, dass der Schlammpeitzger auch ursprünglich in Augewässern der Unteren<br />
Salzach vorgekommen ist.<br />
Historische Hinweise auf Vorkommen von Schlammpeitzgern in den Augewässern der Traun sind<br />
nicht bekannt. Allerdings befinden sich zwei Exemplare aus dem Jahr 1901 in der Fischsammlung<br />
des Naturhistorischen Museums in Wien (WELLENDORF, schriftl. Mittlg), deren Fundort mit „Traun“<br />
angegeben ist. Leider fehlt eine konkretere Ortsbezeichnung.<br />
Alte Beschreibungen von Bestandsdichten oder Fangzahlen fehlen leider weitgehend.<br />
Diesbezüglich ist der Hinweis von FITZINGER (1874) relevant, der die Art als „in der Donau usw.<br />
gemein“ beschreibt. Eine Zahl findet man in der Liste von KERSCHNER (1956), der im Jahr 1905 am<br />
Fischmarkt in Linz 310 Individuen angibt. Dies zeigt, dass Schlammpeitzger wohl nicht selten<br />
waren und offenbar auch kulinarisch verwertet wurden.<br />
MERWALD (1960) bezeichnet den Schlammbeißer als einen im Schlamm des Steyregger Grabens<br />
häufig gefangenen Fisch, bemerkt aber den allgemeinen Rückgang der Fischfauna in diesem<br />
Bereich der Donau durch die Abkopplung des Grabens vom Hauptstrom und eine damit<br />
einsetzende Verlandung. Der Schlammpeitzger wird in einer zweiten Liste von Merwald auf einen<br />
seltenen Fang in kleineren Tümpeln im Herbst zurückgestuft. Diese Einschätzungen beziehen sich<br />
auf den Zeitraum von 1931 bis 1960.<br />
Aus den siebziger Jahren datiert der Fund eines Schlammpeitzgers aus einem Altarm der Pram<br />
bei Taufkirchen (GRIMS, mündl. Mitt.).<br />
65
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Bauern im Eferdinger Becken berichten von dichten Vorkommen des Schlammpeitzgers, der<br />
immer wieder in die Pumpen der Feldbewässerungssysteme gesaugt wurde und diese verstopfte.<br />
Noch in den achtziger Jahren traten auf diese Weise regelmäßig Schlammpeitzger in Erscheinung<br />
(LUGMAIR, mündliche Mitteilung).<br />
Zusammenfassend ist zu rekonstruieren, dass der Schlammpeitzger ursprünglich in den<br />
Augewässern entlang der großen Flüsse Oberösterreichs weit verbreitet war. Vor allem die<br />
Furkationszonen in den Beckenlagen von Salzach, Inn, Donau und Traun dürften entsprechende<br />
Lebensräume geboten haben. Weiters sind Vorkommen in fluss- und seenbegleitenden<br />
Feuchtgebieten sowie Altarmen („oxbows“) kleinerer, mäandrierender Fließgewässer wie<br />
beispielsweise Krems, Aschach, Innbach oder Pram als sehr wahrscheinlich anzunehmen,<br />
wenngleich sie hier nur eingeschränkt durch entsprechende historische Quellen belegt sind. Auch<br />
Bestände in künstlichen Gewässern der frühen Kulturlandschaft wie Entwässerungsgräben, Lösch-<br />
und Fischteichen etc. sind anzunehmen, haben jedoch nicht in die verfügbare historische Literatur<br />
Einzug gehalten.<br />
5.5.3 Aktuelle Verbreitung<br />
Das aktuelle Verbreitungsgebiet des Schlammpeitzgers in Österreich ist mit Sicherheit deutlich<br />
geringer, als das historisch bekannte Verbreitungsgebiet.<br />
Verbreitungsschwerpunkte liegen aktuell noch im flussbegleitenden Altarmsystem der<br />
niederösterreichischen Donau. Mit Ausnahme der Auen östlich von Wien bestehen aber auch hier<br />
große Wissensdefizite über aktuelle Bestände und Populationsgrößen. Vorkommen gibt es weiters<br />
entlang der unteren Thaya und March und in Augewässern entlang der Grenzmur und Lafnitz. Im<br />
burgenländischen Seewinkel ist diese Art in der Langen Lacke nachgewiesen, im Neusiedler See<br />
selbst gilt sie als verschollen (HERZIG et al. 1994). Der Schlammpeitzger fehlt in den<br />
westösterreichischen Bundesländern Vorarlberg, Tirol, Salzburg und Kärnten.<br />
In Oberösterreich war vor der Durchführung der Freilandarbeiten des Kleinfischprojekts der<br />
Schlammpeitzger rezent nur an einem Fundpunkt im Machland nachgewiesen.<br />
Im Rahmen dieses Projektes wurde an 73 Probestellen, das sind 42,4% aller befischten<br />
Gewässer, nach dem Schlammpeitzger gesucht. In elf davon, also in 15,1% der spezifischen<br />
Probestellen, konnte die in Österreich vom Aussterben bedrohte Art (WOLFRAM & MIKSCHI 2007)<br />
nachgewiesen werden. Dazu ist zu sagen, dass in manchen Gebieten fast alle noch vorhandenen,<br />
stagnierenden Gewässer befischt wurden, und. auf weiten Strecken zwischen den Zielgebieten<br />
kaum oder überhaupt keine geeigneten Kleingewässer mehr erhalten sind.<br />
Die neuen Nachweise befinden sich im Machland, Eferdinger Becken und in den Traun-Krems-<br />
Auen östlich von Linz (Abb. 38). Weitere Exemplare wurden im Oktober 2008 in den Innauen bei<br />
Mühlheim entdeckt (MÖRTELMAIER, schriftliche Mitteilung).<br />
66
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 38 Rezente Fundorte des Schlammpeitzgers und neue Fundorte (zum Großteil im Rahmen des<br />
Kleinfischprojekts)<br />
Insgesamt wurden bei den Elektrobefischungen im Jahr 2008 265 Schlammpeitzger<br />
nachgewiesen. Die überwiegende Mehrzahl (n = 212) davon kommt aus Gewässern des<br />
Eferdinger Beckens. Im Machland wurden 40 Individuen entdeckt, in einem Grabensystem der<br />
Traun-Krems-Auen konnten elf Tiere gefangen werden und eine Elektrobefischung in den Innauen<br />
ergab den Nachweis von zwei Schlammpeitzgern.<br />
Die 263 vermessenen Individuen waren zwischen 75 und 255 mm (Abb. 39). Gewogene Individuen<br />
(n = 152) waren zwischen vier und 84 g schwer. Das Geschlecht der gefangenen<br />
Schlammpeitzger wurde soweit möglich vor Ort bestimmt (n = 98). Diese Erfassung ergab ein<br />
Geschlechterverhältnis von 53:47 (m:w).<br />
67
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Frequenz<br />
35<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270<br />
TL [mm]<br />
Eferdinger Becken (n=212)<br />
Machland (n=40)<br />
Traunauen (n=11)<br />
Abb. 39: Längen-Frequenz-Diagramm der gefangenen Schlammpeitzger<br />
Kleine Individuen um 130 mm Körperlänge dominieren die Populationen im Eferdinger Becken und<br />
im Machland. Diese Tiere werden als Altersklasse 1+ interpretiert, entstammen also der<br />
Fortpflanzungsperiode 2007. Die Schlammpeitzgerfunde im Eferdinger Becken, im Machland und<br />
in den Traunauen sind offenbar selbst reproduzierende Populationen.<br />
Die zweigipfelige Verteilung der Individuen im Bereich von 110 bis 130 mm in den Populationen<br />
des Eferdinger Beckens und Machlands ist höchstwahrscheinlich durch unterschiedliches<br />
Wachstum der Jungtiere in Habitaten mit differierenden Nahrungsbedingungen und<br />
Wassertemperaturen zurückzuführen.<br />
Größere Individuen dürften im Fangergebnis dominant aufscheinen, da sie unter den schwierigen<br />
Befischungsbedingungen (Feinsediment, Wassertrübe, Wasserpflanzenbewuchs, Totholz,…)<br />
leichter auszumachen sind als juvenile Schlammpeitzger und stärker auf das elektrische Feld<br />
reagieren. Larven bzw. 0+ Individuen konnten in keinem der Habitate nachgewiesen werden. Dies<br />
ist allerdings höchstwahrscheinlich nicht auf eine fehlende Reproduktion im Frühjahr 2008<br />
zurückzuführen sondern methodisch bedingt.<br />
Ausgewachsene Männchen erreichten eine Maximallänge von 195 mm, Tiere mit mehr als<br />
200 mm Körperlänge waren ausnahmslos weiblichen Geschlechts.<br />
5.5.4 Diskussion<br />
Der aus Oberösterreich einzige vor Projektbeginn bekannte Fundort, ein Grabensystem im<br />
Machland, fließt auf einer Länge von ca. 2 km nördlich der Schwemmnaarn zwischen Eitzendorf<br />
und Saxendorf und wird von kleinen Bächen, Hang- und Sickerwässern gespeist. Der Abfluss ist<br />
sehr gering, der Wasserstand ist vom Grundwasserspiegel abhängig. Die Sohle trägt eine starke<br />
Feinsedimentauflage und der Wasserkörper ist zum Teil dicht von Wasserpflanzen durchwachsen.<br />
Totholz bildet zahlreiche Strukturen im schwach durchströmten Bett (Abb. 40).<br />
68
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 40: Grabensystem zwischen Eitzendorf und Saxen im Machland.<br />
Das Grabensystem ist von mehreren Feldwegen unterbrochen, eine Verbindung der Abschnitte<br />
besteht nur über zum Teil baufällige, schlecht gewartete Rohrdurchlässe. Über den gesamten,<br />
langsam fließenden Teil des Grabensystems wurden an mehreren Stellen Schlammpeitzger<br />
nachgewiesen. Weiters kommen in diesem Grabensystem auch Hecht, Schleie, Aitel,<br />
Marmorgrundel, Blaubandbärbling, Giebel, Karausche, Stichling, Aalrutte, Laube und Flussbarsch<br />
vor (Abb. 42).<br />
Bei Saxendorf münden zuerst der Klambach und kurz darauf der Saxner Bach in das Gewässer,<br />
dessen Charakter sich damit völlig ändert. Ein höherer Abfluss und stärkeres Gefälle bedingen<br />
höhere Strömungsgeschwindigkeiten, das Substrat wird sandig bis kiesig. Flächige<br />
Wasserpflanzenbestände fehlen weitgehend. In diesem Bereich konnten keine Schlammpeitzger<br />
nachgewiesen werden.<br />
Zusätzlich konnte im Machland ein weiteres Gewässer mit einem Bestand an Schlammpeitzgern<br />
gefunden werden. Im Bereich von Mettensdorf liegt südlich der Schwemmnaarn der Rest eines<br />
Altarms, der aktuell nur mehr bei Hochwasser unterseitig an die Schwemmnaarn angebunden ist.<br />
Das Gewässer zeigt eine starke Verlandungstendenz und ist in mehrere Becken unterteilt, die zum<br />
Teil über den Sommer austrocknen. Im westlichsten Becken wurde das Begleitgehölz in einem<br />
Abschnitt entfernt und das Gewässer ausgebaggert. Vor allem in diesem besonnten Bereich<br />
konnten einige Individuen des Schlammpeitzgers gefangen werden. Neben Karausche, Giebel,<br />
Schleie und Blaubandbärbling sind in diesem Altarmsystem vor allem Amphibien zu finden. Der<br />
Fang eines Weißflossengründlings, also einer rheophile Donauart, deutet auf rezente Hochwasser-<br />
und Anbindungsereignisse in diesem Bereich des Machlandes hin.<br />
Bei dem Fundort in den Traun-Donauauen handelt es sich um ein Grabensystem im Tagerbach-<br />
Schwaigau-System. Dieses setzt sich bis in das Mitterwasser fort, das im Unterwasser des<br />
Kraftwerkes Abwinden-Asten in die Donau mündet. Im Bereich des Fundortes wurde das<br />
Gewässer auf ca. 250 m Länge ausgebaggert, sodass ein etwa 5 m breiter und 1 m tiefer<br />
Wasserkörper entstanden ist, der auf einer Seite durch Schilfbewuchs und auf der anderen Seite<br />
von Grünland begrenzt ist. Die Schlammpeitzger hielten sich ausschließlich direkt im Schilf bzw.<br />
an der Schilfkante auf. Es ist anzunehmen, dass der Schlammpeitzgerbestand auch die<br />
69
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
seichteren, nicht aktuell vertieften Abschnitte des Grabensystems besiedelt. Quantitativ überwiegt<br />
auch hier in der Begleitfauna ein stagnophiles Fischartenspektrum (Rotfeder, Karausche, Schleie),<br />
allerdings treten vereinzelt auch Arten mit stärkerem Donaubezug wie Nerfling und Güster auf.<br />
Dies belegt die Anbindung des Gewässers bei Hochwasserereignissen.<br />
Im Eferdinger Becken liegen die Fundorte des Schlammpeitzgers ausschließlich im Bereich südlich<br />
der Donau. Hier sind es vor allem reliktäre Grabensysteme westlich der Ortschaft Gstocket, die<br />
unterwasserseitig an den Innbach angebunden sind bzw. als Ofenwasser bei Fall in den Innbach<br />
münden. Diese Gräben sind zum Teil von kleinen Bächen gespeist, der Wasserstand ist zudem<br />
stark vom Grundwasserspiegel abhängig. In sommerlichen Niederwasserphasen trocknen die<br />
stark verlandenden Gräben über weite Bereiche aus. An Wasserflächen bleiben dann nur im<br />
Rahmen von Amphibienschutzprojekten gebaggerte Tümpelketten in den Grabensystemen bzw.<br />
die unmittelbaren Mündungsbereiche der kleinen Zuflüsse übrig (Abb. 41).<br />
Abb. 41: Rückzugsbereiche des Schlammpeitzgers in den Gräben des Eferdinger Beckens: künstlich angelegte<br />
Eintiefungen für Amphibien.<br />
Vor allem das landwirtschaftlich intensiv genutzte Einzugsgebiet, die fehlenden<br />
Hochwasserereignisse und pflanzliches Material aus den säumenden Begleitgehölzen sorgen für<br />
starke Schlammauflagen. Lokal wird Grundwasser als Waschwasser für die Gemüseernte<br />
gefördert und fließt in diese Gräben ab. Dies sorgt für den stoßweisen Eintrag von kaltem,<br />
sedimentbeladenem Wasser. In manchen Bereichen wurden die Grabensysteme aufgeweitet und<br />
werden aktuell als Fischteiche genutzt. Die Grabensysteme sind durch zahlreiche Feldwege,<br />
Aufschüttungen und Teichdämme in lose Ketten häufig nicht miteinander verbundener Tümpel<br />
unterbrochen.<br />
70
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
In den austrocknungsgefährdeten Grabenbereichen kommen Schlammpeitzger zusammen mit<br />
Karausche, Giebel, Schleie und Hecht vor. In den aufgeweiteten und zum Teil fischereilich<br />
bewirtschafteten Bereichen mit ganzjähriger Wasserführung wurden darüber hinaus noch Karpfen,<br />
Blaubandbärbling, Marmorgrundel, Rotauge, Rotfeder und Bitterling gefunden (Abb. 42).<br />
Der Großteil der mit dem Schlammpeitzger vergesellschafteten Arten bevorzugt stehende<br />
Gewässer (fünf limnophile Arten) beziehungsweise verfügt über keine ausgeprägte<br />
Strömungspräferenz (zwölf indifferente Arten).<br />
Stellen<br />
18<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
Mi.fo<br />
Ca.au<br />
Es.lu<br />
Ti.ti<br />
Ca.ca<br />
Ps.pa<br />
Cy.ca<br />
Ga.ac<br />
Le.ce<br />
Schlammpeitzger, Misgurnus fossilis<br />
Pe.fl<br />
Pr.ma<br />
Ru.ru<br />
Abb. 42: Sympatrisches Auftreten mit Schlammpeitzgern. Blau ... rheophil; grau ... oligorheophil; grün ... indifferent;<br />
rot ... limnophil<br />
Die Liste der sympatrisch mit dem Schlammpeitzger vorgefundenen Arten steht in einer sehr guten<br />
Übereinstimmung mit der hydromorphologischen Charakteristik der von dieser Fischart bevorzugt<br />
besiedelten Habitate. Es handelt sich dabei überwiegend um schwach durchströmte,<br />
makrophytenreiche Gräben bzw. ehemalige Nebenarmsysteme mit massiven<br />
Feinsedimentablagerungen und zahlreichen, vor allem von Totholz gebildeten Strukturen.<br />
Interessant ist in diesem Zusammenhang, dass sich eine zu starke Beschattung der Gewässer<br />
sowie extreme Verlandungssituationen bzw. das komplette Durchwachsen des Wasserkörpers mit<br />
Makrophyten negativ auf den Schlammpeitzger auszuwirken scheinen. In solcherart<br />
beeinträchtigten Gewässern konnte, manchmal trotz unmittelbarer Nähe zu besiedelten<br />
Gewässern, kein Nachweis dieser gefährdeten Fischart erbracht werden.<br />
Im Mettensdorfer Altarm war die Konzentration der Schlammpeitzger im besonnten und vor<br />
kurzem ausgebaggerten Gewässerbereich auffällig.<br />
Mit der fortschreitenden Sukzession von Gewässern scheinen diese ab einem gewissen Zeitpunkt<br />
keinen geeigneten Lebensraum mehr für den Schlammpeitzger darzustellen. In funktionierenden<br />
Auensystemen sorgen wiederkehrende Hochwässer unterschiedlicher Intensität natürlicherweise<br />
für eine Neu- bzw. Umgestaltung der aquatischen Lebensräume und deren unmittelbare<br />
Uferbereiche und durchbrechen somit die Verlandungstendenzen und zunehmende Beschattung<br />
der von Schlammpeitzgern besiedelten Gewässer. Der Schlammpeitzger ist ein auf diese<br />
natürliche Dynamik angewiesener Bewohner unserer Auensysteme.<br />
Sc.er<br />
Ab.bj<br />
Al.al<br />
Ba.br<br />
Le.id<br />
Lo.lo<br />
Rh.am<br />
71
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Der hohe Degradationsgrad der verbliebenen Auen entlang der oberösterreichischen<br />
Fließgewässer und der daraus resultierende Verlust an geeignetem Lebensraum bedingt somit<br />
den starken Gefährdungsstatus dieser Art.<br />
Das Fehlen einer natürlichen Dynamik macht punktuelle menschliche Eingriffe notwendig, um die<br />
bevorzugten Lebensräume dieses Fisches zu erhalten. So wirken z.B. die künstlichen Eintiefungen<br />
in den Grabensystemen im Eferdinger Becken in Niederwasserperioden als kleinräumige<br />
Rückzugsgebiete und enthalten vor allem im Hochsommer hohe Dichten an Schlammpeitzgern.<br />
Ohne erhaltende Maßnahmen fallen diese künstlich geschaffenen Sekundärbiotope jedoch rasch<br />
der hohen Verlandungstendenz der Grabensysteme des Gebietes zum Opfer.<br />
Abb. 43: Verlandende Eintiefungen in den Grabensystemen des Eferdinger Beckens fallen im Sommer oft über<br />
längere Zeit trocken.<br />
5.5.5 Defizitanalyse und Maßnahmenvorschläge<br />
Der Schlammpeitzger ist im Anhang II der FFH Richtlinie der Europäischen Union gelistet und<br />
genießt dadurch einen besonderen Schutzstatus. Österreich verpflichtete sich zur Umsetzung der<br />
FFH-Richtlinie, was unter anderem bedeutet, dass Schutzgebiete für diese Art ausgewiesen,<br />
Bestandsentwicklungen verfolgt und gegebenenfalls Maßnahmen für die Erreichung des günstigen<br />
Erhaltungszustandes gesetzt werden müssen.<br />
Gerade für das oberösterreichische Landesgebiet fehlten jedoch die dafür notwendigen<br />
Grundlagendaten in Bezug auf Verbreitung und Bestandsgrößen der in Österreich vom Aussterben<br />
bedrohten Fischart.<br />
Die im Rahmen des Kleinfischprojektes durchgeführten Freilanduntersuchungen stellen im<br />
Landesgebiet erstmalig systematische Erhebungen dar. Im Zuge dieser Erhebungen konnten<br />
mehrere Schlammpeitzgerbestände in Oberösterreich nachgewiesen werden. Positive Nachweise<br />
konnten jedoch nur in einzelnen Gewässern erbracht werden. Im Großteil der vom<br />
Schlammpeitzger potentiell besiedelbaren Habitate in den untersuchten Gebieten wurden keine<br />
Vertreter dieser Zielfischart nachgewiesen. Die ermittelten Bestände sind aktuell reproduktiv.<br />
72
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Aus fachlicher Sicht sollte der Schlammpeitzger jedenfalls als Schutzgut in den geplanten<br />
Natura2000-Schutzgebieten Machland, Traun-Donau-Auen und Unterer Inn bzw. Auwälder am<br />
unteren Inn aufscheinen bzw. nachgeführt werden.<br />
Die aktuell bekannten Bestände sind in jedem Fall als reliktär anzusehen. Wird nicht aktiv<br />
gegengesteuert, kann davon ausgegangen werden, dass sich die negative Entwicklung der letzten<br />
Jahrzehnte in Bezug auf Bestandszahlen und Verbreitung im Landesgebiet unvermindert<br />
fortsetzen wird, was in letzter Konsequenz zum Aussterben dieser Art in Oberösterreich führt.<br />
Die Hauptursache für den drastischen Rückgang dieser stark gefährdeten Art ist der Verlust<br />
geeigneter Lebensräume und, infolge der Regulierung der großen Flüsse bzw. der zahllosen<br />
Veränderungen hinsichtlich der Gewässerdynamik, das Fehlen einer natürlichen Neubildung.<br />
Durch die massive Regulierung und hydroelektrische Nutzung der größeren Flüsse kam es zu<br />
einer großflächigen Abkopplung des Gewässerumlandes vom Hauptstrom. Die für den Erhalt<br />
natürlicher Fluss-Au-Systeme obligatorische, ständige Umlagerung von Haupt- und Nebenarmen<br />
(vgl. HOHENSINNER et al. 2004) kann heute nicht mehr statt finden. Hochwasserschutzmaßnahmen<br />
führen zur überwiegenden Abfuhr von Hochwässern im Flussbett selbst. Früher regelmäßige und<br />
in ihrer Intensität stark variierende Überschwemmungen der Augebiete bleiben aus oder<br />
unterliegen nicht mehr den natürlichen hydrologischen und zeitlichen Schwankungen. Dies führt<br />
neben der Absenkung des Grundwasserniveaus vor allem zur Abnahme der natürlichen Dynamik<br />
in den Auensystemen. Diese hochwassergespeiste Dynamik führt natürlicherweise zur Neu- bzw.<br />
Umgestaltung von aquatischen Lebensräumen sowie dem Austausch von Sediment, Nährstoffen,<br />
Pflanzen und Tieren zwischen verschieden stark an den Hauptstrom angebundenen aquatischen<br />
Habitaten. Die Augebiete entlang der Donau und größeren Flüsse in Oberösterreich sind stark<br />
bedrohte Lebensräume.<br />
Zusätzlich kommt es in den landwirtschaftlich intensiv genutzten Ebenen der Augebiete zur<br />
Abtrennung, Verfüllung bzw. Drainage von Nebenarmen, stagnierenden Altwässern und<br />
Feuchtgebieten. Dieser zusätzliche Verlust an Lebensraum bedroht spezialisierte und<br />
konkurrenzschwache Arten wie den Schlammpeitzger besonders.<br />
Darüber hinaus kann die fischereiliche Nutzung bzw. der Besatz mit standortfremden Fischarten<br />
negative Auswirkungen auf Schlammpeitzgerpopulationen in Gewässern haben. Im Neusiedlersee<br />
wird unter anderem der Räuberdruck durch die besetzten Aale für das Verschwinden von<br />
Misgurnus verantwortlich gemacht (WANZENBÖCK & KERESZTESSY, 1991; HERZIG et al. 1994). Dies<br />
wäre auch ein plausibler Grund, warum in den Innauen in einer Reihe gut geeigneter Gewässer<br />
keine Schlammpeitzger mehr gefunden werden konnten. Aufgrund der intensiven Aal-<br />
Besatzmaßnahmen in den vergangenen Jahrzehnten traten hier auch in den Augewässern hohe<br />
Aal-Dichten auf.<br />
Eine weitere potentielle Bedrohung für den heimischen Schlammpeitzger könnte von der<br />
Einschleppung nicht heimischer Schlammpeitzger-Arten ausgehen, wie dem Ostasiatischen<br />
Schlammpeitzger (Misgurnus anguillicaudatus), der in Deutschland bereits den Schritt aus dem<br />
Zierfischhandel zu Populationen im Freiland geschafft hat (FREYHOF & KORTE, 2005).<br />
Zur Förderung des stark bedrohten Schlammpeitzgers in Oberösterreich kommen unter<br />
Berücksichtigung der neu hinzugekommenen Fundorte mehrere, idealerweise auf das jeweilige<br />
Vorkommen abgestimmte Maßnahmen in Frage.<br />
Generell sollte der Besatz von standortfremden bzw. eingeschleppten Fischarten wie Katzenwels,<br />
Sonnenbarsch oder Aal in Lebensräume des Schlammpeitzgers unbedingt unterbleiben. Negative<br />
Auswirkungen durch Konkurrenz um Nahrung und Lebensraum bzw. durch direkte Prädation<br />
scheinen wahrscheinlich (WALLNER, 2005).<br />
Die Neubildung bzw. Aufwertung von Habitaten kann durch ambitionierte<br />
Gewässervernetzungsprogramme und die Dynamisierung von Altarmsystemen initiiert werden (vgl.<br />
73
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
ZAUNER et al., 2006). Nur derartige Maßnahmen können langfristig den Erhalt von geeigneten<br />
Kleingewässern für den Schlammpeitzger gewährleisten. Dieser Aspekt kann im Zuge von<br />
Revitalisierungsmaßnahmen nur dann erreicht werden, wenn eine starke Umlagerungsdynamik<br />
entsteht, die zur Verlagerung von Armen und Neubildung von stagnierenden Gewässern führt.<br />
Eine unreflektierte, adynamische Dotation von Augewässern mit Fluss- oder kühlem Qualmwasser<br />
kann hingegen im ungünstigsten Fall die Verlandung bestehender Kleingewässer verstärken bzw.<br />
durch die Veränderung der Strömung, des Temperaturregimes oder der Wasserqualität<br />
stagnophile Fischartengesellschaften zum Verschwinden bringen.<br />
Ein umfangreiches Maßnahmenpaket hat sich schon bei der Erhaltung der letzten<br />
Hundsfischbestände Österreichs, im Rahmen eines Life-Projektes, im Altarmsystem „Fadenbach“<br />
zwischen Orth an der Donau und Eckartsau in Niederösterreich, bewährt (siehe:<br />
http://www.donauauen.at/files/266_NPDA_11_2006_Spindler_Hundsfisch_Fadenbach.pdf und<br />
http://www.fadenbach.at/Hundsfisch.php).<br />
Beim ebenfalls natürlicherweise in kleinräumigen Habitaten vorkommenden Schlammpeitzger kann<br />
auch die Neuschaffung von Kleingewässern in Kombination mit Besatzmaßnahmen zielführend<br />
sein.<br />
Die in den Innauen bei Mühlheim gefundene Population würde sich aus biogeographischer Sicht<br />
am besten für die Etablierung einer ausstrahlenden Gründerpopulation in den Salzachauen,<br />
Innauen und im westlichen Donaugebiet eignen. Zum gegenwärtigen Zeitpunkt ist nicht klar, wie<br />
individuenstark diese Innpopulation ist. Es muss jedoch davon ausgegangen werden, dass nicht<br />
beliebig viele Individuen für den Versatz in geeignete Gewässer umliegender Gebiete entnommen<br />
werden können. Es besteht natürlich auch die Möglichkeit, Schlammpeitzger aus der Innpopulation<br />
zu entnehmen und in ein Nachzuchtprogramm zu überführen. Dies könnte die Gewinnung von<br />
Jungtieren in ausreichenden Mengen für Versatz- und Besatzprogramme in geeigneten, in vielen<br />
Fällen erst zu schaffenden, Gewässern des Salzach-Inn-Donau-Systems ermöglichen.<br />
Diese Maßnahme wird jedoch erst sinnvoll, wenn in geeigneten Gebieten dieses Oberösterreich<br />
durchziehenden Flussverbundes auch besiedelbare aquatische Habitate zur Verfügung stehen, die<br />
als Trittsteine für die flussabwärtige Ausbreitung des Schlammpeitzgers dienen können. Vor allem<br />
im westlichen Donaubereich ist das zurzeit nicht der Fall.<br />
Ein wichtiger erster Schritt für den langfristigen Schutz und die Förderung des Schlammpeitzgers<br />
in Oberösterreich besteht demnach in der Ausarbeitung eines Konzeptes zur Schaffung und<br />
Vernetzung von Lebensräumen für diese Art im Bundesland. In Oberösterreich besteht die<br />
günstige Ausgangssituation, dass die naturnahen Auwaldgebiete zu einem Gutteil in Natura 2000<br />
Gebieten (Salzachauen, Ettenau, Unterer Inn, Oberes Donautal, Machland) liegen. Als<br />
Trittsteinbiotope sind allerdings auch Populationen zwischen diesen Gebieten von hoher<br />
Bedeutung.<br />
Unmittelbare, kurzfristig zu setzende Maßnahmen bieten sich unter anderem im Eferdinger<br />
Becken an. Anthropogen geschaffene Eintiefungen in den Grabensystemen des südlichen<br />
Eferdinger Beckens beherbergen hier aktuell Restbestände des Schlammpeitzgers. Der Großteil<br />
der Graben-, Alt- und Nebenarmsysteme des Eferdinger Beckens existiert aber aktuell nicht mehr.<br />
Der Rest fällt durch Grundwasserabsenkung, fehlende Dynamik des Auensystems sowie massive<br />
Verlandungstendenzen infolge Feinsedimenteintrags aus der Landwirtschaft mehrmals im Jahr<br />
über weite Bereiche trocken. Durch eine gezielte Schaffung von Tümpelketten in unterschiedlichen<br />
Bereichen der verbliebenen Grabensysteme würden geeignete Rückzugsbiete für die lokale<br />
Population geschaffen beziehungsweise vergrößert.<br />
Die bisweilen durchgeführte großflächige Räumung der Grabensysteme zur Abflussverbesserung<br />
ist abzulehnen, da diese Räumungen das Habitat des Schlammpeitzgers massiv beeinträchtigen<br />
und es dazu über weite Bereiche zur Entfernung der letzten verbliebenen Individuen aus den<br />
Gräben kommt.<br />
74
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Mögliche Wanderhindernisse in den Grabensystemen, beispielsweise Wegunterquerungen, Wälle,<br />
Dämme und Teiche, sollten durchgängig gemacht werden, um die Ausbreitung der reliktären<br />
Schlammpeitzgerbestände in neu geschaffene bzw. revitalisierte Bereiche des Grabensystems zu<br />
ermöglichen und damit eine Verbesserung der Bestandssituation durch natürliche Ausbreitung zu<br />
erreichen. Darüber hinaus scheinen manche Subpopulationen im Eferdinger Becken geeignet zu<br />
sein, um laichreife Individuen in geeignete, zum Teil zu revitalisierende bzw. neu zu schaffende<br />
Gewässer zu versetzen und die Besiedelung neuer Gewässer auf diese Weise initiieren zu<br />
können.<br />
Gerade aus den oben genannten Gründen scheint eine verdichtende weitere Nachsuche nach<br />
Gewässern mit Schlammpeitzgerpopulationen im Eferdinger Becken sinnvoll. Vor allem im<br />
nördlichen Eferdinger Becken sowie im westlichen Teil des südlichen Beckenbereiches gibt es<br />
Gewässer mit Lebensraumpotential für diese Art, die im ersten Untersuchungsjahr noch nicht<br />
berücksichtigt werden konnten.<br />
Das von Schlammpeitzgern besiedelte Grabensystem im Machland ist weitgehend naturbelassen<br />
und weist eine hohe Strukturvielfalt auf. Hier sind lediglich die, durch landwirtschaftliche Wege<br />
bedingten, Wanderhindernisse im Längsverlauf als problematisch zu erwähnen. Die ökologisch<br />
orientierte Sanierung dieser Wanderhindernisse würde die Bewegung der aquatischen Fauna im<br />
Längsverlauf des Grabens ermöglichen. Das Gewässersystem sollte auf keinen Fall durch<br />
Zuschüttungen bzw. Grundwasserspiegelmanipulationen in seinen Dimensionen beeinträchtigt<br />
werden. Der Besatz mit standortfremden bzw. eingeschleppten Fischarten sowie eine intensive<br />
fischereiliche Nutzung müssen unterbleiben.<br />
Der Altarm im Bereich von Mettensdorf weist in Teilen eine gute Dichte an Schlammpeitzgern auf.<br />
Eine teilweise Räumung der Ufervegetation bzw. die Eintiefung von Abschnitten in dem stark<br />
verlandenden Beckensystem, die Verbindung der Becken untereinander sowie eventuell eine<br />
Anbindung an die Schwemmnaarn scheinen passend, um die Schlammpeitzgerpopulation in<br />
diesem Gewässer zu fördern.<br />
Zusätzlich sollte eine Nachsuche nach Schlammpeitzgern in den Gewässern des ehemaligen<br />
Steyregger Grabens durchgeführt werden. MERWALD (1960) gibt für dieses Gebiet Funde des<br />
Schlammpeitzgers bis in die 60er Jahre an.<br />
Die aus der Befischung von zahlreichen potentiellen Schlammpeitzgerhabitaten ermittelten<br />
Erfahrungen können in die Revitalisierung von bestehenden bzw. die Schaffung von neuen<br />
Gewässern als Lebensraum einfließen. Vor allem im Machland, im Eferdinger Becken und in den<br />
Innauen gibt es zahlreiche Gewässer, die aufgrund der fehlenden Dynamik starke<br />
Verlandungstendenzen bzw. durch dichte Ufervegetation oder sekundäre Auwälder zu wenig<br />
Besonnung aufweisen (Abb. 44) und damit aus heutiger Sicht keinen geeigneten Lebensraum<br />
mehr für den Schlammpeitzger darstellen. In vielen Fällen könnte die partielle bzw. flächige<br />
Eintiefung und / oder Entfernung von Gehölz die Gewässer als Lebensraum für den<br />
Schlammpeitzger aufwerten bzw. wieder besiedelbar machen. Kommt es dabei zu Konflikten mit<br />
anderen gefährdeten Organismengruppen (Amphibien, Makrophyten, Verlandungsgesellschaften),<br />
so können alternativ neben den bestehenden Gewässern neue Tümpel und Gräben geschaffen<br />
werden.<br />
75
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 44: Diese Gewässer mit Revitalisierungspotential könnten in Zukunft als Lebensraum für den<br />
Schlammpeitzger dienen.<br />
Auf diese Weise könnte mit überschaubarem finanziellem Aufwand der besiedelbare Lebensraum<br />
für diese Fischart sowohl quantitativ als auch geographisch ausgeweitet werden.<br />
In den heutigen flussbegleitenden Auensystemen bieten sich aufgrund der Stauhaltung,<br />
Abdämmung und Eintiefung der Hauptflüsse leider nur mehr eingeschränkt Möglichkeiten,<br />
Kleingewässer so anzulegen, dass organogene Sedimente durch Hochwasserereignisse wieder<br />
ausgetragen werden und die Verlandung langfristig hintan gehalten wird. Daher werden sowohl bei<br />
neuangelegten als auch revitalisierten Gewässern teilweise wiederkehrende<br />
Erhaltungsmaßnahmen notwendig sein. Nicht zuletzt um Austauschprozesse zwischen<br />
Schlammpeitzger-Subpopulationen zu ermöglichen ist jedoch anzustreben, Gewässer so<br />
anzulegen, dass sie bei größeren Hochwässern untereinander bzw. mit dem Hauptstrom<br />
kommunizieren<br />
5.6 Karausche (Carassius carassius)<br />
5.6.1 Allgemeines<br />
Merkmale: Körper hochrückig, seitlich abgeflacht, Länge meist 5-25 cm, maximal 55 cm; Maul<br />
ohne Barteln, Schuppen groß 31-35 entlang der vollständigen Seitenlinie, meist goldgelbe bis<br />
graue Färbung, Rückenflosse lang mit konvex gewölbter Oberkante, Jungtiere oft mit dunklem<br />
Fleck an der Schwanzwurzel (Abb. 45), helles Bauchfell (Peritoneum).<br />
76
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 45: Karausche, Jungtier mit dunklem Fleck an der Schwanzwurzel.<br />
Autökologie: Nach GERSTMEIER & ROMIG (1998) bzw. KOTTELAT & FREYHOF (2007) leben<br />
Karauschen gesellig in Stillgewässern, wobei kleinere, flache Seen und Tümpel bzw. Augewässer<br />
mit viel Pflanzenwuchs bevorzugt werden. Die Karausche wird als typischer Bewohner von<br />
Überschwemmungsauen entlang von Flüssen, in denen nach Hochwässern isolierte Altwässer und<br />
Tümpel zurückbleiben, angesehen. Die Karausche besitzt spezielle Anpassungen an diese<br />
extremen Habitate, indem sie sehr niedrige Sauerstoffkonzentrationen toleriert und bei<br />
Austrocknung noch einige Zeit im nassen Schlamm überleben kann. Sie kann auch in relativ<br />
sauren Gewässern bestehen und kommt sogar in Moortümpeln vor (sog. Moorkarpfen).<br />
Karauschen nützen sowohl tierische als auch pflanzliche Nahrung. Zur Laichzeit im Mai und Juni<br />
ziehen sie in Schwärmen zu seichten, dicht bewachsenen Uferstellen und laichen in Portionen bis<br />
zu 300000 Eiern pro Weibchen. Die Eier haften an Wasserpflanzen und entwickeln sich in 3-7<br />
Tagen. Populationen „verbutten“ in kleinen Tümpeln, d.h. sie bestehen fast ausschließlich aus<br />
recht kleinen Individuen. Große Exemplare finden sich nur in größeren, nahrungsreichen<br />
Gewässern.<br />
5.6.2 Historische Verbreitung<br />
Europa: Ursprünglich kam die Karausche in ganz Ost- und Mitteleuropa vor, mit Ausnahme des<br />
hohen Nordens (KOTTELAT & FREYHOF (2007). Sie fehlt auch weitgehend im Mittelmeerraum mit<br />
Ausnahme von Nordgriechenland. Auch im Süden Englands ist diese Art ursprünglich heimisch.<br />
Nach GERSTMEIER & ROMIG (1998) kommt die Karausche zudem in Spanien und in der Türkei vor.<br />
Österreich: Die Karausche war ursprünglich in allen Bundesländern Österreichs heimisch<br />
(SPINDLER et al. 1997). Bereits FITZINGER (1832) beschreibt sie als in Flüssen, Teichen, Seen und<br />
Sümpfen des Flachlandes als sehr gemein.<br />
Oberösterreich: Für Oberösterreich wird die Karausche bei KUKULA (1874) „in der Donau und in<br />
stehenden Gewässern“ und bei Lori (1871) für die „Altwässer der Donau“ bei Passau beschrieben.<br />
Karauschen tauchen auch am Fischmarkt in Linz Anfang des letzten Jahrhunderts in größerer Zahl<br />
auf (mehrere hundert Stück; KERSCHNER, 1956). Auch bei KOLLMANN (1898) findet man die<br />
Karausche für Salzburg, und bereits HECKEL (1854) beschrieb die Karausche aus „schlammigen<br />
Lacken der Salzach“, sodass historische Vorkommen in der oberösterreichischen Salzach<br />
77
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
anzunehmen sind. Aus dem Inn wurden Karauschen bis hinauf ins Tiroler Unterinntal als seltene<br />
Art der Augewässer beschrieben (HELLER, 1871; MARGREITER, 1933-1935).<br />
5.6.3 Aktuelle Verbreitung<br />
Europa: Zusätzlich zum ursprünglichen Verbreitungsgebiet wurde die Karausche in weiten Teilen<br />
Frankreichs und Norditaliens eingeführt. Auch in weiten Teilen Englands kommt sie heute infolge<br />
fischereilichen Besatzes vor (KOTTELAT & FREYHOF, 2007).<br />
Österreich: Nach WOLFRAM & MIKSCHI (2007) besiedelt die Karausche auch aktuell Gewässer in<br />
allen Bundesländern und fast allen Haupteinzugsgebieten. Verschwunden ist sie lediglich aus dem<br />
Haupteinzugsgebiet des Tiroler Inns und seiner Nebengewässer. Auch aktuell sind Karauschen bis<br />
in erstaunlich hoch gelegene Flusstäler hinauf bekannt, beispielsweise an der Oberen Mur bei<br />
Talheim (WIESNER et al. 2005), wenngleich derartige rezente Vorkommen auch durch menschliche<br />
Einbringung zu erklären sein können.<br />
Oberösterreich: Aus dem Traun-System sind Karauschen aus Wimsbach-Neydharting (Nähe<br />
Almspitz, 1980) durch Belege im Naturhistorischen Museum dokumentiert. Derartige, neuere<br />
Funde könnten leicht auch durch Besatzmaßnahmen oder Einschleppung begründet sein.<br />
Abb. 46: Nachweise von Karauschen in Oberösterreich und benachbarte Bundesländern<br />
Die aktuellen Nachweise von Karauschen in Oberösterreich sind in Abb. 46 dargestellt. Ältere<br />
Funde (vor 2008) sind zum Großteil nicht aufgearbeitet, weil es sich bei der Karausche um keine<br />
der detailliert bearbeiteten FFH-Arten handelt. Es fehlen bekannte Fundorte wie beispielsweise<br />
aus der Reichersberger Au am Inn (ZAUNER et al. 2001). Der Fund von zwei Karauschen in einem<br />
78
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Autümpel in der Nähe von Leopoldschlag an der Maltsch im Jahr 2002 wurde mit eingearbeitet<br />
(SILIGATO & GUMPINGER, 2003), wie auch eine Reihe älterer Funde aus dem Machland.<br />
Gute Karauschenbestände finden sich aktuell noch in wenigen Kleingewässern an der Unteren<br />
Salzach. In den Inn-Auen konnte 2008 nur ein einziger Karauschen-Bestand gefunden werden, in<br />
der „Schwarzen Lacke“ bei Mamling. Sowohl an der Salzach als auch am Inn handelt es sich bei<br />
den Fundorten um stagnierende, stark isolierte Kleingewässer, die von einer ausgeprägt<br />
limnophilen Fischfauna besiedelt sind.<br />
Die höchste Dichte an Karauschen-Gewässern findet sich heute noch in Beckenlagen der Donau.<br />
Im Eferdinger Becken können in Gewässern sowohl am rechten als auch am linken Ufer der<br />
Donau Karauschenbestände gefunden werden, allerdings nur in recht geringe Dichten. Auch im<br />
Tagerbach/Schwaigau System südöstlich von Linz wurden Karauschen dokumentiert. Die größte<br />
Zahl und Dichte von Gewässern und Individuen wurde allerdings im nördlichen Machland<br />
gefunden. Hier konnten zwischen 2001 und 2008 in insgesamt 12 verschiedenen Gewässern,<br />
wobei es sich vorwiegend um stagnierende Tümpel und Altarme handelt, Karauschen gefunden<br />
werden.<br />
Bei der Betrachtung der Größenstruktur der Karauschen (Abb. 47) fällt auf, dass in vielen<br />
Zielgebieten bzw. Gewässern nur kleine Karauschen mit Längen von in der Regel weniger als<br />
150 mm gefunden wurden. Große Karauschen um 200 mm wurden fast nur im Altarm Saxendorf<br />
im Machland sowie in einem Tümpel in den Salzachauen (320 mm) vorgefunden. Dies zeigt, dass<br />
die Art das Potential für ein entsprechendes Größenwachstum besitzt, dieses jedoch in den<br />
meisten Gewässern nicht entsprechend ausreizen kann (Verbuttungserscheinungen).<br />
Individuenzahl<br />
40<br />
30<br />
20<br />
10<br />
0<br />
Carassius carassius<br />
0 50 100 150 200 250 300<br />
Totallänge [mm]<br />
Salzachauen, n = 254<br />
Innauen, n = 24<br />
Eferdinger Becken, n = 17<br />
Linzer Becken, Machland, n = 119<br />
Abb. 47: Größenstruktur der gefangenen Karauschen, getrennt nach Zielgebieten.<br />
79
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Stellen<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
Karausche, Carassius carassius<br />
Ca.ca<br />
Ti.ti<br />
Ru.ru<br />
Pe.fl<br />
Sc.er<br />
Es.lu<br />
Ca.au<br />
Le.ce<br />
Ps.pa<br />
Rh.am<br />
Mi.fo<br />
Pr.ma<br />
Al.al<br />
Ga.ac<br />
Go.go<br />
Ab.br<br />
Ba.ba<br />
Ba.br<br />
Cy.ca<br />
Le.le<br />
Ab.bj<br />
An.an<br />
Ch.na<br />
Le.gi<br />
Le.id<br />
Lo.lo<br />
Ne.ke<br />
On.my<br />
Sa.tr<br />
Th.th<br />
Abb. 48: Mit Karauschen vergesellschaftete Arten. Blau ... rheophile; grau ... oligorheophile; grün ... indifferente; rot<br />
... limnophile<br />
Mit Karauschen sind in oberösterreichischen Gewässern vor allem limnophile Fischarten wie<br />
Schleie, Rotfeder, Bitterling und Schlammpeitzger vergesellschaftet (Abb. 48). Auch<br />
strömungsindifferente Arten, darunter vor allem phytophile wie Rotauge, Flussbarsch, Hecht oder<br />
Giebel finden sich häufig in Karauschengewässern.<br />
5.6.4 Diskussion:<br />
Generell ist anzumerken, dass die Karausche neben der maximal realisierten Körpergröße auch in<br />
Bezug auf die Färbung, Hochrückigkeit und weitere äußere Merkmalen sehr variabel ist. So<br />
konnten im selben Gewässer im Machland hochrückige Karauschen ohne schwarzen Fleck an der<br />
Schwanzwurzel, zusammen mit niedrigeren Exemplaren mit deutlichem dunklem Mal an der<br />
Schwanzwurzel gefangen werden (Abb. 49 links unten). Die Totallängen der gefangenen<br />
Individuen bewegten sich im selben Größenbereich. Eine verlässliche Unterscheidung zum Giebel<br />
ist dabei, ohne die Färbung des Peritoneums zu betrachten, in vielen Fällen nicht zweifelsfrei<br />
möglich.<br />
80
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 49: Links oben: Karausche mit typischem Habitus; rechts oben: Mit Karauschen assoziierte Fischarten (obere<br />
Fotos: Lohjörgl-Altarm, Salzachauen). Links unten: Karauschen mit variierenden äußeren Merkmalen;<br />
rechts unten: verlandendes Augewässer mit Karauschen und Blaubandbärblingen (untere Fotos:<br />
Machland).<br />
In zwei Kleingewässern in den Salzachauen wurden in hohen Dichten Fische gefunden, die<br />
äußerlich eindeutig für Karauschen typische Merkmale aufwiesen (Färbung, Form der Dorsalflosse<br />
dunkler Punkt am Schwanzansatz). Bei der Betrachtung des Merkmales der Pigmentierung des<br />
Bauchfelles (Peritoneum, Abb. 50) anhand weniger Individuen fiel jedoch auf, dass dieses<br />
teilweise dunkel gefärbt war, was für den Giebel charakteristisch ist. Dies zeigt einerseits, dass<br />
Karauschen und Giebel nicht eindeutig anhand äußerer Merkmale unterschieden werden können,<br />
und ist andererseits als Hinweis zu deuten, dass es hier wahrscheinlich zur Hybridisierung von<br />
Karauschen und Giebel kommt. Eine variable Färbung des Peritoneums von Hybriden dieser<br />
beiden Arten wird auch von PAOUSEK et al. (2008) beschrieben.<br />
81
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 50: Links: Als Hybride von Karauschen und Giebeln gedeuteter Bestand in den Salzachauen; Rechts:<br />
Individuum mit äußerlichen Carassius-Merkmalen, aber dunklem Peritoneum<br />
Sowohl im Eferdinger Becken als auch im Machland wurden zahlreiche zum Teil stark isolierte<br />
Gewässer auf ihre Fischfauna untersucht. Dabei war auffallend, dass in mangels Anbindung stark<br />
verlandenden Gewässern, oftmals die Karausche als letzter heimischer Vertreter der Fische zu<br />
finden war. In vielen Fällen kam zusammen mit der Karausche der aus Asien eingeschleppte und<br />
offensichtlich in Bezug auf seine Ansprüche ebenso tolerante Blaubandbärbling (Pseudorasbora<br />
parva) vor.<br />
5.6.5 Defizitanalyse und Maßnahmenvorschläge<br />
Die Defizite für die Karausche ergeben sich aus den Lebensraumansprüchen wie sie im Kapitel<br />
„Autökologie“ erwähnt wurden: Die Karausche wird als typischer Bewohner von<br />
Überschwemmungsauen entlang von Flüssen, in denen nach Hochwässern isolierte Altwässer und<br />
Tümpel zurückbleiben, angesehen. Da diese Lebensräume weitgehend verschwunden sind bzw.<br />
nur in wenigen Resten vorhanden sind, werden die Defizite hinsichtlich der Lebensbedingungen für<br />
die Karausche offensichtlich. Weitgehende Übereinstimmung in den Lebensraumansprüchen<br />
zwischen Karausche und Schlammpeitzger (und z.T. anderen, wärmeliebenden, limnophilen<br />
Kleinfischarten wie Bitterling, Rotfeder und Moderlieschen) sind sehr deutlich und dadurch können<br />
Defizite die bei diesen Arten genannt wurden auf die Karausche übertragen werden.<br />
Aus diesem Grund werden gezielte Maßnahmen für die Karausche nicht näher behandelt. Die Art<br />
kann von Maßnahmen, die auf den Schutz und Erhalt des Schlammpeitzgers abzielen,<br />
profitieren. Eine natürliche Wiederbesiedlung von neu geschaffenen bzw. instand gesetzten<br />
Habitaten kann erwartet werden. Falls fehlende Hochwasserdynamik als Ursache für eine<br />
natürliche Besiedlung geeigneter Habitate bestimmt werden kann, ist direktes Umsetzen aus<br />
nächstgelegenen Populationen mit relativ geringem Aufwand möglich.<br />
Die Unsicherheiten bezüglich der genauen Bestimmung von Karauschen bzw. die mögliche<br />
Vermischung mit Giebeln und die teilweise diskutierte Möglichkeit der Verdrängung von reinen<br />
Karauschenbeständen durch den Giebel sollte Anlass für detaillierte Untersuchungen der<br />
österreichischen Karauschenpopulationen sein. Dafür wären genetische Studien unumgänglich.<br />
Die Ergebnisse dieser Studien könnten eventuell die Gefährdungssituation von (reinen)<br />
Karauschen in einem völlig neuen Licht erscheinen lassen und gezielte Maßnahmen zum Erhalt<br />
dieser Art notwendig machen.<br />
5.7 Bitterling (Rhodeus amarus)<br />
5.7.1 Allgemeines<br />
Merkmale: Körper hochrückig, seitlich abgeflacht; Länge meist 5-6 cm, Maximal 9 cm; kleines,<br />
endständiges Maul; große Schuppen (21 – 44 in einer Längsreihe); Seitenlinie nur 5 – 6 Schuppen<br />
lang; Färbung silbrig glänzend, Rücken graugrün, Seiten mit blaugrün leuchtendem Längsstreifen<br />
von der Mitte bis zum Schwanzflossenansatz; Männchen mit oranger Oberhälfte der Iris und<br />
rötlicher Rücken- und Afterflosse; zur Laichzeit Männchen prächtig gefärbt - Brust und Bauch rot,<br />
(Abb. 51), Laichausschlag auf der Schnauze, Weibchen mit langer Legeröhre.<br />
82
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 51: Bitterling-Pärchen vor der Eiablage. Erkennbar ist die Legeröhre des Weibchens und die ausgeprägte<br />
Laichfärbung des Männchens mit Laichausschlag auf der Schnauzenspitze<br />
Autökologie: Bitterlinge leben nach GERSTMEIER & ROMIG (1998) bzw. nach KOTTELAT & FREYHOF<br />
(2007) gesellig im flachen Wasser pflanzenreicher Uferzonen. Sie bewohnen sowohl langsam<br />
fließende als auch stehende Gewässer bis hin zu Tümpeln. Tiefgründige, verschlammte Gewässer<br />
werden gemieden. Bevorzugte Lebensräume weisen Sandboden mit einer dünnen darüber<br />
liegenden Mulmschicht auf, wo ausreichende Bestände der für die Fortpflanzung notwendigen<br />
Großmuscheln vorkommen. Die Nahrung besteht aus benthischen Invertebraten, besonders bei<br />
großen Exemplaren aber vorwiegend von Detritus und pflanzlichem Material (PRZYBYLSKI &<br />
WINFIELD, 1996).<br />
Der Bitterling verfügt über ein einzigartiges Fortpflanzungsverhalten. Zur Laichzeit, etwa von April<br />
bis August, entwickeln die Weibchen eine lange Legeröhre, mit der sie die Eier in Großmuscheln<br />
ablegen. Als Wirt kommen die Muschelarten Unio pictorum, U. tumidus, U. crassus, Anodonta<br />
anatina und A. cygnea in Frage. Aufgrund selektiver Eiablage, Habitatüberschneidung und<br />
höheren Bruterfolges haben die ersten Arten eine größere Bedeutung für den Bitterling als A.<br />
cygnea (REYNOLDS et al., 1997; SMITH et al., 2000; MILLS & REYNOLDS, 2002). Die prachtvoll<br />
gefärbten Männchen besetzen Reviere über geeigneten Muscheln. Die Weibchen werden<br />
angelockt und platzieren einige wenige Eier durch die Ausströmöffnung in die Kiemenhöhle der<br />
Muschel. Darauf folgend geben die Männchen ihr Sperma über der Muschel ab, das mit dem<br />
Atemwasser in die Mantelhöhle eingesogen wird. Dieser Vorgang wiederholt sich mit mehreren<br />
Muscheln über die gesamte Laichzeit.<br />
Pro Weibchen werden Eizahlen von 60 bis über 500 angegeben (ALDRIDGE, 1999; GERSTMEIER &<br />
ROMIG, 1998). Diese Eizahl ist für Cypriniden ungewöhnlich gering, was durch einen großen<br />
Durchmesser der Eier von 2 bis 3 mm und den hohen Aufwand bei der Eiablage beziehungsweise<br />
den Energieeinsatz für einen besseren Schutz der Eier, ausgeglichen wird. Die Entwicklungsdauer<br />
der Embryos innerhalb der Muschel liegt bei 3 – 6 Wochen. Nach der Adsorption des Dottersackes<br />
schwimmen die etwa 10,5 mm großen Larven vermutlich aktiv aus der Muschel (ALDRIDGE, 1999)<br />
und sind dann in der Drift nachzuweisen (REICHARD et al., 2001). Die Lebensdauer des Bitterlings<br />
wird mit 3,5 bis 5 Jahren angegeben. Die Geschlechtsreife wird im 2. Lebensjahr erreicht.<br />
83
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
5.7.2 Historische Verbreitung<br />
Europa: In den letzten Jahren mehren sich Hinweise, dass der Bitterling historisch nur in<br />
Osteuropa heimisch gewesen wäre. Er könnte erst durch die Karpfenteichwirtschaft im Mittelalter<br />
nach Mitteleuropa vorgedrungen und daher als Archäozoon zu bezeichnen sein (VAN DAMME et al.<br />
2007). Diese Hypothese wird neben historischen Analysen auch durch das Fehlen von<br />
wirkungsvollen Abwehrstrategien europäischer Muscheln gestützt, um der Eiablage von<br />
Bitterlingen zu entgehen (keine langfristig entwickelte Wirt-Parasit-Beziehung; MILLS & REYNOLDS,<br />
2003; REICHARD et al. 2005). Das ursprüngliche Verbreitungsgebiet des Bitterlings im<br />
Donaueinzugsgebiet hätte sich nach VAN DAMME et al. (2007) auf die Mittlere und Untere Donau<br />
beschränkt und würde in etwa mit dem des Wildkarpfens übereinstimmen.<br />
Österreich: Folgt man der Theorie von VAN DAMME et al (2007) wäre der Bitterling in Österreich<br />
als eingebürgert zu betrachten bzw. am Rande seines natürlichen Verbreitungsgebietes<br />
vorkommend, wobei einzuschränken ist, dass Verbreitungsgrenzen von Organismen auch<br />
natürlicherweise stark schwanken können. Der Bitterling dürfte im 19. Jahrhundert in Österreich<br />
häufig vorgekommen sein, schon FITZINGER (1832) beschreibt ihn „in flachliegenden Gegenden; in<br />
Flüssen und Bächen. In der Donau u. s. w. ziemlich häufig“.<br />
Oberösterreich: Auch für Oberösterreich wird der Bitterling bei KUKULA (1874) als „in allen<br />
fließenden und stehenden Gewässern“ vorkommend beschrieben.<br />
5.7.3 Aktuelle Verbreitung<br />
Europa: Nach GERSTMEIER & ROMIG (1998) kommt der Bitterling vom Ural und Kaspischen Meer<br />
im Osten bis nach Mittelfrankreich im Westen vor. Er fehlt in Skandinavien. Nach KOTTELAT &<br />
FREYHOF (2007) wurde der Bitterling in weiten Teilen Frankreichs eingeführt und kommt aktuell<br />
daher auch im Mittelmeerraum (Südfrankreich bzw. Griechenland-Türkei) vor. Nach diesen<br />
Autoren wurde er auch in weiten Teilen Osteuropas angesiedelt. Nach MAITLAND & LINSELL (2006)<br />
wurde der Bitterling auch in Großbritannien eingeführt.<br />
Österreich: Nach WOLFRAM & MIKSCHI (2007) bzw. SPINDLER (1997) fehlt der Bitterling aktuell in<br />
Salzburg und Tirol. Die österreichischen Verbreitungsschwerpunkte werden mit der Donau östlich<br />
von Wien, der March, Thaya, der unteren Mur und deren Zubringern, der unteren Leitha und der<br />
unteren Lafnitz angegeben. Daneben in kleinen Bächen und Gräben des Burgenlandes und in<br />
Seen und Teichen in Kärnten.<br />
Oberösterreich: Aktuell werden in Oberösterreich in Gewässern unterschiedlicher Charakteristik<br />
Bitterlinge nachgewiesen:<br />
- Augewässer an der Unteren Salzach: nur im Lojörgl-Altarm (11 Ind.)<br />
- Augewässer am Inn: 4 Gewässer in der Sunzinger und Gaishofer Au (84 Ind.)<br />
- Augewässer an der Donau:<br />
o Altarme in der Schildorfer Au (125 Ind.)<br />
o Eferdinger Becken (exkl. Aschach + Zubringer; 17 Ind.)<br />
o Machland: 5 Gewässer (150 Ind.)<br />
- Ausrinn des Seeleithensee bei Ibm (2 Ind.)<br />
- Pram bei Taufkirchen (10 Ind.)<br />
- Aschach-Unterlauf mit Leitenbach und Sandbach: Teils sehr hohe Dichten (534 Ind.)<br />
In Aubereichen zwischen den untersuchten Zielgebieten konnten bei früheren Erhebungen<br />
ebenfalls Bitterlinge gefunden werden, beispielsweise in der Reichersberger Au, im Winterhafen<br />
84
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
bei Linz oder auf Höhe des Stauraumes Wallsee-Mitterkirchen (Abb. 52). Damit zeigt sich das Bild<br />
einer stark lückigen, aber ausgedehnten Besiedelung der tiefen Lagen im Landesgebiet.<br />
Abb. 52: Nachweise von Bitterlingen in Oberösterreich und benachbarten Bundesländern<br />
Bei näherer Betrachtung zeigt sich, dass Bitterlinge in unterschiedlichen Gewässertypen<br />
vorkommen. Es handelt sich durchwegs um ausgeprägt sommerwarme Gewässer. Deutlich von<br />
Grund- bzw. Qualmwasser beeinflusste Augewässer sind nicht besiedelt, ebenso sommerkühle<br />
Stauräume von Fließgewässern wie beispielsweise an der Enns oder Traun. Über den Faktor<br />
Temperatur hinaus dürfte vor allem das Vorliegen von Großmuscheln der Gattungen Unio oder<br />
Anodonta entscheidend für die Habitateignung sein. Diese kommen auch in Fließgewässern,<br />
beispielweise Pram, Aschach und Mattig sowie deren Zuflüssen vor.<br />
Die höchsten Bitterling-Dichten werden im Aschach-Unterlauf gefunden, der sich generell durch<br />
eine hohe Produktivität und Arten- und Individuendichte auszeichnet, sowie in der Schwarzen<br />
Lacke in den Innauen, einem isolierten Altarm mit ausgeprägt stagnophiler Fischfauna (Abb. 53).<br />
85
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 53: Unterschiedliche von Bitterlingen besiedelte Gewässertypen: Fließgewässer Aschach unterhalb (links<br />
unten) und oberhalb Durchbruch (linksoben), Altarm in den Innauen (links unten) und Ausrinn des<br />
Seeleithensees (rechts unten).<br />
Bei einigen Populationen ist ein zweigipfeliger Größenaufbau mit einem Maximum bei ca. 30-<br />
50 mm Totallänge und einem zweiten Gipfel bei 50-60 mm zu erkennen (Abb. 54). Die<br />
Interpretation dieser Kohorten als Jahrgänge von 1+ und 2+ Individuen wäre schlüssig, unterliegt<br />
aber aufgrund der zu geringen Messgenauigkeit bei Kleinfischen im Feld gewissen Unsicherheiten.<br />
Individuenzahl<br />
200<br />
150<br />
100<br />
50<br />
0<br />
Rhodeus amarus<br />
0 20 40 60 80 100<br />
Totallänge [mm]<br />
Salzach, n = 11<br />
Innauen, n = 84<br />
Donauauen, n = 211<br />
Aschach, n = 512<br />
Rest, n = 12<br />
86
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 54: Größenstruktur der gefangenen Bitterlinge, getrennt nach Untersuchungsgebieten.<br />
Die breite Palette an besiedelten Gewässern spiegelt sich in einer großen Zahl von Arten wider,<br />
die mit Bitterlingen vergesellschaftet vorkommen. Das ubiquitäre Rotauge sowie weitere<br />
strömungsindifferente Arten wie Aitel, Laube oder Flussbarsch treten in der Regel gemeinsam mit<br />
dem Bitterling auf. Typische limnophile Arten wie Schleie, Rotfeder oder Karausche werden<br />
hingegen nur bei weit weniger als der Hälfte der befischten Stellen gemeinsam mit dem Bitterling<br />
angetroffen (Abb. 55).<br />
Stellen<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
0<br />
Abb. 55: Mit Bitterlingen vergesellschaftete Arten. Blau ... rheophile; grau ... oligorheophile; grün ... indifferente; rot<br />
... limnophile<br />
5.7.4 Diskussion<br />
Bitterling, Rhodeus amarus<br />
Rh.am<br />
Ru.ru<br />
Le.ce<br />
Al.al<br />
Pe.fl<br />
Go.go<br />
Ps.pa<br />
Es.lu<br />
Ba.br<br />
Pr.ma<br />
Le.le<br />
Ti.ti<br />
Ab.br<br />
Al.bi<br />
Sc.er<br />
Ba.ba<br />
Ca.au<br />
Ca.ca<br />
Ch.na<br />
Cy.ca<br />
Ga.ac<br />
An.an<br />
Co.go<br />
Sa.sp<br />
Vi.vi<br />
Le.gi<br />
Sa.tr<br />
As.as<br />
Ru.pi<br />
Go.al<br />
Lo.lo<br />
Mi.fo<br />
Ne.ke<br />
Ne.me<br />
On.my<br />
Ph.ph<br />
Sa.fo<br />
Ab.bj<br />
Co.ta<br />
Eu.ma<br />
Hu.hu<br />
La.pl<br />
Le.de<br />
Le.id<br />
Sa.lu<br />
Th.th<br />
Das Phänomen, dass Bitterlinge in kleineren Fließgewässern in hohen Dichten auftreten, war<br />
bisher vor allem aus dem Südburgenland und den Grabenlandbächen in der Südsteiermark<br />
beschrieben (WOLFRAM & MIKSCHI, 2002; ZAUNER & RATSCHAN, 2004). Dass auch in der Aschach<br />
und anderen oberösterreichischen Fließgewässern überaus dichte Bitterlingsbestände auftreten,<br />
ist hingegen erst seit kurzem bekannt (SILIGATO & GUMPINGER, 2005) und hat sich durch die<br />
Erhebungen im Rahmen des Kleinfisch-Projekts bzw. der Befischung der GZÜV-Stellen (Aschach2<br />
und Aschach Pfaffing) eindrucksvoll bestätigt.<br />
Die Aschach verfügt sowohl oberhalb des Durchbruches samt den Zubringern Leitenbach und<br />
Sandbach, als auch in ihrem Unterlauf über zum Teil dichte Bestände an Großmuscheln, ohne die<br />
eine erfolgreiche Reproduktion des Bitterlings nicht möglich ist. Besonders zu erwähnen sind in<br />
diesem Zusammenhang auch Bestände der vom Aussterben bedrohten Flussperlmuschel<br />
Margaritifera margaritifera (kein potentieller Wirt für den Bitterling) sowie der ebenfalls stark<br />
gefährdeten Gemeinen Flussmuschel Unio crassus. Diese streckenweise sehr arten- und zum Teil<br />
auch individuenreichen Vorkommen von Großmuscheln spiegeln sich in dichten<br />
Bitterlingsbeständen in mehreren Bereichen der Aschach wieder.<br />
87
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Zusammenfassend können aus den Erkenntnissen des Kleinfischprojektes die schon in der<br />
Literatur weitgehend bekannten ökologischen Ansprüche der Art bestätigt werden. Der Bitterling<br />
kommt weiträumig in tief liegenden Landesteilen vor, wo sommerwarme Gewässer vorherrschen<br />
die Großmuschelbestände aufweisen. Bevorzugt werden stehende Gewässer, wobei vereinzelt<br />
auch Fließgewässer besiedelt werden, falls die Voraussetzungen bezüglich Temperatur und<br />
Muschelbestand gegeben sind.<br />
5.7.5 Defizitanalyse und Maßnahmenvorschläge<br />
Bezüglich der landesweiten Verbreitung des Bitterlings können keine dramatischen Unterschiede<br />
zwischen historischen Angaben und aktuellen Daten diagnostiziert werden. Indirekt lassen sich<br />
aus den oben erwähnten ökologischen Ansprüchen der Art dennoch Defizite ableiten, die jedoch<br />
schwer mit nachgewiesenen Bestandsrückgängen des Bitterlings selbst verknüpft werden können.<br />
Dies liegt aber eher an der eingeschränkten historischen Datenlage in Bezug auf die Verbreitung<br />
und Bestandsstärken des Bitterlings in Oberösterreich. Andererseits sind die Rückgänge der<br />
Großmuschelbestände in Oberösterreich weitgehend bekannt, und daraus kann natürlich eine<br />
Verschlechterung der Lebensbedingungen für den Bitterling abgeleitet werden. Darüber hinaus ist<br />
durch Flussbegradigungen, und das Verschwinden von Seiten- und Nebenarmen, bzw. Altarmen<br />
die sich im Sommer stärker erwärmen konnten und so geeignetes Habitat für den Bitterling boten,<br />
ebenfalls von einer Verschlechterung der Lebensraumqualität für die Art auszugehen. In dieser<br />
Beziehung, die eng mit den höheren Temperaturansprüchen des Bitterlings verknüpft ist, ergeben<br />
sich deutliche Parallelen zu den Ansprüchen des Steinbeißers und daher können Defizite die<br />
schon für diese Art beschrieben wurden auch auf den Bitterling übertragen werden.<br />
In Oberösterreich konnte der Bitterling an vielen Stellen in zum Teil beachtlichen Dichten<br />
nachgewiesen werde. Die Gefährdungssituation dieser Art in Oberösterreich ist im Vergleich zu<br />
anderen im Rahmen dieses Projektes bearbeiteten Kleinfischarten als weniger angespannt<br />
einzuschätzen. Gezielte Maßnahmen für die Förderung dieser Art erschienen aus heutiger<br />
Sicht nicht unmittelbar notwendig. Dies auch vor dem Hintergrund, dass die Art im<br />
Landesgebiet nicht zweifellos zur heimischen Fauna zu zählen ist – möglicherweise handelt es<br />
sich um ein Archäozoon (siehe oben). Darüber hinaus kann der Bitterling von Maßnahmen zum<br />
Schutz und Erhalt des Steinbeißers und des Schlammpeitzgers bzw. Maßnahmen zum Schutz der<br />
Großmuschelbestände profitieren, womit auch der langfristige Fortbestand dieser Kleinfischart<br />
sichergestellt werden könnte.<br />
5.8 Moderlieschen (Leucaspius delineatus)<br />
5.8.1 Allgemeines<br />
Merkmale: Schlanker, kleiner (6 bis 8, max. 12 cm) Fisch, Mundspalte steil nach oben gerichtet,<br />
Augen relativ groß, Seitenlinie unvollständig, nur auf die ersten 7-12 Schuppen beschränkt, 44-50<br />
Schuppen in der längsten Reihe, 14-20 Afterflossenstrahlen, Färbung meist hell bräunlich, seitlich<br />
heller, manchmal dunkel - bläuliches Längsband an der hinteren Körperhälfte (Abb. 56).<br />
88
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Abb. 56: Moderlieschen, weibliches Tier mit kurzer Legeröhre am After.<br />
Autökologie: Das Moderlieschen ist ein Schwarmfisch, der hauptsächlich in vegetationsreichen<br />
Kleingewässern anzutreffen ist (GERSTMEIER & ROMIG, 1998). Typische Biotope sind Tümpel, dicht<br />
bewachsene Teiche, Wiesengräben und Altwässer von Flüssen. DUßLING & BERG (2001) geben<br />
aber auch die strömungsberuhigten Zonen von stärker strömenden Fließgewässern als<br />
Lebensraum an. Die Nahrung besteht aus tierischem Plankton und anderen Kleintieren, auch<br />
Anflug. Während der Fortpflanzungszeit von Mai bis September bilden die Männchen einen<br />
Laichausschlag aus, die Weibchen kurze Legeröhren bzw. Genitalpapillen. Die Männchen<br />
verteidigen ein Revier um einen Wasserpflanzenstängel auf den mehrere Weibchen ihre Eier in<br />
Form gerader Streifen von oben nach unten ablegen. Das Gelege wird vom Männchen bewacht<br />
und gesäubert bis die Jungen schlüpfen.<br />
5.8.2 Historische Verbreitung<br />
Europa: Nach KOTTELAT & FREYHOF (2007) kommt das Moderlieschen europaweit ursprünglich<br />
vom Niederrhein im Westen über das Baltikum bis zu den Becken am Schwarzen und Kaspischen<br />
Meer im Osten vor. Im Süden erstreckt sich das Verbreitungsgebiet über die Balkanhalbinsel bis in<br />
die Nordtürkei, im Norden wird noch Südschweden erreicht. Es fehlt in Italien und auf der<br />
Iberischen Halbinsel.<br />
Österreich: Nach WOLFRAM & MIKSCHI (2007) fehlte das Moderlieschen ursprünglich in Salzburg<br />
und Kärnten. Auf ursprüngliche Vorkommen in anderen Bundesländern, z.B. Oberösterreich, wird<br />
nicht explizit eingegangen, allerdings werden als angestammte Lebensräume nur die Donauauen<br />
östlich von Wien und die Marchauen genannt.<br />
Oberösterreich: Beschreibungen von Moderlieschen aus oberösterreichischen Gewässern fehlen<br />
in der historischen Literatur weitgehend. Auch Belegexemplare im Naturhistorischen Museum in<br />
Wien liegen nur aus Niederösterreich vor. KERSCHNER (1956) schreibt über die Verbreitung des<br />
Moderlieschen: „In Oberösterreich bisher nur aus Tümpeln des Kremstales bekannt geworden“.<br />
Auch Lori (1871), der ansonsten eine recht vollständige Beschreibung der Artgarnitur von Donau<br />
und Inn liefert, berichtet, dass in der Gegend von Passau die Gattung Leucaspius gänzlich zu<br />
89
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
fehlen scheint. Basierend auf dieser Datenlage lassen sich keine fundierten Aussagen über die<br />
ursprüngliche Verbreitung der Art tätigen.<br />
5.8.3 Aktuelle Verbreitung<br />
Europa: Das Moderlieschen wurde nach KOTTELAT & FREYHOF (2007) weiträumig in Frankreich<br />
ausgesetzt, sowie auch am Oberrhein. Vereinzelt auch in der Schweiz. Neuerdings ist es auch<br />
nach Großbritannien eingeführt worden (FARR-COX et al., 1996).<br />
Österreich: WOLFRAM & MIKSCHI (2007) berichten von der Einführung des Moderlieschens in<br />
Kärnten wo es sich weiter ausbreiten soll. Aus anderen Gebieten Österreichs werden rückläufige<br />
Verbreitungstendenzen berichtet, etwa aus Niederösterreich und der Steiermark. Nur vereinzelte<br />
Funde liegen aus dem Burgenland und Vorarlberg vor.<br />
Oberösterreich: Aktuell liegen in Oberösterreich Moderlieschen-Funde nur aus dem Elbe-<br />
Einzugsgebiet, dem Eisenhuter Bach unweit der Mündung in die Maltsch, vor (Abb. 2). Hier<br />
konnten unabhängig sowohl SILIGATO & GUMPINGER (2003), als auch ZAUNER & RATSCHAN (2006)<br />
einen Bestand dokumentieren (Abb. 57, Abb. 58). Aufgrund des Vorkommens von Karpfenteichen<br />
im Einzugsgebiet und der Tatsache, dass der Bach kein typisches Moderlieschen-Habitat darstellt<br />
(Abb. 59, Begleitfischarten Bachforelle, Äsche, Aalrutte und Rotauge), ist eher anzunehmen, dass<br />
es sich bei diesen Funden um aus Karpfenteichen abgedriftete Exemplare handelt als um eine<br />
reproduzierende Population. Ähnlich wird ein Fund von Moderlieschen in der Kleinen Salzach<br />
interpretiert, einem stark menschlich überprägten Augewässer an der Unteren Salzach im<br />
Salzburger Landesgebiet (ZAUNER et al., 2008). In Salzburg gilt das Moderlieschen nicht als<br />
ursprünglich heimisch (WOLFRAM & MIKSCHI, 2007).<br />
In den vielen Augewässern in Oberösterreich, die vor allem auf der Suche nach Schlammpeitzgern<br />
beprobt wurden und in Analogie zu Habitaten in Ostösterreich als typische Moderlieschen-<br />
Gewässer angesprochen werden könnten, wurde die Art nicht gefunden.<br />
Abb. 57: Nachweise von Moderlieschen in Oberösterreich und benachbarten Bundesländern<br />
90
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
Individuenzahl<br />
8<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
Leucaspius delineatus, Eisenhuter Bach<br />
0<br />
0 20 40 60 80 100<br />
Abb. 1:<br />
Text).<br />
Abb. 58:<br />
Totallänge [mm]<br />
Größenstruktur der Moderlieschen im Eisenhuter Bach in zwei verschiedenen Jahren (siehe<br />
Abb. 59: Der Eisenhuter Bach - ein untypischer Lebensraum für das Moderlieschen<br />
5.8.4 Diskussion<br />
Siligato & Gumpinger (2003), n = 14<br />
Zauner & Ratschan (2006), n = 13<br />
In Bezug auf das Vorkommen des Moderlieschens in Oberösterreich lassen sich drei Hypothesen<br />
konstruieren:<br />
1) Die Art war ursprünglich in Oberösterreich heimisch, ist aber aufgrund des fortgeschrittenen<br />
Lebensraumverlustes extrem selten geworden bzw. fast ausgestorben.<br />
91
Artenschutzprojekt Kleinfische – Modul 1 Ergebnisse<br />
2) Die Art stößt, abhängig von der jeweiligen klimatischen Situation, in Oberösterreich an die<br />
Verbreitungsgrenze. In warmen Klimaperioden hat das Verbreitungsgebiet natürlicherweise bis an<br />
die Landesgrenze gereicht.<br />
3) Das Moderlieschen war ursprünglich nicht heimisch und ist erst durch die Teichwirtschaft lokal<br />
eingeschleppt worden (Archäozoon; vgl. Bitterling).<br />
Welche dieser drei Hypothesen zutrifft, ist nur schwierig rekonstruierbar, vor allem, da auch<br />
beliebige Kombinationen denkbar sind. Daher muss die Frage eines ursprünglichen Vorkommens<br />
der Art in Oberösterreich vorerst offen bleiben.<br />
5.8.5 Defizitanalyse und Maßnahmenvorschläge<br />
Unabhängig von der Frage nach der Autochthonie ist der potentielle Lebensraum des<br />
Moderlieschens, ähnlich wie im Fall von Karausche und Schlammpeitzger, in den letzten<br />
Jahrzehnten massiv zurückgegangen und wird, wenn nicht Gegenmaßnahmen ergriffen werden,<br />
noch weiter schrumpfen. Auch die Einschleppung von nicht heimischen Arten wie Aal,<br />
Sonnenbarsch oder Blaubandbärbling ist in diesem Zusammenhang zu berücksichtigen. Auf Basis<br />
von Laborversuchen werden darüber hinaus pathogene Keime als Ursache für den Rückgang der<br />
Moderlieschen im Freiland diskutiert (GOZLAN et al. 2005; CARPENTIER et al. 2007).<br />
Aufgrund der Unsicherheit, ob die Art in Oberösterreichisch heimisch war, wird von direkten<br />
Maßnahmen zur Stützung der Art Abstand genommen. Dies auch vor dem Hintergrund, dass<br />
kein Besatzmaterial aus nahe gelegenen Populationen für allfällige Ansiedelungsversuche zur<br />
Verfügung steht. Indirekt kann die Art ggf. auch von Lebensraum verbessernden Maßnahmen<br />
profitieren, die primär in Hinblick auf die Zielart Schlammpeitzger ergriffen werden.<br />
92
Artenschutzprojekt Kleinfische – Modul 1 Ausblick<br />
6 AUSBLICK<br />
Nachdem im ersten Jahr des Kleinfischprojektes die Suche nach noch erhaltenen Beständen der<br />
Zielfischarten im Landesgebiet von Oberösterreich im Vordergrund stand, sollen in den folgenden<br />
Jahren die bereits grob formulierten Maßnahmen zur Verbesserung der Situation dieser Fischarten<br />
einerseits detailliert geplant, andererseits möglichst rasch umgesetzt werden.<br />
Eine zentrale Aufgabe liegt im kommenden Projektjahr sicherlich in der Verdichtung der<br />
Nachsuche nach dem Goldsteinbeißer im Aschach-System und nach dem Steinbeißer im<br />
Machland. Zudem soll – eine entsprechende Populationsgröße vorausgesetzt – ein<br />
Nachzuchtprogramm für den Goldsteinbeißer gestartet werden. Dabei gilt es in erste Linie, die<br />
autökologischen Ansprüche dieser Fischart hinsichtlich der Erfordernisse für die Nachzucht soweit<br />
kennenzulernen, dass jene Parameter abgeschätzt werden können, die ein erfolgreiches<br />
Nachzuchtprogramm garantieren.<br />
Generell muss die Sanierung bzw. Herstellung geeigneter Habitate für die als Zielfischarten<br />
definierten Spezies, allen voran die besonders bedrohten Arten Schlammpeitzger und Steinbeißer<br />
in den Vordergrund der Bemühungen gestellt werden. Dabei werden die Möglichkeiten der<br />
Förderung der finanziellen Aufwendungen durch das Projektteam eruiert. Die Revitalisierung und<br />
Vernetzung der Gewässersysteme und Wiederherstellung der Durchwanderbarkeit der<br />
Hauptflüsse, sowie deren Zuflüsse, werden voraussichtlich nicht aus den finanziellen Mitteln im<br />
Kleinfischprojekt bestreitbar sein. Das Projektteam wird daher versuchen, die Ansprüche der<br />
untersuchten Kleinfischarten in Projekte mit vordergründig anderer Zielstellung zu etablieren.<br />
Gedacht wird hier vor allem an wasserbauliche Projekte, die etwa zur Verbesserung des<br />
Hochwasserschutzes durchgeführt werden oder die die Erreichung des „guten ökologischen<br />
Zustandes“ der Gewässer zum zentralen Ziel haben.<br />
Mittels entsprechender Öffentlichkeitsarbeit sollen neben den Bürgern, allen voran den Fischern,<br />
auch die jeweils zuständigen Behörden, Amtssachverständige und andere, mit unseren<br />
Gewässern befasste Personen auf die dramatische Situation der Kleinfischbestände aufmerksam<br />
gemacht werden. Damit soll ein Schutzbewusstsein hervorgerufen werden, das sich im<br />
Engagement einzelner Bevölkerungsgruppen, letztendlich aber auch in diversen<br />
naturschutzfachlichen und wasserrechtlichen Bewilligungsverfahren niederschlägt, in denen<br />
bestenfalls für die Kleinfischarten förderliche Maßnahmen, beispielsweise als<br />
Kompensationsmaßnahmen für geplante Eingriffe in den Naturhaushalt, formuliert werden.<br />
93
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
7 LITERATUR<br />
AHNELT, H. & TIEFENBACH, O. (1994): Verbreitungsmuster zweier Steinbeißerarten (Cobitis aurata,<br />
Cobitis taenia) im Einzugsgebiet der Mur (Österreich). Fischökologie 7: 11-24.<br />
AHNELT, H. & MIKSCHI, E. (2004): Zwei Goldsteinbeißerarten (Teleostei, Cobitidae, Sabanejewia) in<br />
Österreich? Österr. Fischerei 57: 94–96.<br />
ANONYMUS (1979): Ein Rückblick für jüngere Fischerkameraden. Österreichs Fischerei 32: 117-<br />
119.<br />
ARGUS (1910): Ist der Neunaugenzopf für Huchen nur ein ausgesprochener Reizköder?<br />
Österreichische Fischerei-Zeitung 7: 12-13.<br />
ARSCOTT, D. B., TOCKNER, K. & WARD, J. V. (2001). Thermal heterogeneity along a braided<br />
floodplain river (Tagliamento River, northeastern Italy). Canadian Journal of Fisheries and Aquatic<br />
Sciences 58 (12): 2359-2373.<br />
AIGNER, J. & ZETTER, J. T. M. (1859): Salzburgs Fische. Jahres-<strong>Bericht</strong> des vaterländischen<br />
Museums Carolino-Augusteum der Landes-Hauptstadt Salzburg: 72-92.<br />
BANARESCU, P., HERZIG-STRASCHIL, B. (1998): Beitrag zur Kenntnis der Leuciscus-Untergattung<br />
Telestes Bonaparte (Pisces: Cyprinidae). Annalen des Naturhistorischen Museums Wien 100B:<br />
405-424.<br />
BART, U. & C. GUMPINGER (2009): Umfahrung Haid – Westspange Dammstraße.<br />
Kollaudierungsbericht der gewässerökologischen Bauaufsicht im Auftrag des Amtes der Oö.<br />
Landesregierung, Abt. Strategische Straßenplanung und Netzausbau.<br />
BERG, K., C. SCHEDER & C. GUMPINGER (2009): Restwasserstudie Untere Enns KM 8,1 – KM 0,0:<br />
Teiluntersuchung Fischfauna und Makrozoobenthos. Im Auftrag des Amtes der<br />
Oberösterreichischen Landesregierung, Direktion für Umwelt und Wasserwirtschaft, Abteilung<br />
Anlagen-, Umwelt- und Wasserrecht.<br />
BIRD, D. J. & POTTER, I. C. (1979): Metamorphosis and the paired species of lampreys, Lampetra<br />
fluviatilis (L.) and Lampetra planeri (Bloch). 2. Quantitative data for body proportions, weights,<br />
lengths and sex rations. J. Linn. Soc. Lond. 65: 145-160.<br />
BLESS, R. (1996 a): Zum Laichverhalten und zur Ökologie früher Jugendstadien des Strömers<br />
(Leuciscus souffia Risso, 1826). Fischökologie, 10, 1-10.<br />
BLESS, R. (1996 b): Reproduction and habitat preference of the threatened spirlin (Alburnoides<br />
bipunctatus Bloch) and sufie (Leuciscus souffia Risso) under laboratory conditions (Teleostei:<br />
Cyprinidae). In: Kirchhofer. A. & D. Hefti (1996): Conservation of Endangered Freshwater Fish in<br />
Europe. 249-258. Birkhäuser Verlag, Basel, Boston, Berlin.<br />
BLOHM, H.P.. D. GAUMERT & M. KÄMMEREIT (1994): Leitfaden für die Wieder- und Neuansiedlung<br />
von Fischarten. Binnenfischerei in Niedersachsen, Heft 3, pp.90, Hildesheim.<br />
BOHL, E. & STROHMAIER, W. (1992): Versuche zur Fortpflanzung des Bachneunauges. Fischer &<br />
Teichwirt 12: 447-451.<br />
BOHL, E. (1992): Rundmäuler und Fische im Sediment. Ökologische Untersuchungen zur<br />
Bestands- und Lebensraumsituation von Bachneunauge (Lampetra planeri), Schlammpeitzger<br />
(Misgurnus fossilis) und Steinbeißer (Cobitis taenia) in Bayern. Bayerische Landesanstalt für<br />
Wasserforschung, München. 129 S.<br />
BOHL, E. (1995a): Habitatansprüche und Gefährdungspotential von Neunaugen. Fischökologie 8:<br />
81-92.<br />
BOHL, E. (1995b): Neunaugen-Vorkommen in Bayern. Fischökologie 8: 43-52.<br />
94
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
BOHL, E. (1995c): Untersuchungen zur Fischfauna und ihren Lebensgrundlagen in der unteren<br />
Salzach und ihren Nebengewässern. Münchener Beiträge zur Abwasser-, Fischerei und<br />
Flußbiologie 48: 197-218.<br />
BOHL, E., HERRMANN, M., OTT, B., SEITZ, B. HEISE, J. (2004): Untersuchungen zur<br />
Fortpflanzungsbiologie, Entwicklung und zu den Lebensräumen von Schneider (Alburnoides<br />
bipunctatus BLOCH 1782) und Strömer (Leuciscus souffia agassizi VALENCIENNES 1844).<br />
Bayerisches Landesamt für Wasserwirtschaft. Abschlussbericht über die Untersuchungen 2002-<br />
2004, pp.96.<br />
BOHLEN, J. (1999a): Reproduction of spined loach, Cobitis taenia, under laboratory conditions. J.<br />
Appl. Ichthyol. 15: 49-53.<br />
BOHLEN, J. (1999b): Behaviour and microhabitat of early life stages of Cobitis taenia. Folia Zool.<br />
49, (Suppl. 1): 173 - 178.<br />
BOHLEN, J. (2000): Similarities and differences in the reproductive biology of loaches under<br />
laboratory conditions. Folia Zool. 49 (Suppl. 1): 179-186.<br />
BOHLEN, J. & RÁB, P. (2001): Species and hybrid richness in spined loaches of the genus Cobitis<br />
(Teleostei: Cobitidae), with a checklist of European forms and suggestions for conservation.<br />
BOHLEN, J. (2003): Temperature and oxygen requirements of early life stages of the endangered<br />
spined loach, Cobitis taenia L. (Teleostei, Cobitidae) and implications for the management of<br />
natural populations. Archiv für Hydrobiologie 157: 195-212.<br />
BOHLEN, J. (2008): First report on the spawning behaviour of a golden spined loach, Sabanejewia<br />
vallachia (Teleostei: Cobitidae). Folia Zool. 57 (1-2): 139-146.<br />
CARPENTIER, A., GOZLAN, R. E., COUCHEROUSSET, J., PAILLISSON, J.-M., MARION, L. (2007): Is<br />
topmouth gudgeon Pseudorasbora parva responsible for the decline in sunbleak Leucaspius<br />
delineatus populations? J. Fish Biol. 71 (Suppl. D.): 274-278.<br />
CHRANILOV, N. S. (1925): Vergleichende anatomische Untersuchungen des Schwimmblasenapparates<br />
der Fische aus der Familie der Cobitidae. Trav. Soc. Nat. Leningrad 55: 45 -89.<br />
CSAR, D. (2004): Untersuchung des Najadenbestandes und der Wasser- und Umweltparameter im<br />
Leitenbach (Oberösterreich). Speziell: Flussperlmuschel (Margaritifera margaritifera) und Gemeine<br />
Flussmuschel (Unio crassus f. cytherea). Diplomarbeit Univ. Salzburg.<br />
CSAR, D. & C. GUMPINGER (2009): Ergänzende gewässerökologische Erhebungen im Rahmen des<br />
Landschaftspflegeplans „Böhmerwald & Mühltäler“. – Im Auftrag des Amtes der<br />
Oberösterreichischen Landesregierung Direktion für Landesplanung, wirtschaftliche und ländliche<br />
Entwicklung, Abteilung Naturschutz und Direktion Umwelt und Wasserwirtschaft, Abteilung<br />
Oberflächengewässerwirtschaft.<br />
Delic, A., Bucar, M., Kucinic, M. & Mrakovcic, M. (2003): New data about Distribution of<br />
Sabanejewia balcanica (Karaman, 1922) (Cobitidae) in Croatia. Folia biologica (Krakow) 51, Suppl.<br />
39-42.<br />
DÜMPELMANN, C. (2008): Die Renaissance des Steinbeißers in Hessen. 6. Tagung der Gesellschaft<br />
für Ichthyologie (GFI), 13.-15. März 2008, Zoologische Staatssammlung München.<br />
DUßLING, U. & R. BERG (2001): Fische in Baden-Württemberg. Ministerium für Ernährung und<br />
Ländlichen Raum Baden-Württemberg, Stuttgart, pp.176.<br />
FARR-COX F., LEONARD S., & A. WHEELER (1996): The status of the recently introduced fish<br />
Leucaspius delineatus (Cyprinidae) in Great Britain. Fisheries Management and Ecology 3: 193-<br />
199.<br />
FRAAS (1854): Die künstliche Fischerzeugung nach den Erfahrungen der künstlichen<br />
Fischzuchtanstalt des General-Comité des landwirtschaftlichen Vereins von Bayern an der<br />
95
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
k.Central-Thierarzneischule zu München. Literarisch-artistische Anstalt der J. G. Cotta'schen<br />
Buchhandlung. 79 + IV Seiten.<br />
FREYHOF, J. (1999): Eine verwirrende Artgruppe: Steinbeißer. DATZ 52 (11): 14-18.<br />
FREYHOF, J. & KORTE, E. (2005): The first record of Misgurnus anguillicaudatus in Germany.<br />
Journal of Fish Biology 66: 568–571.<br />
FRIEDL, T. (1995): Zur Verbreitung von Neunaugen in Kärntner Fließgewässern – ein<br />
Zwischenbericht. Fischökologie 8: 31-42.<br />
FITZINGER, L. J. (1832): Ueber die Ausarbeitung einer Fauna des Erzherzogthumes Oesterreich,<br />
nebst einer systematischen Aufzählung der in diesem Lande vorkommenden Säugethiere,<br />
Reptilien und Fische, als Prodrom einer Fauna derselben. Beiträge zur Landeskunde Oesterreich’s<br />
unter der Enns 1: 280-340<br />
FREUDLSPERGER, H. (1936): Kurze Fischereigeschichte des Erzstiftes Salzburg - Teil 1.<br />
Mitteilungen der Gesellschaft für Salzburger Landeskunde 76: 81-128.<br />
GERSTMEIER, R., ROMIG, T. (1998): Die Süßwasserfische Europas. Kosmos Verlag, Stuttgart,<br />
pp.367.<br />
GEYER, F. (1940): Der ungarische Hundsfisch (Umbra lacustris Grossinger). Z. Morph. Ökol. Tiere,<br />
36 (5): 745 – 809.<br />
GILLES, A., R. CHAPPAZ, L. CAVALLI, M. LÖRTSCHER & E. FAURE (1998): Genetic differentiation and<br />
introgression between putative subspecies of Leuciscus soufia (Teleostei: Cyprinidae) of the region<br />
of the Mediterranean Alps. Canadian Journal of Fisheries and Aquatic Sciences 55: 2341-2354.<br />
GOZLAN, R. E., ST-HILAIRE, S., FEIST, S. W., MARTIN, P. & KENT, M. L. (2005). Disease threat to<br />
European fish. Nature 435, 1046.<br />
GRIEB, A. W. (1936): Die larvale Periode in der Entwicklung des Schlammbeißers (Misgurnus<br />
fossilis). Acta zool. 18: 339 – 344.<br />
GUMPINGER, C. & SILIGATO S. (2002): Fachgutachten im Rahmen der Umweltverträglichkeitserklärung<br />
für das Projekt „Hochwasserschutz Machland“, Schutzgut: Tiere und deren<br />
Lebensräume, Fachbereich Fischökologie. - Wels, 71 S..<br />
GUMPINGER, C., SCHEDER C. & SILIGATO S. (2005): UVE-Machland 2005, Ergänzung: Baulos 8<br />
„Mulde“. - i. A. des Amtes der Oö. Landesregierung, Abt. Wasserwirtschaft / Schutzwasserwirtschaft<br />
und Hydrographie, Wels, 32 S..<br />
HAIDVOGL, G. & WAIDBACHER, H. (1997): Ehemalige Fischfauna an ausgewählten österreichischen<br />
Fließgewässern. Univ. f. Bodenkultur, Abt. für Hydrobiologie, Fischerei-wirtschaft und Aquakultur.<br />
Studie gefördert durch die Östereichische Nationalbank. 86 S.<br />
HARDISTY, M. W. & POTTER, I. C. (EDS., 1971): The biology of lampreys. Academic Press, London.<br />
HARDISTY, M. W. (1986): A General Introduction to Lampreys. In: HOLCÍK, J. (Ed.): The Freshwater<br />
Fishes of Europe. Vol. 1/1 Petromyzontiformes. Aula Verlag Wiesbaden. 315 S.<br />
HARKA, A. (1986): A törpe csik (Cobitis aurata, FILIPPI, 1865). – Halazat 32: 1.<br />
HAUNSCHMID R. & PETZ-GLECHNER, R. (2007). Fischökologische Untersuchung der aufgelösten<br />
Rampe am Leitenbach zwischen 2005 und 2007. ÖWAV-Kurs „Naturnaher Wasserbau –<br />
Praxiskurs Durchgängigkeit.“ Zell an der Pram. Vortrag vom 10.-11.10.2007.<br />
HECKEL, J. (1854): Die Fische der Salzach. Verhandlungen des zoologisch-botanischen Vereins in<br />
Wien 4: 189-196.<br />
HECKEL, J. & R. KNER (1858): Die Süsswasserfische der österreichischen Monarchie mit Rücksicht<br />
auf die angränzenden Länder. - Verlag von Wilhelm Engelmann, Leipzig, 388 S..<br />
96
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
HELLER (1871): Die Fische Tirols und Vorarlbergs. Separat-Abdruck aus der Ferdinandeums-<br />
Zeitschrift vom Jahre 1871.<br />
HERZIG, A. ET AL. (1994): Fischökologische Studie Neusiedler See. BFB - <strong>Bericht</strong> 81,<br />
Naturkundliche Station Illmitz.<br />
HINTERHOFER, M., UNFER, G. & PINTER, K. (2007): Nachhaltiges Bewirtschaftungskonzept Kleiner<br />
Kamp" Studie im Auftrag der NÖ Landesregierung, Abteilung Naturschutz<br />
HÖFER (1815): Ethymologisches Wörterbuch der in Oberdeutschland, vorzüglich aber in Österreich<br />
üblichen Mundart. Erster Teil. Linz.<br />
HOLCIK, J. (1995): Geographische Verbreitung von Neunaugen (Petromyzontiformens) in der<br />
mittleren und unteren Donau (zwischen Österreich und dem Schwarzen Meer). Fischökologie 8:<br />
23-30.<br />
HOLZER G., UNFER G., HINTERHOFER M. (2007): Fischbestandserhebung im Revier YBBS BI/1-l. Im<br />
Auftrag des NÖ-Landesfischereiverbandes.<br />
HONSIG-ERLENBURG, W., FRIEDL, T. & KERSCHBAUMER, G. (2002): Fische und Neunaugen. In:<br />
HONSIG-ERLENBURG, W. & PETUTSCHNIG, W. (Hrsg.): Fische, Neunaugen, Flusskrebse,<br />
Großmuscheln. Sonderreihe Natur Kärnten Band 1, Naturwissenschaftlicher Verein für Kärnten,<br />
Klagenfurt. S. 33-165.<br />
HUET, M., 1949. Apercu des relations entre la pente et les populations piscicoles des eaux<br />
courantes. Schweiz. Z, Hydrol. 11(3-4): 332-351.<br />
JÄCKEL, A. J. (1864): Die Fische Bayerns, ein Beitrag zur Kenntniss der deutschen<br />
Süsswasserfische. Pustet, Regensburg. 101 S.<br />
JUNGWIRTH, M. (1984): Quantitative Fischbestandsaufnahme. In: RADLER, S. (Hrsg.): Naturnahes<br />
Regulierungskonzept Pram. Wiener Mittlg. 55, 272 S.<br />
JUNGWIRTH M. & S. MUHAR, ZAUNER G., KLEEBERGER J. , KUCHER T. (1996): Die steirische Enns;<br />
Fischfauna und Gewässermorphologie, Universität für Bodenkultur, Abteilung Hydrobiologie,<br />
Fischereiwirtschaft und Aquakultur, Wien<br />
KAINZ, E. (1991): Erstnachweis des Goldsteinbeißers (Cobitis aurata DeFilippi) in Österreich.<br />
Österreichs Fischerei 44 (5/6): 141.<br />
KAINZ, E. & H. P. GOLLMANN (1998): Aufzuchtversuche beim Strömer (Leuciscus souffia agassizi<br />
Risso). Österreichs Fischerei 51: 19-22.<br />
KAINZ, E. & GOLLMANN, H. P (2000): Notiz zum Vorkommen von Frauennerflingen (Rutilus pigus<br />
virgo Heckel) und Steinbeißern (Cobitis taenia L.) in Oberösterreich. Österreichs Fischerei 53: 246.<br />
KAPPUS, B., HOLCIK, J. & SALEWSKI, V. (1995): Taxonomie von Neunaugen der oberen Donau.<br />
Fischökologie 8: 63-80.<br />
KAPPUS, B. & RAHMANN, H. (1995): Zusammenfassende Aspekte zum gegenwärtigen Stand der<br />
Neunaugen-Forschung in Mitteleuropa – Ergebnisse des Neunaugen-Symposiums in Stuttgart.<br />
Fischökologie 8: 109 – 118.<br />
KARAMAN, S. (1922): Über eine neue Cobitis-Art aus Jugoslawien, Cobitis balcanica n. sp. –<br />
Glasnik Kroat. – Naturwiss. Ges. Zagreb 34: 1-4.<br />
KÄFEL, G. (1991a): Autökologische Untersuchungen an Misgurnus fossilis im March-Thaya<br />
Mündungsgebiet. Diss. Univ. Wien: 109 S.<br />
KÄFEL, G. (1991b): Misgurnus fossilis, einige Überlegungen zum Thema Artenschutz. Hydroskop 3<br />
(1): 13 – 16.<br />
97
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
KÄFEL, G. (1993): Besonderheiten und Gefährdung von Misgurnus fossilis. Österreichs Fischerei<br />
46 (4): 83 – 90.<br />
KERSCHNER, T. (1928): Verbreitungskarten der Mühlviertler Fische, nicht publiziert. In: ZICK, D.:<br />
Fischökologische Leitbilderstellung im Fischereirevier Rohrbach. BAW, IGf. Scharfling. I. A.<br />
Fischereirevier Rohrbach. 64 S.<br />
KERSCHNER, T. (1956): Der Linzer Markt für Süßwasserfische. Naturkundliches Jahrbuch der Stadt<br />
Linz 1956. Linz.<br />
KIRCHHOFER, A. (1995): Schutzkonzept für Bachneunaugen (Lampetra planeri) in der Schweiz.<br />
Fischökologie 8: 93-108.<br />
KOFLER, A. (1980): Zum Vorkommen von Fischen in Osttirol. Carinthia II 170/90: 495-516.<br />
KOLLMANN, J. (1898): Karte der Fischarten vom Land Salzburg.<br />
KOTTELAT, M. (1997): European freshwater fishes. An heuristic checklist of the freshwater fishes of<br />
Europe (exclusive of former USSR), with an introduction for non-systematics and comments on<br />
nomenclature and conservation. Biologia, Bratislava, Section Zoology 52 (suppl. 5): 1 – 271.<br />
KOTTELAT, M., FREYHOF, J. (2007): Handbook of European freshwater fishes. Kottelat, Cornol,<br />
Switzerland and Freyhof, Berlin, Germany, pp. 646.<br />
KOURIL, J. et al. (1996): The artificial propagation and culture of youg weatherfish (Misgurnus<br />
fossilis L.). Conservation of endangered freshwater fish in Europe. Birkhäuser Verlag, Basel.<br />
KRAFFT, C. (1874): Die neuesten Erhebungen über die Zustände der Fischerei in den im<br />
Reichrathe vertretenen Königreichen und Ländern an den österreichischungarischen<br />
Meeresküsten. Wien, k.k. statistischer Central-Commission.<br />
KRAPPE, M. (2008): Entwicklung morphologischer Parameter im adulten Stadium des<br />
Bachneunauges. 6. Tagung der Gesellschaft für Ichthyologie (GFI), 13.-15. März 2008,<br />
Zoologische Staatssammlung München.<br />
KUHN, M. (1992): Lebensraumansprüche des Bachneunauges Lampetra planeri, Bloch. Eine<br />
vergleichende Habitatanalyse. – Lizentiatsarbeit, Univ. Bern. 65 S.<br />
KUKULA, W. (1874): Die Fischfauna Oberösterreichs. Fünfter Jahres-<strong>Bericht</strong> des Vereines für<br />
Naturkunde in Österreich ob der der Enns zu Linz. Verein für Naturkunde zu Linz: 2-25.<br />
LEUNER, E., KLEIN, M., BOHL, E., JUNGBLUTH, J.H., GERBER, J. & K. GROH (2000): Ergebnisse der<br />
Artenkartierungen in den Fließgewässern Bayerns – Fische, Krebse, Muscheln. Bayerisches<br />
Staatsministerium für Ernährung, Landwirtschaft und Forsten, pp. 212.<br />
LEVIN, B. A. & HOLCIK, J. (2006): New data on the geographic distribution and ecology of the<br />
Ukrainian brook lamprey, Eudontomyzon mariae (Berg, 1931). Folia Zool. 55 (3): 282 – 286.<br />
LORI, T. (1871): Die Fische in der Umgegend von Passau. 9. Jahrsbericht des naturhistorischen<br />
Vereines in Passau, S. 99-104.<br />
MACHORDOM, A., Y. NICOLAS & A. J. CRIVELLI (1999): Genetic variability and differentiation in<br />
Leuciscus (Telestes) souffia. Taxonomic and conservation inferences. C. R. Acad. Sci. Paris,<br />
Sciences de la vie/Life Sciences, 322, 15-28.<br />
MAITLAND, P. S. (1980): Review of the ecology of Lampreys in Northern Europe. Can. J. Fish.<br />
Aquat. Sci. 37: 1944-1952.<br />
MAITLAND, P.S. & K. LINSELL (2006): Philip´s guide to Freshwater Fish of Britain and Europe.<br />
Philip´s – Octopus Publishing Group, London, pp. 272.<br />
MALMQVIST, B. (1980a): Habitat Selection of Larval Brook Lampreys (Lampetra planeri, Bloch) in a<br />
South Swedish Stream. Oecologia 45: 35 – 38.<br />
98
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
MALMQVIST, B. (1980b): The spawning migration of the brook lamprey, Lampetra planeri Bloch, in a<br />
South Swedish Stream. J. Fish Biol. 16: 105 – 114.<br />
MALMQVIST, B. (1983): Breeding behaviours of brook lampreys Lampetra planeri: experiments on<br />
mate choice. Oikos 41: 43-48.<br />
MARGREITER (1933 - 1935): Die Fische Tirols und Vorarlbergs. Vorarlberger Jagd und Fischerei.<br />
Innsbruck. Teil 1: Jg. 8 Heft 1, Teil 2:Jg. 8 Heft 2, Teil 3: Jg. 10 Heft 3, Teil 4: Jg. 10 Heft 4.<br />
MERWALD, F. (1960): Der Steyregger Graben und seine Fischwelt. Naturkdl. Jb. d. Stadt Linz, Jg.<br />
6, 311-326.<br />
MEYER, L. & D. HINRICHS (2000): Microhabitat preferences and movements of the weatherfish,<br />
Misgurnus fossilis, in a drainage channel. Environ. Biol. Fish 58 (3): 297–306.<br />
MILLS, S. C. & REYNOLDS, J. D. (2003): The bitterling-mussel interaction as a test case for<br />
coevolution. Journal of Fish Biology 63: 84-104.<br />
MOORE, J. W. & POTTER, I. C. (1976): A laboratory study on the feeding of larvae of the brook<br />
lamprey Lampetra planeri, Bloch. J. Anim. Ecol. 45: 81-90.<br />
MOJSISOVICS VON MOJSVAR, A. (1897): Das Thierleben der österreichisch-ungarischen Tiefebenen.<br />
Wien.<br />
MORRIS, K. H. & P. S. MAITLAND (1987): A trap for catching adult lampreys (Petromyzonidae) in<br />
running water. Journal of Fish Biology 31 (4): 513-516.<br />
PAPOUSEK, I., VETESNIK, L., HALACKA, K., LUSKOVA, V., HUMPL, M. & MENDEL, J. (2008):<br />
Identification of natural hybrids of gibel carp Carassius auratus gibelio (Bloch) and crucian carp<br />
Carassius carassius (L.) from lower Dyje River floodplain (Czech Republic). Journal of Fish Biology<br />
(2008) 72, 1230–1235.<br />
PERDICES, A., DOADRIO, I., ECONOMIDIS, P. S., BOHLEN, J. & P. BARANESCU (2003): Pleistocene<br />
effects on the European freshwater fish fauna: double origin of the cobitid genus Sabanejewia in<br />
the Danube basin (Osteichthyes: Cobitidae). Molecular Phylogenetics and Evolution 26: 289–299.<br />
POVZ, M. & SUMER, S. (2000): Present status and distribution of the species of the genera<br />
Misgurnus, Cobitis and Sabanejewia in Slovenia. Folia Zool. 49, Suppl. 1: 107 – 112.<br />
REICHARD, M., PRZYBYLSKI, M., KANIEWSKA, P., LIU, H. & SMITH, C. (2007): A possible evolutionary<br />
lag in the relationship between freshwater mussels and European bitterling. Journal of Fish Biology<br />
70: 709-725.<br />
REICHENBACH-KLINKE, H. (1968): Fischfauna und Fischerei in der deutschen Donau. Arch.<br />
Hydrobiol./Suppl- XXXIV (1/2): 12-23.<br />
REICHHOLF, J. (1989): Die Fischfauna des Unteren Inn: Eine Übersicht. Mitt. Zool. Ges. Braunau.<br />
Bd. 5. Nr. 5/8: S. 107 – 110.<br />
REMBISZEWSKI, J. M. (1968): Observations on hybrids of Lampetra (Lampetra) planeri (Bloch,<br />
1784) x Lampetra (Eudontomyzon) mariae Berg, 1931. Věstník Čs. Spol. Zool. 32: 390–393.<br />
RENAUD, C. B. (1982): Revision of the lampreys genus Regan, 1911. M. Sc. thesis, Univ. Ottawa,<br />
146 pp.<br />
RITTERBUSCH, D. & BOHLEN, J. (2000): On the ecology of spined loach in Lake Müggelsee. Folia<br />
Zool. 49 (Suppl. 1): 187 - 192.<br />
ROBOTHAM, P. W. J. (1978): Some factors influencing the microdistribution of a population of spined<br />
loach, C. taenia. Hydrobiologia 61: 161 – 167.<br />
ROBOTHAM, P. W. J. (1982): An analysis of a specialized feeding mechanism of the Spined Loach,<br />
Cobitis taenia (L.), and a description of the related structures.<br />
99
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
SALEWSKI, V. (1991): Untersuchungen zur Ökologie und Biometrie einer Neunaugen-Population<br />
(Lampetra planeri) im Odenwald. Fischökologie 4: 7-22.<br />
SALZBURGER, W., A. BRANDSTÄTTER, A. GILLES, W. PARSON, M. HEMPEL, C. STURMBAUER & A.<br />
MEYER (2003): Phylogeography of the vairone (Leuciscus souffia, Risso 1826) in Central Europe.<br />
Molecular Ecology 12: 2371-2386<br />
SAMEK, M. (2000): Die Ökologie des Steinbeißers im Copacabana-Freizeitsee. Diplomarbeit Univ.<br />
Graz, 58 S.<br />
SCHEDER, C. & C. GUMPINGER (2007) Bewertung des ökologischen Zustandes von Naarn,<br />
Schwemmnaarn, Mettensdorfer Mühlbach und Aistmühlbach. <strong>Bericht</strong> im Auftrag des Amtes der<br />
Oö. Landesregierung, Abteilung Wasserwirtschaft, Schutzwasserwirtschaft und Hydrographie, 34<br />
S.<br />
SCHEIBER, A. M. (1930): Geschichte der Fischerei in OÖ, insbesondere Traunfischerei.<br />
Heimatgaue, Zeitschrift für oberösterreichische Geschichte, Landes- und Volkskunde. Verlag<br />
Pirngruber, Linz. 10. - 12. Jhg.<br />
SCHLOTT, G. & SCHLOTT-IDL, K. (1991): Die Fischarten im Einzugsgebiet der Lainsitz. Ber. Ökol.<br />
Station Waldviertel 3: 73 - 83.<br />
SCHMALL, B. (2008): Die Fischarten der Salzach. Historisch – aktuell – Zukunft. Rückgangsursachen.<br />
Univ. Salzburg, FB Organismische Biologie. Unveröff. Manuskript. 152 S.<br />
SCHMUTZ, S.; KAUFMANN, M.; VOGEL, B. & JUNGWIRTH, M. (2000): Methodische Grundlagen und<br />
Beispiele zur Bewertung der fischökologischen Funktionsfähigkeit österreichischer Fießgewässer.<br />
BMLFUW, Wasserwirtschaftskataster, Wien.<br />
SCHNEEWEIS, F. (1979): Innfischerei. Die traditionelle Fischerei im Oberösterreichisch-Bayerischen<br />
Inngebiet und ihre Wandlung vom Ende des neunzehnten Jahrhunderts bis zur Gegenwart in<br />
volkskundlicher Sicht. Dissertation Univ. Wien,<br />
SCHOTZKO, N. & JAGSCH, A. (2007): Fischbestandsaufnahme Unterer Inn, Braunau bis Kirchdorf<br />
2007. BAW, IGf Scharfling I. A. Abt. Naturschutz, Land OÖ. 48 S.<br />
SCHRANK, F. V. P. (1798): Fauna Boica. Durchdachte Geschichte der in Baiern einheimischen und<br />
zahmen Thiere. Band 1.2.4. Fische. Stein’sche Buchhandlung, Nürnberg. 46 S.<br />
SCHROLL, F. (1958): Zur Ernährungsbiologie der steirischen Ammocoeten Lampetra planeri<br />
(BLOCH) und Eudontomyzon danfordi (REGAN). Inauguraldissertation K. F. Universität Graz. 126<br />
S.<br />
SCHROLL, F. (1959): Zur Ernährungsbiologie der steirischen Ammocoeten Lampetra planeri<br />
(BLOCH) und Eudontomyzon danfordi (REGAN). Int. Rev. ges. Hydrobiol. 44: 395 – 429.<br />
SCHROLL, F. (1969): Zur Problematik der Systematik der Neunaugen im ostalpinen Raum.<br />
Mitteilungen des Naturwissenschaftlichen Vereins Steiermark 99: 55-58.<br />
SCHWARZ, M. (1998): Biologie, Gefährdung und Schutz des Strömers (Leuciscus souffia) in der<br />
Schweiz. Mitteilungen zur Fischerei Nr. 59. Bundesamt für Umwelt, Wald und Landschaft<br />
(BUWAL), Bern, pp.55.<br />
SIEBOLD, C. (1863): Die Süßwasserfische von Mitteleuropa. Verlag von Wilhelm Engelmann,<br />
Leipzig. 430 S.<br />
SILIGATO, S. & GUMPINGER C. (2003): Das österreichische Maltsch-System. Fischökologische<br />
Bestandsanalyse und gewässerökologischer Managementplan mit Ergänzungen zur Fischfauna im<br />
tschechischen Teil des Einzugsgebietes. – In: WWF (Hrsg.): Landschaftspläne<br />
Europaschutzgebiet Maltsch – Erhebungsergebnisse und Vorschläge zum Management. WWF-<br />
Studie Nr. 48, Linz, 64 – 88.<br />
100
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
SILIGATO, S. & GUMPINGER, C. (2004): Erfassung und Bewertung des fischökologischen Zustands<br />
des Aschach-Teileinzugsgebietes oberhalb des Aschachdurchbruches. I. A. Amt der Oö.<br />
Landesregierung, Abt. Wasserwirtschaft/Gewässerschutz.<br />
SILIGATO, S. & GUMPINGER, C. (2005): Fischökologischer Zustand OÖ. Gewässerstrecken. I. A.<br />
OÖ. Landesregierung, Wasserwirtschaft, Gewässerschutz. Linz. Gewässerschutz <strong>Bericht</strong> 31/2004.<br />
122 pp.<br />
SPILLMANN, J. (1962): Sur la systématique de Telestes soufia (Risso). Variation de certains<br />
charactères numériques et métriques de´l espéche. Bulletin de Muséum national d´Histoire<br />
naturelle 34: 435-452.<br />
SPINDLER, T., HOLCIK, J. & HENSEL, K. (1992): Die Fischfauna der österreichischtschechoslowakischen<br />
Grenzstrecke der March samt ihrem Einzugsgebiet. Forschungsbericht<br />
Fischereimanagement 2, WWF Österreich. 180 S.<br />
SPINDER, T. (1997): Fischartenkartierung FRV I, Krems. Großer Kamp, Mühlkamp. Studie I. A. des<br />
NÖ. Fischereiverbandes I, Krems.<br />
SPINDLER, T. (1997): Fischfauna in Österreich. Ökologie - Gefährdung - Bioindikation - Fischerei -<br />
Gesetzgebung. Monographien des Umweltbundesamtes, Band 87, Wien.<br />
SPINDLER T., WINTERSBERGER, T., MEDGYESY, N. & MARK, W. (2002): Inn 2000. Die Gewässer- und<br />
Fischökologie des Inn und seiner Seitengewässer. Studie i. A. Tiroler Fischereiverband.<br />
STEINHÖRSTER, U. (2000): Untersuchung der Fischbestände im Unteren Inn / Staustufe Ering.<br />
Studie i. A. Landesfischereiverband Bayern e. V. Abschlussbericht, 38 S.<br />
STEINMANN, I. & R. BLESS (2004): Fische und Rundmäuler der FFH-Richtlinie. In: PETERSEN, B.;<br />
ELLWANGER, G., BLESS, R., BOYE, P., SCHRÖDER, E. & SYMANK, A. (Bearb.): Das europäische<br />
Schutzgebietssystem Natura 2000 – Ökologie und Verbreitung von Arten der FFH-Richtlinie in<br />
Deutschland – Band 2: Wirbeltiere. Schriftenreihe für Landschaftspflege und Naturschutz Heft 69/<br />
Band 2. Bundesamt für Naturschutz, Bonn, pp. 693.<br />
TATENHORST, L.; KASCHEK, N.; MEYER, E. I. (1999): Freilanduntersuchungen zur Habitatpräferenz<br />
des Steinbeißers (Cobitis taenia, L., Cobitidae, Osteichthyes). - Deutsche Gesellschaft für<br />
Limnologie (DGL) - Tagungsbericht 1999 (Rostock), Tutzing: 943-947.<br />
TATENHORST, L.; KASCHEK, N.; MEYER, E. I. (2002): DER STEINBEIßER (COBITIS TAENIA L.). Aspekte<br />
zur Ökologie einer bedrohten Art. - Münster: Schüling, 133pp und Anhang.<br />
TEROFAL, F. (1977): Das Artenspektrum der Fische Bayerns in den letzten 50 Jahren. Ber. d. Akad.<br />
f. Natursch. und Landschaftspfl. (Laufen/Salzach) 1: 9-22.<br />
TÜRK, R. EMBACHER, G., SCHWARZ, M. & WAUBKE, M. (1996): Der Naturraum um Seekirchen. In:<br />
DOPSCH, E. & DOPSCH, H. (Eds.): 1300 Jahre Seekirchen. Marktgemeinde Seekirchen am<br />
Wallersee. pp. 33-68.<br />
UIBLEIN, F., et al. (2000): Untersuchungen zur lokalen Anpassung, Gefährdung und Schutz der<br />
Äsche (Thymallus thymallus) in drei Gewässern in Oberösterreich. Österreichs Fischerei 53: 88-<br />
165.<br />
VAN DAMME, D., BOGUTSKAYA, N., HOFFMANN, R. C. & SMITH, C. (2007): The introduction of the<br />
European bitterling (Rhodeus amarus) to west and central Europe. Fish and Fisheries 8: 79-106.<br />
VASIL’EV, V., VASIL’EVA, E. D. & OSINOV, A. G. (1989). Evolution of a diploid-triploidtetraploid<br />
complex in fishes of the genus Cobitis (Pisces, Cobitidae). In: DAWLEY, R. M. & BOGART, J. P.<br />
(Eds.): Evolution and Ecology of Unisexual Vertebrates, pp. 153–169. New York: Albany Museum.<br />
101
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
WALLNER R. M. (2005). Aliens – Neobiota in Österreich. Bundesministerium für Land- und<br />
Forstwirtschaft, Umwelt und Wasserwirtschaft (Hrsg.): Grüne Reihe Bd. 15. Böhlau Verlag Wien.<br />
282 S.<br />
WANZENBÖCK, J. & KERESZTESSY, K. (1991): Kleingewässer als Rückzugsmöglichkeiten für<br />
bedrohte Fischarten im Raum Neusiedler See. Österreichisch-ungarische Forschungskooperation,<br />
unpubl. Endbericht. 154 S.<br />
WANZENBÖCK, J. & SPINDLER, T. (1995): Der Hundsfisch als Zielart für besonders gefährdete<br />
Feuchtgebietszonen. Artenschutzprogramm i. A. BMUJF und NÖ Landesregierung.<br />
WATERSTRAAT, A. (1989): Einfluß eines Gewässerausbaus auf eine Population des<br />
Bachneunauges Lampetra planeri (BLOCH, 1784) in einem Flachlandbach im Norden der DDR.<br />
Fischökologie 1 (2): 29 – 44.<br />
WEIMAIER, T. P. (1859): Versuch einer Topographie des Admontthales. In: FUCHS, G.: Kurzgefasste<br />
Geschichte des Benedictinier-Stiftes Admont. 2. verb. Aufl., Leykam´s Erben, Graz<br />
WIESNER, C., UNFER, G. & JUNGWIRTH, M. (2005): Inneralpines Flussraummanagement Obere Mur.<br />
Arbeitspaket A.2. Teilmanagementplan Fischökologisches/Fischereiliches Management. Studie i.<br />
A. d. Amts der Steiermärkischen Landesregierung, FA 19B, Graz.<br />
WIESNER, C. & GUMPINGER, C. (2005): Ergebnis der Fischbestandsaufnahme in den von der<br />
Errichtung der Donaubrücke Traismauer (S33) betroffenen Gewässern. Endbericht. I. A. d.<br />
ASFINAG.<br />
WOLFRAM, G. & MIKSCHI, E. (2002): Rote Liste der gefährdeten Neunaugen und Fische des<br />
Burgenlandes. Studie im Auftrag der Burgenländischen Landesregierung, 75 pp. + Anhang.<br />
WOLFRAM, G. & E. MIKSCHI (2007). Rote Liste der Fische (Pisces) Österreichs. Bundesministerium<br />
für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft (Hrsg.): Grüne Reihe des<br />
Lebensministeriums Bd. 14/2. Böhlau Verlag Wien. 515 S.<br />
WOLFRAM, G. WOSCHITZ,G., WOLFRAM, A. (2008): LIFE – Natur „Lafnitz – Lebensraumvernetzung<br />
an einem alpin-pannonischen Fluss“. Maßnahme F.2. Endbericht Wissenschaftliches Monitoring. I.<br />
A. Weideverein Ramsargebiet Lafnitztal und Direktion für Wasserwesen Szombathely. 328 S.<br />
WOSCHITZ, G., GUTTMANN, S., HOLZER, G., HINTERHOFER, M., PARTHL, G., SCHOBER, E. & WIESNER,<br />
C. (2001): Schutzwasserwirtschaftliches Grundsatzkonzept Raab – Bgld. I. A.<br />
Bundeswasserbauverwaltung Burgenland, Landeswasserbaubezirksamt Oberwart,<br />
Wasserbauleitung Güssing. 56 S.<br />
ZAUNER, G. & WOSCHITZ, G. (1992); Fischökologie. In: Hozang, B. & Zauner, G. (Hrsg.):<br />
Gewässerbetreuungskonzept Lafnitz. Burgenländische Landesregierung Abt. XIII/3 und<br />
Bundesministerium für Land- und Forstwirtschaft, Sektion IV, pp. 88-158.<br />
ZAUNER, G. (1995): Fischökologische Untersuchung in MUHAR, S. & JUNGWIRTH, M. (Eds.):<br />
Flußstudie Url.- Studie i. A. Url-Wasserverband und NÖ Landschaftsfonds.<br />
ZAUNER, G. , GLATZEL, J. & PINKA, P. (2001): Fischbiologische Untersuchung Reichersberger Au –<br />
Fischereiliches Bewirtschaftungskonzept; im Rahmen des „Life-Natur-Projektes Unterer Inn“.<br />
Studie im Auftrag der Oberösterreichischen Landesregierung, Naturschutzabteilung.<br />
ZAUNER, G. (2002): Fischökologische/fischereiliche Bestandesaufnahme und Gutachten im<br />
Zusammenhang mit der thermischen Belastung der Donau im Nahbereich der VÖEST. Studie im<br />
Auftrag der Vöest Alpine Stahl GmbH<br />
ZAUNER, G. & RATSCHAN, C. (2004): Schutzgütererhebung – Fische im Natura 2000 Gebiet AT<br />
2213000 „Steirische Grenzmur mit Gamlitzbach und Gnasbach“. Studie im Auftrag des<br />
Wasserverbandes Wasserversorgung Radkersburg.<br />
102
Artenschutzprojekt Kleinfische – Modul 1 Literatur<br />
ZAUNER, G. & RATSCHAN, C. (2005): Fische und Neunaugen. S. 322 - 426. In: ELLMAUER, T.<br />
(Hrsg.), Entwicklung von Kriterien, Indikatoren und Schwellenwerten zur Beurteilung des<br />
Erhaltungszustandes der Natura 2000-Schutzgüter. Band 2: Arten des Anhangs II der Fauna-<br />
Flora-Habitat-Richtlinie. Im Auftrag der neun österreichischen Bundesländer, des<br />
Bundesministerium f. Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft und der<br />
Umweltbundesamt GmbH, pp 28-129.<br />
ZAUNER, G. & RATSCHAN, C. (2006): UVE S10 Mühlviertel Schnellstraße. Fachbereiche<br />
Fischökologie und Fischerei. I. A. ASFINAG Bau Management GmbH<br />
ZAUNER, G., RATSCHAN, C. & MÜHLBAUER, M. (2006): GEK Obere Mur, Lonka, Taurach. AP 6<br />
Gewässerökologie. I. A. Sbg. Landresregierung, Wasserwirtschaft.<br />
ZAUNER, G., MÜHLBAUER, M. & RATSCHAN, C. (2006): Gewässer- und auenökologisches<br />
Restrukturierungspotential an der oberösterreichischen Donau. Studie im Auftrag des Amts der<br />
Oberösterreichischen Landesregierung, Wasserwirtschaft, Gewässerschutz.<br />
ZAUNER, G. & RATSCHAN, C. (2007): Erarbeitung von Grundlagen zur Erstellung des <strong>Bericht</strong>es nach<br />
Artikel 17 der FFH-Richtlinie. In ELLMAUER, T. (Red.): Österreichischer <strong>Bericht</strong> nach Artikel 17<br />
der FFH-RL. UBA I. A. der Bundesländer und des BMLFUW.<br />
ZAUNER, G., RATSCHAN, C. & MÜHLBAUER, M. (2007): UVE Voest Alpine Stahl GmbH. L6 Teil 1 und<br />
2. Fachbereiche Gewässerökologie und Fischerei. I. A. Voest Alpine Stahl GmbH<br />
ZAUNER, G., RATSCHAN, C. & MÜHLBAUER, M. (2008): Fischökologische Ist-Zustandserhebung in<br />
der Kleinen Salzach (Freilassinger Becken). Im Auftrag des Amts der Salzburger Landesregierung,<br />
Fachabteilung Wasserwirtschaft. 39 S.<br />
ZAUNER, G. & RATSCHAN, C. (2008): Gewässerzustandserhebung in Österreich, Fachbereich<br />
Fische, für die Beobachtungsjahre 2007 – 2009 im Bundesland Oberösterreich. Gewässer<br />
Kategorie C und D. I. A. Land OÖ, Abt. Wasserwirtschaft, Gewässerschutz.<br />
ZAUNER, G. & RATSCHAN, C. (2008): Gewässerzustandserhebung in Österreich, Fachbereich<br />
Fische. Enns-Kanal in Niederösterreich. I. A. Land NÖ.<br />
ZAUNER, G., RATSCHAN, C. & MUEHLBAUER, M. (2009): KW Spielfeld an der Mur. Herstellung der<br />
Fischpassierbarkeit mittels Umgehungsarm und Revitalisierung Gamlitzbach Unterlauf.<br />
Konzeption, Bauaufsicht und fischökologisches Monitoring. I. A. Verbund AHP.<br />
ZAUNER, G., MÜHLBAUER, M. & RATSCHAN, C. (2009): Erhebung der Fischwanderung aus der<br />
Donau in das Innbach-Aschach-System. Studie i. A. Land OÖ, Abt. Wasserwirtschaft,<br />
Gewässerschutz.<br />
ZITEK, A., SCHMUTZ, S. & JUNGWIRTH, M. (2004a): Fischökologisches Monitoring an den Flüssen<br />
Pielach, Melk und Mank im Rahmen des EU-LIFE Projektes „Lebensraum Huchen“. Endbericht.<br />
Univ. f. Bodenkultur, Institut für Hydrobiologie und Gewässermanagement. 113 S.<br />
ZITEK, A., UNFER, G., WIESNER, C., FLEISCHANDERL, D. & MUHAR, S. (2004b): Monitoring ökologisch<br />
orientierter Hochwasserschutzmaßnahmen an der sulm/Stmk. – Lebensraum und Fischfauna,<br />
Endbericht. Univ. f. Bodenkultur, Institut für Hydrobiologie und Gewässermanagement.<br />
ZITEK, A., HAIDVOGL, G., JUNGWIRTH, M., PAVLAS, P., SCHMUTZ, S. (2007): Ein ökologisch<br />
strategischer Leitfaden zur Wiederherstellung der Durchgängigkeit von Fließgewässern für die<br />
Fischfauna in Österreich. AP5 des MIRR-Projektes, Endbericht. Studie im Auftrag von<br />
Lebensministerium und Land Niederösterreich. 138 S.<br />
103
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
8 ABBILDUNGS- UND TABELLENVERZEICHNIS<br />
Abbildungen<br />
Abb. 1 Aktuelle Verbreitung der Zielfischarten in den untersuchten Gebieten in Oberösterreich<br />
..................................................................................................................................... 3<br />
Abb. 2: Übersichtskarte über die Verteilung der Befischungstellen im Rahmen des vorliegenden<br />
Projektes in Oberösterreich......................................................................................... 12<br />
Abb. 3: Habitus von Strömer (unten) und Schneider (oben) im Vergleich. Bild: C. Ratschan. .. 14<br />
Abb. 4: Fundorte des Strömers im Jahr 2008 im Vergleich zu früheren Nachweisen in der<br />
Umgebung. ................................................................................................................. 18<br />
Abb. 5: Längenfrequenz der gefangenen Strömer im Unterlauf der Enns (Gewässerzustandsüberwachungsverordnung<br />
GZÜV) und in den Stauräumen Losenstein und<br />
Großraming bzw. deren Zubringerbächen (Artenschutzprojekt Kleinfische). ............... 19<br />
Abb. 6: Begleitfischarten die zusammen mit Strömern an den verschiedenen Fundstellen<br />
nachgewiesen wurden. Blau: rheophile Arten, grün: indifferente Arten. ...................... 19<br />
Abb. 7: Frische, massiv ausgeführte und teure Uferverbauungen am Stiedlsbach mit aus<br />
schutzwasserwirtschaftlicher Sicht fragwürdiger Notwendigkeit, die die Habitat- und<br />
Laichplatzqualität für Strömer und andere Arten verringern. ....................................... 22<br />
Abb. 8: Querder aus dem Kenadinger Bach (Pfuda-Zubringer) mit für Eudontomyzon mariae<br />
typischer Marmorierung der Flanken. .......................................................................... 24<br />
Abb. 9: Neunaugen-Standorte im Fornacher Redlbach nahe der Mündung (links) und ca. 2,5<br />
km stromauf (rechts). .................................................................................................. 28<br />
Abb. 10: Neunaugen-Nachweise in Oberösterreich; Böhmische Masse (Granit- und Gneisgebiet)<br />
in blau. ........................................................................................................................ 30<br />
Abb. 11: Saugscheiben von L. planeri (Aist, links) sowie E. mariae aus dem Redlbach (Mitte)<br />
und der Pfuda (rechts). 1 .. exolaterale Zähne; 2 .. endolaterale Zähne; 3 .. posteriale<br />
Zähne ......................................................................................................................... 31<br />
Abb. 12: Größen von Neunaugen-Querdern (Balken) und Adulten (Punkte). n .. Individuenzahl;<br />
? .. Querder und Adulte nicht differenziert; Kärnten: div. Kärntner Gewässer. Stmk: div.<br />
steirische Gewässer (aus: SCHROLL, 1958). ................................................................ 33<br />
Abb. 13: Populationsaufbau in der Pfuda (links; April) und der Großen Mühl (rechts, August). .. 35<br />
Abb. 14: Typische „Neunaugen-Sedimentbank“ in der Pfuda bei Angsüß mit feinsandigschluffigem,<br />
mit organischem Material durchsetztem Sediment; links Überblick; rechts<br />
Detail. Auf dieser Bank konnten 61 Querder gefangen werden. .................................. 36<br />
Abb. 15: Makro-Aufnahmen von mit Querdern besiedeltem Sohlsubstrat aus dem Redlbach<br />
(links) und aus der Pfuda (rechts). .............................................................................. 36<br />
Abb. 16: Gefälle –Breiten-Verhältnisse der Probestellen mit und ohne Neunaugenfund an Pfuda<br />
(mit Zubringern) und Fornacher Redl nach Huet (1949). ............................................. 37<br />
Abb. 17: Im Kenadinger Bach kommen neben einer großen Sedimentbank im Mündungsbereich<br />
in die Pfuda auch kiesige Furten als potentielle Laichplätze vor (Hintergrund links). Hier<br />
können neben einer großen Zahl von Querdern (46) auch drei Adulte (rechts) gefangen<br />
werden. ....................................................................................................................... 37<br />
104
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 19: Vergleich Goldsteinbeißer (Sabanejewia balcanica, oben) mit Steinbeißer (Cobitis sp.);<br />
beide stammen aus dem Sulzabach (Zubringer der Grenzmur). Roter Pfeil: zweiter<br />
Fleck. .......................................................................................................................... 41<br />
Abb. 20: Goldsteinbeißer aus der Aschach ................................................................................ 42<br />
Abb. 21: Verbreitung von Goldsteinbeißern in Österreich. Rot: Funde 2008. Grün: Stand 2007.<br />
Blau: Böhmische Masse. ............................................................................................ 44<br />
Abb. 22: Goldsteinbeißer-Nachweise in Oberösterreich ............................................................ 44<br />
Abb. 23: Sandbank, auf der die höchste Dichte an Goldsteinbeißern gefunden wurde (rechts<br />
unten) ......................................................................................................................... 45<br />
Abb. 24: Vergleich des von Goldsteinbeißern besiedelten Sohlsubstrates in der Aschach (links)<br />
und im Gamlitzbach in der Südsteiermark (rechts). ..................................................... 46<br />
Abb. 25: Goldsteinbeißer aus Aschach (oben), Kamp (Mitte) und Gamlitzbach (unten). ............ 47<br />
Abb. 26: Größenstruktur von Goldsteinbeißern aus der Aschach (oben) im Vergleich mit<br />
Grabenlandbächen und Gamlitzbach (Mitte; ZAUNER & RATSCHAN, 2004; ZAUNER et al.,<br />
2009) sowie der Lafnitz (WOLFRAM et al. 2008.) .......................................................... 48<br />
Abb. 27: Die Sohlrampe in Karling (links) als Beispiel für ein energiewirtschaftlich nicht<br />
genutztes, unpassierbares Querbauwerk, das einen für Goldsteinbeißer und rheophile<br />
Fischarten kaum besiedelbaren, etwa einen Kilometer langen Stau bildet (rechts). .... 50<br />
Abb. 28: Steinbeißer aus dem Machland (oben) und aus der Enknach (unten). ........................ 51<br />
Abb. 29 Steinbeißer-Nachweise in Oberösterreich ................................................................... 55<br />
Abb. 30: Steinbeißer-Nachweise in Österreich, Stand 2007; Daten aktualisiert aus: ZAUNER &<br />
RATSCHAN, 2005. ........................................................................................................ 55<br />
Abb. 31 Längen-Frequenz-Diagramm der Steinbeißerpopulationen aus dem Machland und der<br />
Enknach ..................................................................................................................... 56<br />
Abb. 32 Sympatrisches Auftreten mit Steinbeißern. Blau … rheophil; grau ... oligorheophil; grün<br />
... indifferent; rot ... limnophil ....................................................................................... 57<br />
Abb. 33: Fundstelle im überwachsenen Bereich des Kleinen Naarnkanals vor der Mündung des<br />
Tobrabachs (links) und auf verbliebenen Schlammbänken (links unten) im<br />
Mündungsbereich zur Naarn (rechts). Die Felder grenzen unmittelbar an den Bachlauf.<br />
................................................................................................................................... 58<br />
Abb. 34: Anbindung des Gießen-Systems (links) an die Enknach (rechts) bei Dietzing. ............ 59<br />
Abb. 35: Strukturfreier Unterlauf der Naarn (links) und feinsedimentbelastete Bereiche in der<br />
Schwemmnaarn (rechts). ............................................................................................ 61<br />
Abb. 36: Kleiner Naarnkanal kurz nach einer Bachbetträumung. ............................................... 62<br />
Abb. 37: Geschlechtsdimorphismus beim Schlammpeitzger: oben Männchen (TL 185 mm) mit<br />
größerer Brustflosse, verdicktem 2. Flossenstrahl und rötlichem Wulst im<br />
Schwanzbereich; unten Weibchen (TL 195 mm) mit kleinerer Brustflosse. ................. 64<br />
Abb. 38 Rezente Fundorte des Schlammpeitzgers und neue Fundorte (zum Großteil im<br />
Rahmen des Kleinfischprojekts) .................................................................................. 67<br />
Abb. 39: Längen-Frequenz-Diagramm der gefangenen Schlammpeitzger ................................. 68<br />
Abb. 40: Grabensystem zwischen Eitzendorf und Saxen im Machland. ..................................... 69<br />
Abb. 41: Rückzugsbereiche des Schlammpeitzgers in den Gräben des Eferdinger Beckens:<br />
künstlich angelegte Eintiefungen für Amphibien. ......................................................... 70<br />
105
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 42: Sympatrisches Auftreten mit Schlammpeitzgern. Blau ... rheophil; grau ... oligorheophil;<br />
grün ... indifferent; rot ... limnophil ............................................................................... 71<br />
Abb. 43: Verlandende Eintiefungen in den Grabensystemen des Eferdinger Beckens fallen im<br />
Sommer oft über längere Zeit trocken. ........................................................................ 72<br />
Abb. 44: Diese Gewässer mit Revitalisierungspotential könnten in Zukunft als Lebensraum für<br />
den Schlammpeitzger dienen. ..................................................................................... 76<br />
Abb. 45: Karausche, Jungtier mit dunklem Fleck an der Schwanzwurzel. .................................. 77<br />
Abb. 46: Nachweise von Karauschen in Oberösterreich und benachbarte Bundesländern ........ 78<br />
Abb. 47: Größenstruktur der gefangenen Karauschen, getrennt nach Zielgebieten. .................. 79<br />
Abb. 48: Mit Karauschen vergesellschaftete Arten. Blau ... rheophile; grau ... oligorheophile; grün<br />
... indifferente; rot ... limnophile ................................................................................... 80<br />
Abb. 49: Links oben: Karausche mit typischem Habitus; rechts oben: Mit Karauschen assoziierte<br />
Fischarten (obere Fotos: Lohjörgl-Altarm, Salzachauen). Links unten: Karauschen mit<br />
variierenden äußeren Merkmalen; rechts unten: verlandendes Augewässer mit<br />
Karauschen und Blaubbandbärblingen (untere Fotos: Machland). .............................. 81<br />
Abb. 50: Links: Als Hybride von Karauschen und Giebeln gedeuteter Bestand in den<br />
Salzachauen; Rechts: Individuum mit äußerlichen Carassius-Merkmalen, aber dunklem<br />
Peritoneum ................................................................................................................. 82<br />
Abb. 51: Bitterling-Pärchen vor der Eiablage. Erkennbar ist die Legeröhre des Weibchens und<br />
die ausgeprägte Laichfärbung des Männchens mit Laichausschlag auf der<br />
Schnauzenspitze ........................................................................................................ 83<br />
Abb. 52: Nachweise von Bitterlingen in Oberösterreich und benachbarten Bundesländern ....... 85<br />
Abb. 53: Unterschiedliche von Bitterlingen besiedelte Gewässertypen: Fließgewässer Aschach<br />
unterhalb (links unten) und oberhalb Durchbruch (linksoben), Altarm in den Innauen<br />
(links unten) und Ausrinn des Seeleithensees (rechts unten). ..................................... 86<br />
Abb. 54: Größenstruktur der gefangenen Bitterlinge, getrennt nach Untersuchungsgebieten. ... 87<br />
Abb. 55: Mit Bitterlingen vergesellschaftete Arten. Blau ... rheophile; grau ... oligorheophile; grün<br />
... indifferente; rot ... limnophile ................................................................................... 87<br />
Abb. 56: Moderlieschen, weibliches Tier mit kurzer Legeröhre am After. ................................... 89<br />
Abb. 57: Nachweise von Moderlieschen in Oberösterreich und benachbarten Bundesländern .. 90<br />
Abb. 1: Abb. 58: Größenstruktur der Moderlieschen im Eisenhuter Bach in zwei verschiedenen<br />
Jahren (siehe Text). .................................................................................................... 91<br />
Abb. 59: Der Eisenhuter Bach - ein untypischer Lebensraum für das Moderlieschen ................ 91<br />
Abb. 60: Kleinfisch-Webseite auf der Homepage www.blattfisch.at mit download-Möglichkeit der<br />
Bestimmungshilfe und elektronischen Abgabe von Fundmeldungen......................... 108<br />
Abb. 61: Formular für die elektronische Abgabe von Fundmeldungen auf der Homepage<br />
www.blattfisch.at ....................................................................................................... 109<br />
Abb. 62: Kurzinformation über das Kleinfischprojekt, die in Papierform und elektronisch (pd-file)<br />
verteilt wurden. ......................................................................................................... 110<br />
Abb. 64: Beiträge in Österreichs Fischerei 61 (5/6): 112 – 114 und Oberösterreichs Fischerei 36<br />
(1): 4 – 5 (rechts unten) zusammen mit dem Bestimmungsblatt (siehe Abb. 63). ...... 112<br />
Abb. 65: Beitrag in Natur und Land 94 (1/2), 50-51. ................................................................ 113<br />
Abb. 66: Beitrag in Informativ 49 (März), 8-9. .......................................................................... 114<br />
106
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 67: <strong>Bericht</strong> in den Oberösterreichischen Nachrichten vom 06.August 2008 ..................... 115<br />
Abb. 68: <strong>Bericht</strong> in den Oberösterreichischen Nachrichten vom 10.November 2008 ............... 116<br />
Tabellen<br />
Tab. 1: Ausgewählte Zielarten, Gefährdungskategorie, Nennung in Anhang II der FFH-<br />
Richtlinie und bisherige, rezente Fundorte in Oberösterreich. ..................................... 10<br />
Tab. 2: Zielgebiete, Zeitaufwand für Befischungen und realisierte Befischungsstellen der<br />
einzelnen Bearbeiter ................................................................................................... 11<br />
Tab. 4: Biometrische und morphologische Merkmale von Neunaugenfunden in Oberösterreich<br />
– Querder und Adulte getrennt. .................................................................................. 32<br />
Tab. 5: Größenangaben (Totallänge) nicht parasitischer, europäischer Neunaugen in der<br />
Literatur . .................................................................................................................... 32<br />
107
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
9 ANHANG<br />
Abb. 60: Kleinfisch-Webseite auf der Homepage www.blattfisch.at mit download-Möglichkeit der Bestimmungshilfe<br />
und elektronischen Abgabe von Fundmeldungen<br />
108
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 61: Formular für die elektronische Abgabe von Fundmeldungen auf der Homepage www.blattfisch.at<br />
109
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 62: Kurzinformation über das Kleinfischprojekt, die in Papierform und elektronisch (pd-file) verteilt wurden.<br />
110
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 63: Bestimmungsblatt für das Kleinfischprojekt; in Papierform und elektronisch (pdf-file) verteilt; Anhang im<br />
Beitrag in Oberösterreichs Fischerei.<br />
111
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 64: Beiträge in Österreichs Fischerei 61 (5/6): 112 – 114 und Oberösterreichs Fischerei 36 (1): 4 – 5 (rechts<br />
unten) zusammen mit dem Bestimmungsblatt (siehe Abb. 63).<br />
112
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 65: Beitrag in Natur und Land 94 (1/2), 50-51.<br />
113
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 66: Beitrag in Informativ 49 (März), 8-9.<br />
114
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 67: <strong>Bericht</strong> in den Oberösterreichischen Nachrichten vom 06.August 2008<br />
115
Artenschutzprojekt Kleinfische – Modul 1 Anhang<br />
Abb. 68: <strong>Bericht</strong> in den Oberösterreichischen Nachrichten vom 10.November 2008<br />
116