Immundefekt – - Hauner Journal
Immundefekt – - Hauner Journal
Immundefekt – - Hauner Journal
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Dr. von Hau nersches Kinderspita l<br />
<strong>Immundefekt</strong> <strong>–</strong><br />
Allergie oder Autoimmunität?<br />
Trockene, rote, juckende Haut in Kombination mit erhöhten Serum-IgE Spiegeln muss nicht immer<br />
eine allergische Erkrankung sein, wenngleich dies die häufigste Ursache ist. Differentialdiagnostische<br />
Ursachen außerhalb des atopischen Formenkreises sind insbesondere dann zu bedenken, wenn<br />
rezidivierende Infektionen oder Infektionskomplikationen zum klinischen Bild hinzukommen. Neben<br />
parasitären oder auch tumorösen Erkrankungen, wie z. B. der Langerhanszellhistiozytose, kommen<br />
eine Reihe von angeborenen Störungen des Immunsystems <strong>–</strong> sogenannte Primäre <strong>Immundefekt</strong>e <strong>–</strong><br />
differentialdiagnostisch in Betracht.<br />
Kinderklinik und<br />
Kinderpoliklinik im Dr. von<br />
<strong>Hauner</strong>schen Kinderspital,<br />
Ludwig Maximilians<br />
Universität, München;<br />
* Klinik und Poliklinik für<br />
Dermatologie und Allergologie,<br />
Ludwig Maximilians<br />
Universität, München;<br />
** Children’s Hospital and<br />
University of Washington,<br />
Seattle, WA (USA)<br />
Korrespondenzadresse:<br />
Priv.-Doz. Dr. med.<br />
Ellen D. Renner<br />
Kinderklinik und<br />
Kinderpoliklinik im<br />
Dr. von <strong>Hauner</strong>schen<br />
Kinderspital,<br />
Ludwig Maximilians<br />
Universität,<br />
Lindwurmstr. 4,<br />
80337 München<br />
E-Mail: Ellen.Renner@med.<br />
uni-muenchen.de<br />
Trockene, rote, juckende Haut ist nicht immer nur ein Ekzem<br />
Lyn J. Kohl, Lena F. Schimke, Gundula Notheis, Julie Sawalle-Belohradsky, Annette Jansson, Florian Hoffmann,<br />
Anita Rack, Beate Hagl, Theresia Kusuma, Anne Langenbeck, Nikolaus Rieber, Silvia Stojanov, Anna-Lisa Lanz,<br />
Andreas Wollenberg*, Hans D. Ochs**, Bernd H. Belohradsky, Michael Albert, Ellen D. Renner<br />
WAS IST EIN PRIMÄRER<br />
IMMUNDEFEKT ?<br />
Primäre <strong>Immundefekt</strong>e sind seltene Erbkrankheiten<br />
des Immunsystems, welche häufig durch<br />
monogenetische Defekte verursacht sind. Diese<br />
Mutationen in der Erbanlage können durch einen<br />
Zellbildungsdefekt und/oder Differenzierungsdefekt<br />
zu einer immunologischen Funktionsstörung<br />
mit einer angeborenen Abwehrschwäche<br />
gegenüber einem schmalen Erregerspektrum bis<br />
zum Gesamtspektrum an Krankheitserregern<br />
führen.[1, 2] Wiederholte, langandauernde, therapieresistente<br />
oder schwer verlaufende Infektionen,<br />
sowie Infektionen mit atypischen Erregern<br />
sind verdächtig. Primäre <strong>Immundefekt</strong>e sind<br />
abzugrenzen von Infektionen aufgrund von organischen<br />
Fehlbildungen (= meist monotope Infektionen)<br />
oder sekundären Infektionen im Rahmen<br />
chronischer Viruserkrankungen, immunsupressiver<br />
Therapie oder durch Eiweißverlust.<br />
PRIMÄRE IMMUNDEFEKTE MIT<br />
EKzEM<br />
Leitsymptome von Erkrankungen des atopischen<br />
Formenkreises sind erhöhtes Serum-IgE<br />
und chronisches Ekzem. Aber auch bei einer<br />
ganzen Reihe von Primären <strong>Immundefekt</strong>en<br />
treten erhöhte Serum-IgE Spiegel und ein chronisches<br />
Ekzem auf. Hierzu gehören unter anderen<br />
das Omenn Syndrom, das Wiskott-Aldrich<br />
Syndrom, das IPEX (= Immune Dysregulation,<br />
Polyendocrinopathy, Enteropathy, X-linked)<strong>–</strong><br />
Syndrom, das Comèl-Netherton Syndrom und<br />
die Hyper-IgE Syndrome (HIES). Für diese Primären<br />
<strong>Immundefekt</strong>e gibt es mittlerweile eine<br />
Assoziation mit einem oder mehreren Gendefekten<br />
(siehe Tabelle).<br />
HyPER-IGE SyNDRoME (HIES)<br />
Die Unterscheidung einer schweren atopischen<br />
Dermatitis von HIES ist klinisch eine Herausforderung.<br />
Da viele Symptome des HIES erst mit<br />
zunehmendem Alter hinzutreten oder erkennbar<br />
sind, bereitete die Abgrenzung eines HIES<br />
gegenüber einer schweren Neurodermitis vor der<br />
Möglichkeit der molekulargenetischen Diagnostik<br />
große Schwierigkeiten.<br />
HIES sind gekennzeichnet durch die klinische<br />
Trias (1) Ekzem mit erhöhtem Serum-IgE<br />
(>2000 IU/ml bzw. 2SD über der altersentsprechenden<br />
Norm) (2) rezidivierende Staphylokokken-Abszesse<br />
der Haut (Abb. 1a) und (3) Pneumonien<br />
mit Pneumatozelenbildung (Abb. 1b).<br />
[3-5]<br />
Das klassische autosomal dominante Hyper-<br />
IgE Syndrom (AD-HIES) ist assoziiert mit nicht<br />
immunologischen Symptomen wie verzögerter<br />
Milchzahnwechsel, Skoliose, Überstreckbarkeit<br />
der Gelenke und charakteristischen Gesichtszügen.[5]<br />
HIES-Patienten mit einem autosomal<br />
rezessiven Erbgang (AR-HIES) haben im Gegen-
Primäre <strong>Immundefekt</strong><br />
Syndrome<br />
Hyper-IgE Syndrome<br />
(HIES)<br />
Erbgang:<br />
IPEX<br />
autosomal dominant<br />
autosomal rezessiv<br />
autosomal rezessiv<br />
Wiskott-Aldrich Syndrom<br />
(WAS)<br />
Comèl-Netherton Syndrom<br />
Omenn Syndrom<br />
DiGeorge Syndrom<br />
Symptome Gendefekt Immunologische Marker<br />
Staphylokokken-Abszesse<br />
Pneumonien<br />
Pneumatozelenbildung<br />
Assoziierte Skelett- und<br />
Bindegewebsveränderungen<br />
Virale Infektionen,<br />
Atypische Mykobakteriose<br />
Virale Infektionen<br />
ZNS-Beteiligung<br />
Chronische Diarrhö<br />
Endokrinopathie<br />
Ekzem,<br />
bakterielle, virale und<br />
opportunistische Infektionen<br />
wie Pneumocystis jeroveci<br />
Thrombozytopenie/-pathie<br />
Ichthyosis<br />
Bambus-Haar<br />
Atopie<br />
Rezidivierende Infektionen<br />
insbesondere mit<br />
Staphylococcus aureus<br />
Schwere virale, mykotische<br />
und bakterielle Infektionen<br />
Herzfehler<br />
Faciale Dysplasien<br />
Thymushypoplasie<br />
Hypoparathyreoidismus<br />
satz zum klassischen HIES keine Krankheitszeichen<br />
an Skelett und Bindegewebe, jedoch zusätzlich<br />
schwere, chronisch rezidivierende Mollusca<br />
contagiosa, Herpes simplex und Varicella Zoster<br />
Infektionen, sowie eine ZNS-Beteiligung mit<br />
Hämorrhagien und Lähmungserscheinungen.<br />
2006 gelang der Nachweis einer homozygoten<br />
Tyk2 (tyrosine kinase 2) Mutation bei einem<br />
Patienten mit einer AR-HIES Variante.[6]<br />
Diese Tyk2-Mutation führte zur Fokusierung<br />
auf JAK-STAT-Signalwege als Ursache für AD-<br />
HIES und damit zur Identifikation von heterozygoten<br />
STAT3-Mutationen beim autosomal<br />
dominaten HIES.[7-9] In der 2004 beschriebenen<br />
AR-HIES Variante[10] gelang kein Nachweis von<br />
Tyk2- oder STAT3-Mutationen.[9, 11]<br />
Ende 2009 wurden Mutationen im Gen, das<br />
für das 'dedicator of cytokinesis 8' (DOCK8) Protein<br />
kodiert, bei Patienten mit hohem Serum-IgE,<br />
rezidivierenden Virusinfektionen, T Zelldefekt<br />
und autosomal rezessivem Erbgang beschrieben.[12]<br />
Mittlerweile ist bekannt, dass einige<br />
Patienten mit der 2004 beschriebenen AR-HIES<br />
Variante Mutationen in DOCK8 tragen.([13]<br />
(und eigene unpublizierte Daten).<br />
STAT3<br />
Tyk2<br />
DOCK8<br />
FOXP3<br />
WAS<br />
SPINK5<br />
RAG 1 und 2,<br />
ARTEMIS,<br />
IL-7Rα,<br />
RMRP, ADA<br />
und weitere<br />
22q11-<br />
Deletionen<br />
TBX1<br />
Dr. von Hau nersches Kinderspita l<br />
Kombinierter <strong>Immundefekt</strong><br />
TH17-Zellbildungsstörung<br />
T-Zelldefekt<br />
Kombinierter <strong>Immundefekt</strong><br />
T-regulatorische (Treg)-<br />
Zellbildungsstörung<br />
Kombinierter <strong>Immundefekt</strong><br />
Defekt der spezifischen<br />
Antikörperbildung auf<br />
Polysaccharide und phiX174-<br />
Bakteriophage<br />
Natürliche Killerzellen Dysfunktion<br />
Schwerer kombinierter <strong>Immundefekt</strong><br />
Oligoklonale T-Zellen und<br />
reduzierte B-Zellen<br />
T-Zellreduktion<br />
Variabler T-Zelldefekt<br />
Eine frühe Diagnose ist beim STAT3-HIES<br />
essentiell um lebensbedrohliche Infektionskomplikationen,<br />
insbesondere der Lunge wie Pneumatozelenbildung<br />
nach Pneumonie oder Lungenabszess<br />
zu vermeiden und so die Prognose der<br />
Patienten zu verbessern.<br />
Symptomatische Therapien wie frühzeitige<br />
auch venöse Anitbiotikatherapie, eine Staphylokokken-wirksameAntibiotikadauerprophylaxe,<br />
eine antimykotische Behandlung und chirurgische<br />
Abszessspaltung stehen im Vordergrund.<br />
Entfernungen von Pneumatozelen der<br />
Lunge sollten sehr zurückhaltend und nur nach<br />
aussichtsloser konservativer Therapie erfolgen.<br />
Pneumatozelen können sich auch im späteren<br />
Verlauf noch spontan zurückbilden.<br />
Bei guter Lungenfunktion und antibiotischer/antimykotischer<br />
Behandlung haben<br />
STAT3-HIES-Patienten eine annähernd normale<br />
Lebenserwartung.<br />
Im Gegensatz dazu sind die klinischen<br />
Verläufe der AR-HIES Patienten mit DOCK8-<br />
Mutationen durch den kombinierten <strong>Immundefekt</strong><br />
und die ZNS-Beteiligung mit einem möglichen<br />
fulminanten Verlauf gekennzeichnet. Die<br />
Ausgewählte Primäre<br />
<strong>Immundefekt</strong>e mit<br />
Ekzem und erhöhtem<br />
Serum-IgE
Dr. von Hau nersches Kinderspita l<br />
2<br />
IPEX Syndrom<br />
Patient mit chronisch<br />
ekzematöser Dermatitis<br />
Dankenswerterweise<br />
zur Verfügung gestellt<br />
von Prof. Notarangelo,<br />
boston (USA)<br />
5<br />
omenn Syndrom<br />
Patient mit<br />
Erythrodermie,<br />
Ekzem,<br />
Lymphadenopathie,<br />
Alopezie,<br />
Dystrophie<br />
Schwere der Erkrankung und Limitierung auf<br />
das immunologische System haben zu ersten<br />
erfolgreichen Stammzelltransplantationen bei<br />
DOCK8-HIES Patienten geführt (unpublizierte<br />
Daten).<br />
1 a, b<br />
Hyper-IgE-Syndrom<br />
a) Patient mit Ekzem und<br />
rezidivierenden Abzessen<br />
b) Röntgen Thorax mit<br />
Pneumatozellen<br />
IPEX-SyNDRoM<br />
3 a, b<br />
Wiskott-Aldrich<br />
Syndrom<br />
a) juckendes<br />
Ekzem am ganzen<br />
Integument<br />
b) selber Patient<br />
nach erfolgreicher<br />
Stammzelltransplantation<br />
4 a, b, c<br />
Comèl-Netherton<br />
Syndrom<br />
a) Patient mit<br />
ichthyosiformer<br />
Erythrodermie<br />
b) nach<br />
Immunglobulintherapie<br />
c) bambushaar<br />
6<br />
DiGeorge Syndrom<br />
Junge mit<br />
tiefsitzenden, nach<br />
hinten rotierten ohren,<br />
offen stehender<br />
‘Fischmund’,<br />
schmales Rot der<br />
oberlippe,<br />
verstrichenem<br />
Philtrum, breiter<br />
Nasenwurzel<br />
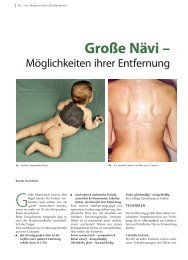
Das IPEX-Syndrom (= Immune Dysregulation,<br />
Polyendocrinopathy, Enteropathy, X-linked)<br />
zeichnet sich durch ab dem Säuglingsalter auf-
tretende, schwere, nicht-infektiöse Enteropathie,<br />
autoimmune Endokrinopathien, chronische<br />
ekzematöse Dermatitis (Abb. 2) und rezidivierende<br />
Infektionen aus.[14] Dieser X-chromosomal<br />
vererbte <strong>Immundefekt</strong> wird durch Mutationen<br />
im FOXP3 Gen verursacht. FOXP3 spielt<br />
die entscheidende Rolle bei der Produktion von<br />
regulatorischen T-Zellen (Treg). Meist finden<br />
sich normale bis erhöhte Immunglobulinspiegel.<br />
Bereits in der Neonatalperiode kann es zu<br />
schweren Autoimmunphänomenen wie Diabetes<br />
mellitus Typ 1, Thyreoiditis, autoimmun-hämolytischer<br />
Anämie, autoimmuner Thrombozytopenie<br />
und Neutropenie, sowie einer Nephropathie<br />
und autoimmuner Hepatitis kommen, so<br />
dass eine Immunsuppression nötig wird. Primär<br />
und auch sekundär besteht eine erhöhte Anfälligkeit<br />
für unterschiedliche Infektionserreger.[14]<br />
Ohne Stammzelltransplantation ist die Prognose<br />
meist infaust. Nur bei sehr milden Krankheitsverläufen<br />
ist ohne Transplantation ein Überleben<br />
bis zum 30. Lebensjahr beobachtet worden.<br />
WISKoTT-ALDRIcH SyNDRoM<br />
Das Wiskott-Aldrich Syndrom (WAS) ist durch<br />
die klinische Trias von Infektionsanfälligkeit,<br />
Ekzemen und Thrombozytopenie gekennzeichnet.[15,<br />
16] Nicht alle Patienten zeigen die<br />
volle Ausprägung des Krankheitsbildes, Ekzem<br />
(Abb. 3a) und <strong>Immundefekt</strong> können auch fehlen<br />
oder milde ausgeprägt sein. Man spricht dann<br />
von X-chromosomal vererbter Thrombozytopenie<br />
(XLT).[17] Außerdem haben die Patienten ein<br />
erhöhtes Risiko für Autoimmunerkrankungen<br />
und Malignome. Ursächlich sind Mutationen im<br />
X-chromosomal kodierten Gen WAS.<br />
Das Protein WASP kontrolliert das Zytoskelettrearrangement,<br />
bestimmte Signaltransduktionswege<br />
und die Zellmigration hämatopoetischer<br />
Zellen. Patienten weisen einen kombinierten<br />
<strong>Immundefekt</strong> mit Reduktion der peripheren<br />
T-Zellen und deren Funktion, wie auch<br />
eine verminderte NK-Zellfunktion auf. Immunglobulinspiegel<br />
im Serum können sehr variieren,<br />
wobei meist die Fähigkeit zur Produktion von<br />
spezifischen Antikörpern gegen Polysaccharide<br />
eingeschränkt ist und Isohämagglutinine nicht<br />
im Serum nachweisbar sind. Die allogene hämatopoetische<br />
Stammzelltransplantation (Abb. 3b)<br />
gilt als kurative Standardtherapie falls ein HLAkompatibler<br />
Spender zur Verfügung steht. Eine<br />
hämatopoetische Stammzellgentherapie befindet<br />
sich in klinischer Erprobung.[18]<br />
coMèL-NETHERToN SyNDRoM<br />
Das Comèl-Netherton Syndrom ist eine seltene,<br />
autosomal rezessive Erkrankung charakterisiert<br />
durch eine angeborene Ichthyosis, Bambushaar<br />
(Abb. 4), Atopie und rezidivierende Infektionen.<br />
[19-21] Bluteosinophilie und erhöhtes Serum-IgE<br />
Dr. von Hau nersches Kinderspita l<br />
sind nachweisbar. Direkt nach Geburt fallen die<br />
Kinder durch die ichthyosiforme Erythrodermie<br />
auf. Eine Nahrungsmittelunverträglichkeit,<br />
Infektionen und chronische Entzündungsreaktion<br />
der Haut führen in den ersten Lebensjahren<br />
zu einer teils sehr ausgeprägten Gedeihstörung<br />
mit sekundärem Minderwuchs. Insbesondere im<br />
ersten Lebensjahrzehnt kommt es zu schweren<br />
Infektionen sowie septischen Krankheitsbildern,<br />
die zu einer Mortalität von 20% im ersten Lebensjahr<br />
beitragen.[22] Mutationen im Gen SPINK5,<br />
lokalisiert auf Chromosom 5q32, führen zu einer<br />
fehlenden oder reduzierten Expression des Proteaseinhibitor<br />
LEKTI.[20] LEKTI reguliert die<br />
Desquamation und Matrixentwicklung der Haut.<br />
[23] Eine Expression von LEKTI nicht nur in Epithelzellen<br />
der Haut und Mukosa, sondern auch<br />
in den Hassallschen Körperchen des Thymus<br />
lässt vermuten, dass LEKTI entscheidend für die<br />
T-Zellentwicklung ist.[24] Patienten zeigen einen<br />
breit gefächerten <strong>Immundefekt</strong>, der sich durch<br />
eine reduzierte spezifische Antikörperbildung<br />
gegen Pneumokokken-Polysaccharid-Antigen<br />
und dem Neoantigen Bakteriophage phiX174,<br />
einer reduzierten NK-Zellzytotoxizität und verminderter<br />
B-Gedächtniszellzahl im peripheren<br />
Blut kennzeichnet.[21, 25-27]<br />
Im ersten Lebensjahr steht insbesondere die<br />
schwere Gedeihstörung im Vordergrund. Aufgrund<br />
der generalisierten Nahrungsunverträglichkeit<br />
ist für viele Patienten eine teilparenterale<br />
Ernährung über einen zentralen Katheter oder<br />
eine PEG-Sonde unumgänglich. Ein ständiger<br />
antihistaminikaresistenter Juckreiz belastet die<br />
Patienten. Unter Einsatz von Immunglobulinen<br />
konnte bei einigen Patienten ein verbessertes<br />
Gedeihen, eine reduzierte Inflammation der<br />
Haut, sowie eine Abnahme der Infektionsanfälligkeit<br />
aufgezeigt werden.[21] Die Prognose ist<br />
nach Überleben der ersten Lebensjahre meist gut.<br />
Einzelfallberichte beschreiben allerdings maligne<br />
Hautveränderungen bei jungen Erwachsenen<br />
mit Comèl-Netherton Syndrom.[28]<br />
oMENN-SyNDRoM<br />
Beim Omenn-Syndrom handelt es sich um<br />
einen schweren kombinierten <strong>Immundefekt</strong><br />
(SCID), der durch eine generalisierte Schwäche<br />
des Immunsystems frühzeitig zu fulminanten<br />
Infektionen mit Bakterien, Viren und Pilzen<br />
führen kann.[29] Das Omenn-Syndrom <strong>–</strong> auch<br />
Familiäre Retikuloendotheliose oder SCID mit<br />
Eosinophilie genannt <strong>–</strong> beginnt meist im Neugeborenenalter<br />
mit einer generalisierten Erythrodermie<br />
(Abb. 5), Lymphadenopathie und Hepatosplenomegalie.<br />
Unterschiedlichste genetische<br />
SCID-Defekte wie hypomorphe Mutationen in<br />
RAG1/2, Artemis, ADA, IL7Rα und weiteren<br />
Genen können zum Omenn-Syndrom führen.<br />
Hypomorphe Mutationen in diesen Genen führen<br />
zu einer residuellen Aktivität und konse-
Dr. von Hau nersches Kinderspita l<br />
kutiver exzessiver Expansion oligoklonaler T-<br />
und B-Zellen. Ausgeprägte Lymphadenopathie<br />
und Hepatosplenomegalie sind charakteristisch.<br />
Diese T-Zellen induzieren massive Entzündungsreaktionen<br />
die klinisch einer Graft versus Host<br />
Erkrankung ähneln. Im Labor findet sich eine<br />
Lymphozytose mit hoher Zahl an aktivierten<br />
T-Zellen, meist Fehlen von B-Zellen, einer ausgeprägten<br />
Eosinophilie (oft > 1000/µL) und hohe<br />
Serum IgE-Spiegel. Die Therapie besteht in einer<br />
aggressiven immunsuppressiven Behandlung<br />
und zügiger Stammzelltransplantation. Ohne<br />
Transplantation ist die Prognose fatal.<br />
DIGEoRGE-SyNDRoM<br />
(Mikrodeletionssyndrom 22q11)<br />
Das DiGeorge Syndrom (DGS) gehört zu den<br />
Mikrodeletionssyndromen 22q11 einschließlich<br />
des Shprintzen oder Velo-cardio-fazialen Syndroms<br />
(Abb. 6).<br />
Dem DGS liegt eine fehlerhafte embryonale<br />
Entwicklung der 3. und 4. Schlundtasche<br />
zugrunde, die zu den charakteristischen Anomalien<br />
wie Herzfehler, Thymushypoplasie und<br />
Hypoparathyreoidismus führt. Nicht immer liegen<br />
beim DGS Mikrodeletionen im Chromosom<br />
22 vor, auch Punktmutationen im TBX1 Gen<br />
oder noch unbekannte Veränderungen können<br />
ursächlich sein.[30] Die Erstdiagnose des DGS<br />
wird häufig im Rahmen eines prä- oder neonatal<br />
aufgefallenen schweren Herzfehlers gestellt. Der<br />
<strong>Immundefekt</strong> bei Patienten mit DGS kann sehr<br />
variabel ausgeprägt sein: Vom völligen Fehlen<br />
der T-Zellen bis zu normaler T-Zellzahl und<br />
-funktion. Charakteristisch ist die verminderte<br />
Produktion von T-Zellen (v.a. CD3+ und CD4+)<br />
bedingt durch einen Mangel an funktionellem<br />
Thymusgewebe. Daher besteht eine erhöhte<br />
Infektionsanfälligkeit insbesondere für virale-<br />
und Pilzinfektionen. Der T-Zelldefekt ist vor<br />
allem in den ersten Lebensmonaten ausgeprägt<br />
und kann sich bis zum Ende des ersten Lebensjahres<br />
verbessern oder normalisieren.<br />
Neugeborene mit schwerer T-Zelldefizienz<br />
können unter entsprechenden prophylaktischen<br />
Maßnahmen wie z.B. Pneumocystis jiroveci Prophylaxe,<br />
Bestrahlung von Blutprodukten etc. für<br />
eine bestimmte Zeit beobachtet werden, um zu<br />
sehen, ob sich der <strong>Immundefekt</strong> im Verlauf verbessert.<br />
Sekundäre Funktionseinschränkungen<br />
der B Zellen sind möglich.<br />
Bei Persistenz eines schweren <strong>Immundefekt</strong>s<br />
muss eine Stammzell- oder Thymustransplantation<br />
angestrebt werden.[31, 32] Ältere Patienten<br />
mit DGS haben ein erhöhtes Risiko für Autoimmunerkrankungen.[33]<br />
DIAGNoSTIScHES VoRGEHEN<br />
Wiederholte, zeitlich oder durch die Schwere<br />
der Verläufe auffallende Infektionen, die nicht<br />
auf einer organischen Fehlbildung oder sekundär<br />
begründet sind, stehen bei Patienten mit<br />
Primärem <strong>Immundefekt</strong> im Vordergrund. Die<br />
Infektionsanfälligkeit kann im ersten Lebensjahr<br />
mild (z. B. Ekzem und dann erste Abszesse<br />
beim HIES), aber auch sehr schwer (z. B. fulminante<br />
Infektionen bei Omenn-Syndromen)<br />
ausgeprägt sein. Infektionsanfälligkeit oder protrahierte<br />
Infektionsverläufe sind immer obligate<br />
Symptome, um an einen PID zu denken. Für die<br />
Diagnosestellung ist eine ausführliche Anamnese<br />
bedeutend. Diese sollte die Erstellung eines<br />
Stammbaums mit der Frage nach Infektionsanfälligkeit,<br />
Fehlgeburten/Aborten/unklaren<br />
Todesfällen und Konsanguinität in der Familie<br />
enthalten. Klinische Untersuchungsbefunde wie<br />
Bambushaar (Netherton-Syndrom), Doppelreihenbildung<br />
der Milchzähne (STAT3-HIES), tiefsitzende<br />
Ohren (DiGeorge Syndrom) oder seit<br />
Geburt bestehende schwere chronische Durchfälle<br />
(IPEX-Syndrom) können neben der Infektionsanfälligkeit<br />
Leitsymptome für den zugrunde<br />
liegenden <strong>Immundefekt</strong> sein. Die Basisdiagnostik<br />
besteht in der Bestimmung des Blutbilds mit<br />
Differentialblutbild, Serum-Immunglobulinen<br />
und der Untersuchung der spezifischen Antikörperbildung<br />
auf Routineimpfungen wie auf<br />
Diphtherie, Tetanus, Haemophilus influenzae B<br />
und Pneumokokken-Polysaccharid Antigenen.<br />
Bei numerischen oder qualitativen pathologischen<br />
Befunden sollten weitere gezielte Untersuchungen<br />
wie z. B. die Bestimmung der Lymphozyten-<br />
und Granulozytenfunktion, B- und<br />
T-Lymphozyten Subpopulationen in einem<br />
Zentrum für Primäre <strong>Immundefekt</strong>e erfolgen.<br />
Diese und weitere Untersuchungen werden von<br />
unserem immunologischen Diagnostiklabor<br />
angeboten im Rahmen einer Vorstellung in der<br />
<strong>Immundefekt</strong>ambulanz des Hauses (Terminvereinbarung<br />
unter 089-5160-3931) oder durch<br />
direkte Einsendung von Untersuchungsmaterial<br />
nach telefonischer Anmeldung unter der Telefonnummer<br />
089-5160-2831. Bei dringendem<br />
klinischem und immunologischem Verdacht auf<br />
einen Primären <strong>Immundefekt</strong> sollte außerdem<br />
frühzeitig versucht werden, die Diagnose molekulargenetisch<br />
zu sichern.<br />
Hierbei gilt zu beachten, dass molekulargenetische<br />
Untersuchungen nur nach schriftlicher<br />
Einwilligung des Patienten/Erziehungsberechtigten<br />
nach den neuen Richtlinien des Gendiagnostikgesetz<br />
vom 1.2.2010 durchgeführt werden<br />
dürfen. Auch dieses Formular kann bei uns<br />
unter 089-5160-2831 angefordert werden.<br />
THERAPIEMÖGLIcHKEITEN<br />
Je nach Diagnose muss eine symptomatische<br />
Therapie mittels frühzeitiger Antibiotikatherapie<br />
(häufig auch intravenös nötig), antibiotischer<br />
und antimykotischer Dauerprophylaxe und/
Lite ratur<br />
oder Immunglobulinsubstitution durchgeführt<br />
werden. Eine kurative Stammzelltransplantation<br />
oder eine Gentherapie können lebensrettend sein.<br />
In den letzten Jahren hat sich die Erfolgsquote<br />
von Stammzelltransplantationen bei Patienten<br />
mit Primärem <strong>Immundefekt</strong> deutlich verbessert,<br />
so dass diese Therapie einer größeren Zahl von<br />
Patienten angeboten werden kann.<br />
Zwischen 2004 und 2009 sind im Dr. von<br />
<strong>Hauner</strong>schen Kinderspital 27 Kinder mit Primärem<br />
<strong>Immundefekt</strong> transplantiert worden.<br />
Allgemein gilt, dass eine frühzeitige Diagnosestellung<br />
für die Prognose des Patienten essentiell<br />
ist und durch frühzeitige Therapie Patienten<br />
vor Infektionskomplikationen geschützt werden<br />
können und sich so Überlebenschancen und<br />
Lebensqualität entscheidend verbessern.<br />
DANKSAGUNG<br />
Dr. von Hau nersches Kinderspita l<br />
Die Teamarbeit im diagnostischen und therapeutischen,<br />
sowie im klinischen und wissenschaftlichen<br />
Bereich wird von vielen Mitarbeitern<br />
verschiedenster Abteilungen erbracht. Genannt<br />
seinen, ohne Anspruch auf Vollständigkeit, die<br />
medizinisch technischen Assistentinnen Frau<br />
Bieberle, Dönhoff, Eckerlein, Eisl, Hofmann,<br />
Laniado, die <strong>Immundefekt</strong>ambulanzschwestern<br />
Frau Schlieben, Strotmann und Wichert, überweisende<br />
Ärzte und Kooperationspartner und<br />
Drittmittelgeber wie die Fritz-Thyssen-Stiftung,<br />
Kindness for Kids, FöFoLe der LMU, so wie nicht<br />
zu vergessen unsere Patienten und Frau Gründl,<br />
Vorsitzende der DSAI e.V. (Deutsche Selbsthilfe<br />
angeborene <strong>Immundefekt</strong>e).<br />
[1] Ochs HD, Smith, C.I.E., Puck, J.M. Primary Immunodeficiency Diseases - A Molucular And Genetic Approach. 2nd ed. New York, NY: Oxford University Press 2007.<br />
[2] Stiehm ER, Ochs H.D., Winkelstein, J.A. Immunologic Disorders in Infants&Childrens. Philadelphia, Pennsylvania: Elsevier Saunders 2004.<br />
[3] Buckley RH, Wray BB, Belmaker EZ. Extreme hyperimmunoglobulinemia E and undue susceptibility to infection. Pediatrics. 1972 Jan;49(1):59-70.<br />
[4] Belohradsky BH, Daumling S, Kiess W, Griscelli C. [The hyper-IgE-syndrome (Buckley- or Job-syndrome)]. Ergeb Inn Med Kinderheilkd. 1987;55:1-39.<br />
[5] Grimbacher B, Holland SM, Gallin JI, Greenberg F, Hill SC, Malech HL, et al. Hyper-IgE syndrome with recurrent infections--an autosomal dominant multisystem<br />
disorder. N Engl J Med. 1999 Mar 4;340(9):692-702.<br />
[6] Minegishi Y, Saito M, Morio T, Watanabe K, Agematsu K, Tsuchiya S, et al. Human tyrosine kinase 2 deficiency reveals its requisite roles in multiple cytokine signals<br />
involved in innate and acquired immunity. Immunity. 2006 Nov;25(5):745-55.<br />
[7] Minegishi Y, Saito M, Tsuchiya S, Tsuge I, Takada H, Hara T, et al. Dominant-negative mutations in the DNA-binding domain of STAT3 cause hyper-IgE syndrome.<br />
Nature. 2007 Aug 5.<br />
[8] Renner ED, Torgerson TR, Rylaarsdam S, Anover-Sombke S, Golob K, LaFlam T, et al. STAT3 mutation in the original patient with Job's syndrome. N Engl J Med.<br />
2007 Oct 18;357(16):1667-8.<br />
[9] Holland SM, DeLeo FR, Elloumi HZ, Hsu AP, Uzel G, Brodsky N, et al. STAT3 mutations in the hyper-IgE syndrome. N Engl J Med. 2007 Oct 18;357(16):1608-19.<br />
[10] Renner ED, Puck JM, Holland SM, Schmitt M, Weiss M, Frosch M, et al. Autosomal recessive hyperimmunoglobulin E syndrome: a distinct disease entity. J Pediatr.<br />
2004 Jan;144(1):93-9.<br />
[11] Woellner C, Schaffer AA, Puck JM, Renner ED, Knebel C, Holland SM, et al. The hyper IgE syndrome and mutations in TYK2. Immunity. 2007 May;26(5):535;<br />
author reply 6.<br />
[12] Zhang Q, Davis JC, Lamborn IT, Freeman AF, Jing H, Favreau AJ, et al. Combined immunodeficiency associated with DOCK8 mutations. N Engl J Med. 2009 Nov<br />
19;361(21):2046-55.<br />
[13] Engelhardt KR, McGhee S, Winkler S, Sassi A, Woellner C, Lopez-Herrera G, et al. Large deletions and point mutations involving the dedicator of cytokinesis 8 (DOCK8)<br />
in the autosomal-recessive form of hyper-IgE syndrome. The <strong>Journal</strong> of allergy and clinical immunology. 2009 Dec;124(6):1289-302 e4.<br />
[14] Gambineri E, Torgerson TR, Ochs HD. Immune dysregulation, polyendocrinopathy, enteropathy, and X-linked inheritance (IPEX), a syndrome of systemic autoimmunity<br />
caused by mutations of FOXP3, a critical regulator of T-cell homeostasis. Curr Opin Rheumatol. 2003 Jul;15(4):430-5.<br />
[15] Wiskott A. Familiärer, angeborener Morbus Werlhofii? Montasschr Kinderheilkd. 1937; 68:p. 212-6.<br />
[16] Thrasher AJ. WASp in immune-system organization and function. Nature reviews. 2002 Sep;2(9):635-46.<br />
[17] Albert MH, Bittner TC, Nonoyama S, Notarangelo LD, Burns S, Imai K, et al. X-linked thrombocytopenia (XLT) due to WAS mutations: clinical characteristics,<br />
long-term outcome, and treatment options. Blood. 2010 Apr 22;115(16):3231-8.<br />
[18] Boztug K, Dewey RA, Klein C. Development of hematopoietic stem cell gene therapy for Wiskott-Aldrich syndrome. Current opinion in molecular therapeutics.<br />
2006 Oct;8(5):390-5.<br />
[19] Wilkinson RD, Curtis GH, Hawk WA. Netherton's Disease; Trichorrhexis Invaginata (Bamboo Hair), Congenital Ichthyosiform Erythroderma and the Atopic Diathesis.<br />
A Histopathologic Study. Arch Dermatol. 1964 Jan;89:46-54.<br />
[20] Chavanas S, Bodemer C, Rochat A, Hamel-Teillac D, Ali M, Irvine AD, et al. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome.<br />
Nat Genet. 2000 Jun;25(2):141-2.<br />
[21] Renner ED, Hartl D, Rylaarsdam S, Young ML, Monaco-Shawver L, Kleiner G, et al. Comel-Netherton syndrome defined as primary immunodeficiency. The <strong>Journal</strong> of<br />
allergy and clinical immunology. 2009 Sep;124(3):536-43.<br />
[22] Jones SK, Thomason LM, Surbrugg SK, Weston WL. Neonatal hypernatraemia in two siblings with Netherton's syndrome. Br J Dermatol. 1986 Jun;114(6):741-3.<br />
[23] Jayakumar A, Kang Y, Henderson Y, Mitsudo K, Liu X, Briggs K, et al. Consequences of C-terminal domains and N-terminal signal peptide deletions on LEKTI secretion,<br />
stability, and subcellular distribution. Arch Biochem Biophys. 2005 Mar 1;435(1):89-102.<br />
[24] Magert HJ, Kreutzmann P, Standker L, Walden M, Drogemuller K, Forssmann WG. LEKTI: a multidomain serine proteinase inhibitor with pathophysiological<br />
relevance. Int J Biochem Cell Biol. 2002 Jun;34(6):573-6.<br />
[25] Greene SL, Muller SA. Netherton's syndrome. Report of a case and review of the literature. J Am Acad Dermatol. 1985 Aug;13(2 Pt 2):329-37.<br />
[26] Judge MR, Morgan G, Harper JI. A clinical and immunological study of Netherton's syndrome. Br J Dermatol. 1994 Nov;131(5):615-21.<br />
[27] Van Gysel D, Koning H, Baert MR, Savelkoul HF, Neijens HJ, Oranje AP. Clinico-immunological heterogeneity in Comel-Netherton syndrome. Dermatology.<br />
2001;202(2):99-107.<br />
[28] Katugampola RP, Finlay AY, Harper JI, Dojcinov S, Maughan TS. Primary cutaneous CD30+ T-cell lymphoproliferative disorder following cardiac transplantation in a<br />
15-year-old boy with Netherton's syndrome. Br J Dermatol. 2005 Nov;153(5):1041-6.<br />
[29] Villa A, Sobacchi C, Notarangelo LD, Bozzi F, Abinun M, Abrahamsen TG, et al. V(D)J recombination defects in lymphocytes due to RAG mutations: severe<br />
immunodeficiency with a spectrum of clinical presentations. Blood. 2001 Jan 1;97(1):81-8.<br />
[30] Yagi H, Furutani Y, Hamada H, Sasaki T, Asakawa S, Minoshima S, et al. Role of TBX1 in human del22q11.2 syndrome. Lancet. 2003 Oct 25;362(9393):1366-73.<br />
[31] Markert ML, Devlin BH, Chinn IK, McCarthy EA. Thymus transplantation in complete DiGeorge anomaly. Immunologic research. 2009;44(1-3):61-70.<br />
[32] Land MH, Garcia-Lloret MI, Borzy MS, Rao PN, Aziz N, McGhee SA, et al. Long-term results of bone marrow transplantation in complete DiGeorge syndrome.<br />
The <strong>Journal</strong> of allergy and clinical immunology. 2007 Oct;120(4):908-15.<br />
[33] McLean-Tooke A, Spickett GP, Gennery AR. Immunodeficiency and autoimmunity in 22q11.2 deletion syndrome. Scandinavian journal of immunology. 2007 Jul;66(1):1-7.