Hvad fr en normal celle til at dele sig - Liv.dk
Hvad fr en normal celle til at dele sig - Liv.dk
Hvad fr en normal celle til at dele sig - Liv.dk
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
IndholdsfortegnelseIndholdsfortegnelse s. 2Indledning s. 3<strong>Hvad</strong> får <strong>en</strong> <strong>normal</strong> <strong>celle</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> s. 4-vækst<strong>sig</strong>nalerCelledeling s. 4-vækstfaktorer-PDGF-PDGF’s receptorer-Hvordan kræft<strong>celle</strong>r sæter <strong>sig</strong> ud over <strong>sig</strong>nalfaktorerne-<strong>celle</strong>kern<strong>en</strong>-”Brems<strong>en</strong>”-TGF-β-Eksempler på mut<strong>at</strong>ioner i TGF-β-<strong>sig</strong>nalkæd<strong>en</strong>Kræft <strong>en</strong> <strong>celle</strong>cyklussygdom s. 8-G 1 og restriktionspunktet (point of no return)-S, G 2 og M-Checkpoints-Restriktionspunktet-Bomm<strong>en</strong> (Rb) løftes af (cyklin D/CDK4)-Bomm<strong>en</strong> (Rb) holdes nede af (p15 og p16)-p53 – Dna’ets vogter-Kræft<strong>celle</strong>rne-Cyklin D bomm<strong>en</strong> løftes-p16 ing<strong>en</strong> <strong>til</strong> <strong>at</strong> holde bomm<strong>en</strong> nede-Rb (bomm<strong>en</strong> mangler)-Kræft <strong>en</strong> <strong>celle</strong>cyklus sygdomHvordan sætter kræft<strong>celle</strong>r <strong>sig</strong> ud over <strong>celle</strong>rnes kontrol med hinand<strong>en</strong> s. 12-De otte barriererBehandling af kræft, <strong>en</strong> del af de otte barrierer s. 14Kirurgi og kemoterapi s. 15Helbredelse i <strong>fr</strong>emtid<strong>en</strong>, Angiog<strong>en</strong>ese s. 16Ny vid<strong>en</strong> s. 17-HERCEPTIN-GLEEVEC-Bivirkninger ved stofferneSidste bemærkning s. 18Litter<strong>at</strong>urliste s. 192
IndledningKræftforskning<strong>en</strong>s udvikling er eksploderet ind<strong>en</strong> for de sidste 5-10 år. I takt med <strong>at</strong> detm<strong>en</strong>neskelige g<strong>en</strong>om er blevet kortlagt, og g<strong>en</strong>terapi ikke længere er sci<strong>en</strong>sfiction. D<strong>en</strong>ne opgaveskal give et indblik i hvor vi i dag er nået <strong>til</strong> og hvilke behandlingsmuligheder der er.Opgav<strong>en</strong> er lavet ud <strong>fr</strong>a et oplæg <strong>fr</strong>a kræft<strong>en</strong>s bekæmpelse:Problemformulering:Hvordan styres cell<strong>en</strong>s udvikling, og kan d<strong>en</strong>ne vid<strong>en</strong> bruges <strong>til</strong> helbredelse af kræftsygdomme?- hvad får <strong>en</strong> <strong>normal</strong> <strong>celle</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong>.?- hvordan bliver besked<strong>en</strong> om <strong>at</strong> <strong>dele</strong> <strong>sig</strong> oms<strong>at</strong> <strong>til</strong> virkelighed?- hvordan sætter kræft<strong>celle</strong>r <strong>sig</strong> udover <strong>celle</strong>rnes kontrol med hinand<strong>en</strong>?- Kræft bliver også kaldt <strong>en</strong> <strong>celle</strong>cyklussygdom. Hvordan mister kræft<strong>celle</strong>r kontroll<strong>en</strong> over cell<strong>en</strong>cyklus?- Kan vid<strong>en</strong> om <strong>normal</strong>e <strong>celle</strong>rs kontrol og kræft<strong>celle</strong>rs mangel på samme bruges <strong>til</strong> <strong>at</strong> lave nyekræftbehandlinger?3
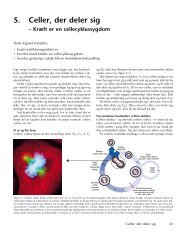
<strong>Hvad</strong> får <strong>en</strong> <strong>normal</strong> <strong>celle</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> ?En <strong>normal</strong> <strong>celle</strong> bestemmer ikke selv om d<strong>en</strong> skal <strong>dele</strong> <strong>sig</strong> eller lade være. Det er <strong>sig</strong>naler <strong>fr</strong>a andre<strong>celle</strong>r, som afleverer et <strong>sig</strong>nal <strong>til</strong> cell<strong>en</strong>s overflade. Disse <strong>sig</strong>naler er vækstfaktorer og antivækstfaktorer.Om cell<strong>en</strong> <strong>dele</strong>r <strong>sig</strong> eller ej afhænger af hvilket <strong>sig</strong>nal der er mest af. Hvilket vil <strong>sig</strong>e<strong>at</strong> cell<strong>en</strong> kun <strong>dele</strong>r <strong>sig</strong>, når der er flest vækstfaktorer. En <strong>normal</strong> <strong>celle</strong> gør kun, hvad d<strong>en</strong> får beskedpå.Vækst<strong>sig</strong>naler:Signalerne kommer <strong>en</strong>t<strong>en</strong> <strong>fr</strong>a nabocell<strong>en</strong> (parakrin <strong>sig</strong>nalering) eller også kommer de <strong>fr</strong>a <strong>en</strong><strong>en</strong>dokrin kirtel via blodban<strong>en</strong>, da <strong>sig</strong>nalerne er produceret et helt andet sted i kropp<strong>en</strong> (<strong>en</strong>dokrin<strong>sig</strong>nalering). På d<strong>en</strong> måde bliver hvert væv opretholdt i d<strong>en</strong> rigtige størrelse og struktur, efterkropp<strong>en</strong>s behov.Nogle <strong>celle</strong>r, især kræft<strong>celle</strong>r, kan både producere og modtage deres egne <strong>sig</strong>naler (autokrin<strong>sig</strong>nalering).Parakrin og autokrin <strong>sig</strong>nalering afgiver et <strong>sig</strong>nalmolekyle (lokalhormoner), som kun kan opf<strong>at</strong>tes i<strong>en</strong> afstand under 1mm. dvs. <strong>sig</strong>nalmolekylerne kun påvirker de nærmeste <strong>celle</strong>r. Lokalhormonernebliver afgivet <strong>til</strong> det ekstracellulære rum og kommer ikke i blodban<strong>en</strong>, m<strong>en</strong>s de <strong>normal</strong>e hormonertransporteres via blodet. Det er i forbindelse med lokalhormonerne problemerne opstår, og derforvil vi beskæftige os med disse. Lokalhormoner er mange forskellige <strong>sig</strong>nalmolekyler, som påvirkerderes mål<strong>celle</strong>r på forskellige måder, de lokalhormoner der får <strong>en</strong> <strong>celle</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> kaldesvæksthormoner.Celledeling<strong>en</strong>Vækstfaktorer:Lokalhormonerne i form af vækstfaktorer, binder <strong>sig</strong> <strong>til</strong> specielle receptorer. Receptorer er etprotein med <strong>en</strong> del ud<strong>en</strong> for cell<strong>en</strong> og <strong>en</strong> indre del i cell<strong>en</strong>s cytoplasma, som går g<strong>en</strong>nem<strong>celle</strong>membran<strong>en</strong> via <strong>en</strong> <strong>sig</strong>nalkæde <strong>til</strong> <strong>celle</strong>kern<strong>en</strong>. Når vækstfaktorer bindes <strong>til</strong> receptorerne,reagerer disse med <strong>sig</strong>nalproteiner, som ig<strong>en</strong> reagerer med nogle proteiner, kaldettranskriptionfaktorer ved <strong>at</strong> aktivere nogle g<strong>en</strong>er. G<strong>en</strong>erne koder for proteiner, som fører cell<strong>en</strong>g<strong>en</strong>nem <strong>celle</strong>deling<strong>en</strong>.4
Et <strong>sig</strong>nal går <strong>fr</strong>a receptor<strong>en</strong> g<strong>en</strong>nem <strong>en</strong> <strong>sig</strong>nalkæde ind <strong>til</strong> <strong>celle</strong>kern<strong>en</strong>. Proteinerne i <strong>sig</strong>nalkæd<strong>en</strong> er istand <strong>til</strong> <strong>at</strong> videregive et <strong>sig</strong>nal <strong>til</strong> et andet protein i kæd<strong>en</strong>, som <strong>en</strong>der ud i <strong>en</strong> transkriptionsfaktor,der aflæser DNA'et.PDGF:PDGF er et eksempel på <strong>en</strong> vækstfaktor (PDGF = Pl<strong>at</strong>elet-Derived Growth Factor).For <strong>at</strong> beskrive <strong>sig</strong>nalkæd<strong>en</strong>s kompon<strong>en</strong>ter har vi tage udgangspunkt i PDGF som vækstfaktor, oghvordan cell<strong>en</strong> <strong>dele</strong>s under PDGF's påvirkning.Normale mål<strong>celle</strong>r producerer ikke PDGF. PDGF produceres i knoglemarv<strong>en</strong>. De <strong>celle</strong>r derproducerer PDGF afgiver dette <strong>til</strong> målcell<strong>en</strong>. PDGF virker ikke som <strong>en</strong>kelt molekyle m<strong>en</strong> danner <strong>en</strong>dimer ved <strong>at</strong> binde <strong>sig</strong> <strong>til</strong> et andet PDGF molekyle. Mange vækstfaktorer fungerer på d<strong>en</strong>ne måde.Dimer<strong>en</strong> binder <strong>sig</strong> ikke <strong>til</strong> én PDGF-receptorer, m<strong>en</strong> to. Dette tvinger PDGF-receptorerne fysisktæt på hinand<strong>en</strong>. Dette giver receptorerne <strong>en</strong> lidt ændret struktur, og det er d<strong>en</strong>ne, der gør demaktive.PDGF's receptorer:Receptor<strong>en</strong> er <strong>en</strong> såkaldt tyrosinkinase-receptor. Kinase betyder, <strong>at</strong> d<strong>en</strong> er i stand <strong>til</strong> <strong>at</strong> sætte <strong>en</strong>fosf<strong>at</strong>gruppe på et andet protein. I dette <strong>til</strong>fælde sættes fosf<strong>at</strong>grupp<strong>en</strong> på aminosyr<strong>en</strong> tyrosin ogderfor, får d<strong>en</strong> navnet tyrosinkinase-receptor. D<strong>en</strong> del af receptor<strong>en</strong>, som befinder <strong>sig</strong> i cell<strong>en</strong>sindre, er der, hvor selve kinaseaktivitet<strong>en</strong> foregår. Når PDGF-vækstfaktor<strong>en</strong> binder <strong>sig</strong> <strong>til</strong>receptor<strong>en</strong>, bliver kinas<strong>en</strong> aktiv. Det er strukturændring<strong>en</strong> af receptor<strong>en</strong>e, der gør, <strong>at</strong> kinas<strong>en</strong> bliveraktiv og i stand <strong>til</strong> <strong>at</strong> sætte <strong>en</strong> fosf<strong>at</strong>gruppe(fosforylere) på d<strong>en</strong> and<strong>en</strong> receptor. Hermed bliverreceptor<strong>en</strong> aktiv, og bl.a. i stand <strong>til</strong>, ved fosforylering, <strong>at</strong> aktivere andre proteiner <strong>en</strong>d <strong>sig</strong> selv.Det, man umiddelbart ville tro, får cell<strong>en</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong>, er altså ikke d<strong>en</strong> aktive receptor, m<strong>en</strong> er istedet (bl.a.) et protein, Grb2, der <strong>normal</strong>t befinder <strong>sig</strong> i cell<strong>en</strong>s cytoplasma. Det bliver <strong>til</strong>trukket affosf<strong>at</strong>grupp<strong>en</strong> på d<strong>en</strong> aktive receptor og binder <strong>sig</strong> <strong>til</strong> d<strong>en</strong>. Grb2 er bundet <strong>til</strong> et andet protein, Sos,da det ikke selv har nog<strong>en</strong> <strong>en</strong>zymaktivitet. Sos har <strong>en</strong>zymaktivitet. Ved receptor<strong>en</strong> kommer Sos itæt kontakt med det tredje protein i rækk<strong>en</strong>, Ras, der sidder på indersid<strong>en</strong> af <strong>celle</strong>membran<strong>en</strong>. Herbliver Ras aktiveret af Sos.Ras er <strong>en</strong>t<strong>en</strong> i <strong>en</strong> aktiv eller <strong>en</strong> inaktiv form. I sin inaktive form binder Ras GDP. For <strong>at</strong> Ras skalblive aktiv, sørger Sos for <strong>at</strong> udskifte GDP-molekylet med et GTP, når vækstreceptor<strong>en</strong> er aktiv.5
GTP-Ras-komplekset har <strong>en</strong> kort levetid, fordi andre proteiner hurtigt sørger for <strong>at</strong> omdanne det <strong>til</strong>d<strong>en</strong> inaktive form, hvor GDP er bundet <strong>til</strong> Ras. Derfor skal vækstfaktor<strong>en</strong> hele tid<strong>en</strong> være bundet <strong>til</strong>vækstreceptor<strong>en</strong>, for <strong>at</strong> Ras skal blive ved med <strong>at</strong> være aktiv. Det aktive Ras-protein sørger for <strong>at</strong>aktivere det fjerde protein i rækk<strong>en</strong>, proteinkinas<strong>en</strong> Raf. D<strong>en</strong>ne aktivering starter nu rigtig mangefosforyleringer, hvor d<strong>en</strong> <strong>en</strong>e proteinkinase (Raf) fosforylerer d<strong>en</strong> and<strong>en</strong> (MEK), som fosforylererd<strong>en</strong> tredje (ERK), der bliver aktiv og herefter bevæger <strong>sig</strong> <strong>fr</strong>a cytoplasmaet ind i <strong>celle</strong>kern<strong>en</strong>, ogfosforylerer og aktiverer ind<strong>til</strong> flere DNA-bind<strong>en</strong>de proteiner(transkriptionsfaktorer), der stimulerertranskription<strong>en</strong>. Transkriptionsfaktorerne sørger for <strong>at</strong> aktivere de g<strong>en</strong>er, der er nødv<strong>en</strong>dige for<strong>celle</strong>deling<strong>en</strong>. De nydannede proteiner overtager derefter og sørger for <strong>at</strong> gøre cell<strong>en</strong> klar <strong>til</strong> selve<strong>celle</strong>deling.Hvordan kræft<strong>celle</strong>r sætter <strong>sig</strong> ud over <strong>sig</strong>nalfaktorerneEn kræft<strong>celle</strong> er i stand <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> uhæmmet(forklares i afsnittet med de 8 barriere). For <strong>at</strong> cell<strong>en</strong>skal kunne <strong>dele</strong> <strong>sig</strong> skal d<strong>en</strong> have et vækst<strong>sig</strong>nal eller simulere et. Her har kræftcell<strong>en</strong> tomuligheder; cell<strong>en</strong> kan <strong>en</strong>t<strong>en</strong> producere et vækst<strong>sig</strong>nal, som d<strong>en</strong> selv er i stand <strong>til</strong> <strong>at</strong> modtage. Hvor<strong>normal</strong>e <strong>celle</strong>r kun kan modtage deres eget vækst<strong>sig</strong>nal ude<strong>fr</strong>a. Dette kan ske via mut<strong>at</strong>ioner i nogleproto-onkog<strong>en</strong>er. eksempler på dette er sarkomer- og bindevævskræft.Eller cell<strong>en</strong> kan "simulere", <strong>at</strong> d<strong>en</strong> modtager et vækst<strong>sig</strong>nal.Dette kan ske ved, <strong>at</strong> to vækstreceptorer kommer for tæt samme, p.g.a. trængsel af vækstreceptorerpå cell<strong>en</strong>s overflade. Hos <strong>en</strong> <strong>normal</strong> <strong>celle</strong> skal der et vækst<strong>sig</strong>nal <strong>til</strong> <strong>at</strong> samle to vækstreceptorer.Epidermal growth factor receptor (EGF-R) er et eksempel på <strong>en</strong> receptore, som cell<strong>en</strong> har formange af ved mave-, hjerne- og brystkræft.For mange receptorer kan også gøre cell<strong>en</strong> over følsom over for vækst<strong>sig</strong>naler, så <strong>en</strong> lille mængdevækst<strong>sig</strong>nal, som <strong>en</strong> <strong>normal</strong> <strong>celle</strong> ikke ville reagere på, bringer cell<strong>en</strong> <strong>til</strong> deling.6
Hvis <strong>en</strong> <strong>celle</strong> er muteret så d<strong>en</strong> ydre del af vækstreceptor<strong>en</strong> (EGF) mangler, får det f<strong>at</strong>alekonsekv<strong>en</strong>ser, fordi to vækstfaktorer ud<strong>en</strong> <strong>en</strong> ydre del spontant får de to muterede receptorer <strong>til</strong>forbinde <strong>sig</strong>, og de vil nu lave et konstant vækst<strong>sig</strong>nal. Dette skyldes <strong>en</strong> mut<strong>at</strong>ion der kaldes <strong>en</strong>delmut<strong>at</strong>ion, d<strong>en</strong>ne går ud på <strong>at</strong> onkog<strong>en</strong>-udgav<strong>en</strong> af EGF-receptor<strong>en</strong> mangler et stort stykke af detDNA, som i proto-onkog<strong>en</strong>-udgav<strong>en</strong> koder for d<strong>en</strong> ydre del af receptor<strong>en</strong>.Cytoplasmaet, muteret Ras-g<strong>en</strong>.Det kan også gå galt inde i cell<strong>en</strong>, et eksempel på dette er Ras-g<strong>en</strong> (proto-onkog<strong>en</strong>) der er muteret,Det muterede Ras-g<strong>en</strong> (onkog<strong>en</strong>), er ændret i sin struktur, så det hele tid<strong>en</strong> videre s<strong>en</strong>der et <strong>sig</strong>nalind i cell<strong>en</strong> om deling (Ras er et af de proteiner, der er med <strong>til</strong> <strong>at</strong> s<strong>en</strong>de vækst<strong>sig</strong>nalet videre indg<strong>en</strong>nem cytoplasmaet.). Disse hyperaktive udgaver af Ras er fundet i omkring <strong>en</strong> fjerdel af allekræft<strong>til</strong>fælde og i forbindelse med tyktarmskræft optræder der et muteret Ras-g<strong>en</strong> hver and<strong>en</strong> gang.Mange forskere m<strong>en</strong>er, <strong>at</strong> p<strong>at</strong>i<strong>en</strong>ter med d<strong>en</strong> samme sygdom har <strong>en</strong> mut<strong>at</strong>ion i et af de andre g<strong>en</strong>er,der koder for et af <strong>sig</strong>nalproteinerne i cytoplasmaet eller <strong>celle</strong>kern<strong>en</strong>.Cellekern<strong>en</strong>.Det kan også gå galt i <strong>celle</strong>kern<strong>en</strong> f.eks. Myc-onkog<strong>en</strong>er der koder for transkriptionsfaktorer, der<strong>normal</strong>t kun dannes på vækst<strong>sig</strong>nalets kommando, m<strong>en</strong> i mange typer af kræft er antallet af Myctranskriptionsfaktorerhele tid<strong>en</strong> højt. Det vil <strong>sig</strong>e, der hele tid<strong>en</strong> bliver produceret proteiner, der fårcell<strong>en</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong>.”Brems<strong>en</strong>”For <strong>at</strong> <strong>en</strong> <strong>celle</strong> skal kunne <strong>dele</strong> <strong>sig</strong>, er det ikke nok d<strong>en</strong> har kontrol over vækstfaktor<strong>en</strong>e ogvækst<strong>sig</strong>nalerne. Der er også antivækstfaktorer, der ligesom vækstfaktor<strong>en</strong>e sætter gang i <strong>en</strong> <strong>sig</strong>nalkæde, bestå<strong>en</strong>de af proteiner, der går <strong>fr</strong>a antivækstreceptorer på cell<strong>en</strong>s overflademembran ig<strong>en</strong>nemcytoplasmaet ind i <strong>celle</strong>kern<strong>en</strong>. Der skal altså ikke kun én mut<strong>at</strong>ion <strong>til</strong> i proto-onkog<strong>en</strong>et. Dette øgercell<strong>en</strong>s forsvar mod kræft, fordi der skal <strong>en</strong>dnu <strong>en</strong> mut<strong>at</strong>ion <strong>til</strong> i et af proteinerne i cell<strong>en</strong>santivækst<strong>sig</strong>nalkæde (tumorsuppressorg<strong>en</strong>erne). Mut<strong>at</strong>ion<strong>en</strong> skal blot ramme <strong>en</strong> aftumorsuppressorg<strong>en</strong>erne, og result<strong>at</strong>et vil blive det samme, <strong>en</strong> brudt antivækst<strong>sig</strong>nalkæde. Ettumorsuppressorg<strong>en</strong> er, som det <strong>fr</strong>emgår af navnet, et g<strong>en</strong>, der undertrykker <strong>en</strong> tumor.TGF-βEt eksempel på <strong>en</strong> tumorsuppressor-<strong>sig</strong>nalkæde er d<strong>en</strong> kæde TGF-β) (transforming growth factor),sætter i gang, når d<strong>en</strong> binder <strong>sig</strong> <strong>til</strong> cell<strong>en</strong>. TGF-β binder <strong>sig</strong> <strong>til</strong> TGF-β-receptor<strong>en</strong> på cell<strong>en</strong>soverflademembran. Her aktiveres receptorerne på samme måde som ved vækstfaktor<strong>en</strong>. TGF-βreceptor<strong>en</strong>er <strong>en</strong> kinase, der, når d<strong>en</strong> er aktiveret af TGF-β ; er i stand <strong>til</strong> <strong>at</strong> sætte fosf<strong>at</strong>grupper på toproteiner, Smad2 og Smad3, som ligger i receptor<strong>en</strong>s umiddelbare nærhed. Dette gør de to7
smadproteiner i stand <strong>til</strong> <strong>at</strong> gå samm<strong>en</strong> med Smad4, og dette proteinkompleks går ind i <strong>celle</strong>kern<strong>en</strong>,hvor det sørger for dannels<strong>en</strong> af p15, som er i stand <strong>til</strong> <strong>at</strong> stoppe cell<strong>en</strong>s deling.Eksempler på mut<strong>at</strong>ioner i TGF-β-<strong>sig</strong>nalkæd<strong>en</strong>:I nogle former for mavekræft er der sket <strong>en</strong> mut<strong>at</strong>ion i tumorsuppressorg<strong>en</strong>et, der koder for TGF-βreceptor<strong>en</strong>.Dette betyder, <strong>at</strong> cell<strong>en</strong> ikke længere reagere på TGF-β <strong>fr</strong>a nabo<strong>celle</strong>rne, og d<strong>en</strong>n<strong>at</strong>urlige bremse forsvinder.Mut<strong>at</strong>ionerne kan også gå udover Smad2 eller Smad4. Fjernes disse to proteiner, stopperantivækst<strong>sig</strong>nalkæd<strong>en</strong>, for ud<strong>en</strong> disse kan <strong>sig</strong>nalet ikke føres ind i <strong>celle</strong>kern<strong>en</strong>, og der ville ikkeforekomme <strong>en</strong> transskription af p15.Hvis der er sket <strong>en</strong> mut<strong>at</strong>ion i slutproduktet p15, når <strong>sig</strong>nalet cell<strong>en</strong>s kerne, m<strong>en</strong> p15 er ikke istand<strong>til</strong> <strong>at</strong> stoppe cell<strong>en</strong>s deling.Kræft <strong>en</strong> <strong>celle</strong>cyklussygdomNår man taler om kræft, taler man om, <strong>at</strong> cell<strong>en</strong> har mistet kontroll<strong>en</strong> over sin cyklus. I cell<strong>en</strong>scyklus er d<strong>en</strong> i stand <strong>til</strong> <strong>at</strong> pause eller helt stoppe deling<strong>en</strong>, m<strong>en</strong> er der sket fejl i de g<strong>en</strong>er, somstyrer cyklus, er der ikke noget, som holder cell<strong>en</strong> <strong>til</strong>bage <strong>fr</strong>a <strong>at</strong> <strong>dele</strong> <strong>sig</strong>, påtrods af f.eks. skader påDNA’et. For <strong>at</strong> forstå kræft, og hvor det er gået galt, må man forstå cell<strong>en</strong>s <strong>normal</strong>e cyklus.CellecyklusCellecyklus kan ses som et ur bestå<strong>en</strong>de af fem trin (G 0 , G 1 , S, G 2 og M). Jo længere rundt i uretman bevæger <strong>sig</strong>, des større bliver d<strong>en</strong> og jo tættere kommer d<strong>en</strong> på <strong>at</strong> <strong>dele</strong> <strong>sig</strong>. Result<strong>at</strong>et bliverdeling <strong>til</strong> to id<strong>en</strong>tiske <strong>celle</strong>r. Cellerne kan her<strong>fr</strong>a begynde for<strong>fr</strong>a med <strong>at</strong> <strong>dele</strong> <strong>sig</strong> eller gå i standbyfunktion (G 0 ). Cellerne begynder kun cyklus, hvis de får besked på det, som g<strong>en</strong>nem gået undervækstfaktorer. For bedre <strong>at</strong> forstå de forskellige trin kommer <strong>en</strong> g<strong>en</strong>nemgang af dem.8
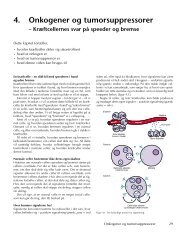
G 1 og restriktionspunktet (point of no return)Gap 1 betyder hul, da man først ikke troede cell<strong>en</strong> foretog <strong>sig</strong> noget her. M<strong>en</strong> i virkelighed<strong>en</strong> skerder <strong>en</strong> masse i d<strong>en</strong>ne fase. Cell<strong>en</strong> bliver større og forbereder på <strong>at</strong> <strong>dele</strong> <strong>sig</strong>. S<strong>en</strong>t i G 1 fas<strong>en</strong> er ogsåR (restriktionspunktet) også kaldet point ”of no return”, fordi cell<strong>en</strong> efter dette punkt ikke længerereagerer på hverk<strong>en</strong> antivækstfaktorer eller vækstfaktorer, og det er disse der op <strong>til</strong> R bestemmer omcell<strong>en</strong> skal <strong>dele</strong> <strong>sig</strong>. Ved et overtal af vækstfaktorer <strong>dele</strong>r cell<strong>en</strong> <strong>sig</strong> og ved overtal af vækstfaktorergår deling<strong>en</strong> i stå. I mange former for kræft eksistere restriktionspunktet ikke og <strong>celle</strong>deling<strong>en</strong> kanikke stoppes i G 1 .Hvis cell<strong>en</strong> stoppes i G 1, vil d<strong>en</strong> gå over i G 0 fas<strong>en</strong>, hvor d<strong>en</strong> <strong>en</strong>t<strong>en</strong> bliver perman<strong>en</strong>t eller kun <strong>til</strong>d<strong>en</strong> får <strong>en</strong> and<strong>en</strong> besked, dvs. d<strong>en</strong> v<strong>en</strong>ter på vækst<strong>sig</strong>nal, før d<strong>en</strong> begynder <strong>at</strong> <strong>dele</strong> <strong>sig</strong> ig<strong>en</strong>.S, G 2 og MEfter restriktionspunktet, vil cell<strong>en</strong> fortsætte ind i S-fas<strong>en</strong>, (syntes<strong>en</strong>) hvor DNA’et bliver kopiret. IG 2 -fas<strong>en</strong> forbereder cell<strong>en</strong> <strong>sig</strong> på d<strong>en</strong> <strong>en</strong>delige deling. I M-fas<strong>en</strong> (mitose) <strong>dele</strong>r cell<strong>en</strong> <strong>sig</strong> i to <strong>celle</strong>rmed lige mange kromosomer. De to nye <strong>celle</strong>r er født ind i G 1 -fas<strong>en</strong>, og det er nu mængd<strong>en</strong> af antiogvækst<strong>sig</strong>naler der er afgør<strong>en</strong>de for om disse to <strong>celle</strong>r går ind i G 0 -fas<strong>en</strong> eller videre i G 1 -fas<strong>en</strong>.CheckpointsI cykluss<strong>en</strong> er der nogle checkpoints, der, udover restriktionspunktet, kan stoppe deling<strong>en</strong>. Dissecheckpoints hiver ikke cell<strong>en</strong> ud af cykluss<strong>en</strong>, m<strong>en</strong> giver d<strong>en</strong> <strong>en</strong> chance for <strong>at</strong> reparere evt. skadetDNA, ind<strong>en</strong> deling<strong>en</strong> fortsætter. Hvis skad<strong>en</strong> ikke kan laves, søger checkpointet for, <strong>at</strong> cell<strong>en</strong> begårselvmord (apoptose).Hvis <strong>en</strong> <strong>celle</strong> mister disse checkpoints, stopper d<strong>en</strong> ikke op og reparerer eller begår selvmord hvisder er skader på DNA’et og hvis disse skader er sket på et særligt g<strong>en</strong> (proto-onkog<strong>en</strong> ellertumorsupressor) kan dette være begyndels<strong>en</strong> <strong>til</strong> kræft.RestriktionspunktetSom nævnt vil det have k<strong>at</strong>astrofale følger, hvis restriktionspunktet ikke virker. Det viser <strong>sig</strong>, <strong>at</strong> imange former for kræft er restriktionspunktet s<strong>at</strong> ud af spil. Cell<strong>en</strong> kan miste kontroll<strong>en</strong> påforskellige måder m<strong>en</strong> når restriktionspunktet fungerer optimalt er det som <strong>en</strong> bom, der stoppercell<strong>en</strong> på sin g<strong>en</strong>nem <strong>celle</strong>cykluss<strong>en</strong>. Så ville bomm<strong>en</strong> være retinablastom-proteinet (Rb). Rb søgerfor, <strong>at</strong> de proteiner, der skal drive cell<strong>en</strong> g<strong>en</strong>nem sin deling, ikke bliver dannet. Dette gør Rbproteinetved <strong>at</strong> binde <strong>sig</strong> <strong>til</strong> transkriptionsfaktor<strong>en</strong> E2F, hvor Rb virker som repressor E2Ftranskriptionsfaktor<strong>en</strong>i sin aktive form søger for, <strong>at</strong> proteinerne, der skal kopiere DNA, bliverdannet. Det var bomm<strong>en</strong>, der kan stoppe cell<strong>en</strong> i restriktionspunktet, m<strong>en</strong> d<strong>en</strong> skal kunne hæves ogholdes nede.9
Bomm<strong>en</strong> (Rb) løftes af (cyklin D/CDK4)Når cell<strong>en</strong> modtager vækstfaktorer produceres der cyklin D, som ellers ikke <strong>normal</strong>t findes i cell<strong>en</strong>.Cell<strong>en</strong> skal under hele process<strong>en</strong> <strong>til</strong> restriktionspunktet er overskredet modtage vækstfaktorer, ellervil cyklin D proteinerne ikke blive produceret, og dem der er vil hurtigt forsvinde for cyklin Dproteinet er meget ustabilt.D<strong>en</strong> producerede cyklin D samarbejder med CDK 4 (cyklin Dep<strong>en</strong>d<strong>en</strong>t kinase 4), der hele tid<strong>en</strong> er<strong>til</strong>stede i cell<strong>en</strong>. CDK 4 kan sætte fosf<strong>at</strong>grupper på andre proteiner, når cyklin er <strong>til</strong>stede.Cyklin D/CDK4 kan nu hæve bomm<strong>en</strong> ved <strong>at</strong> blive ved med <strong>at</strong> sætte fosf<strong>at</strong>grupper på Rb,(bomm<strong>en</strong>) der <strong>til</strong> sidst må give slip på E2F-transkriptionsfaktor<strong>en</strong>, som bliver aktivt og begynder <strong>at</strong>transkriptere de vækstproteiner, der skal føre cell<strong>en</strong> g<strong>en</strong>nem de sidste tre faser. Så er cell<strong>en</strong> nuselvforsyn<strong>en</strong>de med vækstproteiner, og har s<strong>at</strong> <strong>sig</strong> udover behovet for vækstfaktorer.Bomm<strong>en</strong> (Rb) holdes nede af (p15 og p16)Til <strong>at</strong> holde bomm<strong>en</strong> nede er tumorsuppressorerne p15 (som dannes på kommando <strong>fr</strong>aantivækst<strong>sig</strong>nalers kommando) og p16. Disse to proteiner kan forhindre cyklin D i <strong>at</strong> binde <strong>sig</strong> <strong>til</strong>CDK 4, ved selv <strong>at</strong> binde <strong>sig</strong> <strong>til</strong> CDK 4, så cyklin D ikke kan komme <strong>til</strong> og på d<strong>en</strong> måde inaktivereCDK 4. Om bomm<strong>en</strong> skal løftes bestemmes i <strong>celle</strong>kern<strong>en</strong>. Hvis der er overvægt af vækstfaktorer,vil der være overvægt af cyklin D, og cell<strong>en</strong> fortsætter i cyklus <strong>til</strong> S-fas<strong>en</strong>. Med overvægt afantivækstfaktorer, vil der være overvægt af p15 og cell<strong>en</strong> vil blive i G 1 -fas<strong>en</strong>.p53-Dna’ets vogterCell<strong>en</strong> har flere muligheder for <strong>at</strong> stoppe i <strong>celle</strong>cyklus <strong>en</strong>d i restriktionspunktet. Der er indlagt tocheckpoints hvor evt. DNA-fejl bliver fundet og rettet, eller cell<strong>en</strong> bliver tvunget <strong>til</strong> selvmord.Problemet er, <strong>at</strong> <strong>celle</strong>r med DNA skader ikke <strong>en</strong>t<strong>en</strong> bliver repareret eller begår selvmord. Grund<strong>en</strong><strong>til</strong> d<strong>en</strong>ne fejl kan muligvis findes hos p53, der er d<strong>en</strong> mest uds<strong>at</strong>te tumorsuppressor. p53 kaldes ogsåDNA’ets vogter, fordi p53 spiller <strong>en</strong> c<strong>en</strong>tral rolle i <strong>celle</strong>cykluss<strong>en</strong>s checkpoints. p53-proteinet søgerfor <strong>at</strong> <strong>celle</strong>r med DNA-skader <strong>en</strong>t<strong>en</strong> bliver repareret eller begår selvmord. I de <strong>til</strong>fælde hvor p53 erdefekt vil <strong>en</strong> <strong>celle</strong> med <strong>en</strong> g<strong>en</strong>fejl kunne blive ved med <strong>at</strong> <strong>dele</strong> <strong>sig</strong>. Hvis fejl<strong>en</strong> er sket i etkræft<strong>fr</strong>emkald<strong>en</strong>de proto-onkog<strong>en</strong> f.eks. cyklin D, kan dette være begyndels<strong>en</strong> <strong>til</strong> kræft. M<strong>en</strong>muterer g<strong>en</strong>et der, koder for p53, vil cell<strong>en</strong> ikke blive stoppet i checkpoint`ne, og deling<strong>en</strong> kan skepå trods af skadet DNA. Da det også er p53's opgave <strong>at</strong> få cell<strong>en</strong> <strong>til</strong> <strong>at</strong> begå selvmord i <strong>til</strong>fælde afDNA-skader udelukkes mulighed<strong>en</strong> for selvmord også hvis p53 muterer.10
Kræft<strong>celle</strong>rneI <strong>en</strong> kræft<strong>celle</strong> er det ofte gået galt i restriktionspunktet.Når dette er sket, vil kræft<strong>celle</strong>rne med d<strong>en</strong> fejl blive ved med <strong>at</strong> <strong>dele</strong> <strong>sig</strong>, fordi de ikke længere erafhængige af <strong>sig</strong>naler ude<strong>fr</strong>a. Dette, kombineret med <strong>en</strong> mut<strong>at</strong>ion i p53, vil cell<strong>en</strong> kunne <strong>dele</strong> <strong>sig</strong>uhæmmet på trods af skader.Der er flere muligheder for fejl i restriktionspunktet, dog alle med d<strong>en</strong> fællesfaktor <strong>at</strong> Rb (bomm<strong>en</strong>)holdes lukket.Cyklin D bomm<strong>en</strong> løftes.Ved brystkræft, produceres meget store mængder cyklin D, selvom cell<strong>en</strong> ikke har modtagetvækstfaktorer. Dette er sket ved cyklin D-g<strong>en</strong>et (proto-onkog<strong>en</strong>et)har fået <strong>en</strong> mut<strong>at</strong>ion, der gørcell<strong>en</strong> ude af stand <strong>til</strong> <strong>at</strong> undertrykke dannels<strong>en</strong> af cyklin D-proteinet. Dette betyder, cell<strong>en</strong> vilbegynde <strong>at</strong> <strong>dele</strong> <strong>sig</strong>, som beskrevet under bomm<strong>en</strong> løftes, hvor Cyklin D og CDK 4 går samm<strong>en</strong>, oghæver bomm<strong>en</strong> (inaktiverer Rb), og cell<strong>en</strong> vil <strong>dele</strong> <strong>sig</strong> ukontrolleret.p16 ing<strong>en</strong> <strong>til</strong> <strong>at</strong> holde bomm<strong>en</strong> nede.I de fleste <strong>til</strong>fælde af modermærkekræft (melanom), mangle p16-proteinet <strong>til</strong> <strong>at</strong> holde bomm<strong>en</strong>nede. Her mangler p16 proteinet som modvægt <strong>til</strong> Cyklin D, og der er ikke noget <strong>til</strong> <strong>at</strong> modvejevækstfaktor<strong>en</strong>.Rb (bomm<strong>en</strong> mangler)Proteinet Rb (tumorsuppressor-g<strong>en</strong>) som p16 og cyklid/CDK 4 <strong>en</strong>t<strong>en</strong> aktiverer eller inaktiverer kanogså mangle, og derfor vil der ikke være noget, der stopper cell<strong>en</strong> i sin deling g<strong>en</strong>nem G 1 . D<strong>en</strong>neform for mut<strong>at</strong>ion forekommer i flere kræftformer: blære-, nethinde-, lunge-, og livmoderhalskræft.11
Kræft <strong>en</strong> <strong>celle</strong>cyklus sygdomDet viser <strong>sig</strong> <strong>at</strong> lige meget hvilk<strong>en</strong> kræftform, der er tale om, er fælles for dem alle, <strong>at</strong> de har mistetkontroll<strong>en</strong> over <strong>celle</strong>cyklus. I mange <strong>til</strong>fælde gør et af de tre ov<strong>en</strong>stå<strong>en</strong>de eksempler <strong>sig</strong> gæld<strong>en</strong>de,og især problemet med p53, da netop d<strong>en</strong> mistede kontrol med <strong>celle</strong>cyklus er <strong>en</strong> del af <strong>en</strong>kræft<strong>celle</strong>s ”liv” er forskerne <strong>en</strong>ige om <strong>at</strong> kræft kan kaldes <strong>en</strong> <strong>celle</strong>cyklussygdom Det skal dogbemærkes <strong>at</strong> kræft ikke kun sker i forbindelse med <strong>celle</strong>cyklus, cell<strong>en</strong> skal ”bestige” alle ottebarrirer, hvoraf dette blot er <strong>dele</strong> af de fire første.Hvordan sætter kræft<strong>celle</strong>r <strong>sig</strong> ud over <strong>celle</strong>rnes kontrol medhinand<strong>en</strong>Der er <strong>en</strong> del forskelle på almindelige, raske <strong>celle</strong>r og kræft<strong>celle</strong>r. Disse forskelle kommer på grundaf mut<strong>at</strong>ioner.Alle <strong>celle</strong>r bliver hele tid<strong>en</strong> uds<strong>at</strong> for mindre mut<strong>at</strong>ioner, der dog ikke har d<strong>en</strong> store betydning forcell<strong>en</strong> og d<strong>en</strong>s eg<strong>en</strong>skaber- raske <strong>celle</strong>r bliver ikke <strong>til</strong> kræft<strong>celle</strong>r bare fordi, der sker <strong>en</strong> eller tomut<strong>at</strong>ioner, cell<strong>en</strong> skal derimod overtræde otte barrierer. Dette er nemmere sagt <strong>en</strong>d gjort. Cell<strong>en</strong>har flere forsvarsmekanismer, der sikrer <strong>at</strong> det kun er sjæld<strong>en</strong>t, <strong>at</strong> d<strong>en</strong> muterede <strong>celle</strong> udvikler <strong>sig</strong> <strong>til</strong><strong>en</strong> kræft<strong>celle</strong>. Det vil altså <strong>sig</strong>e, <strong>at</strong> cell<strong>en</strong> skal g<strong>en</strong>nemgå mange mut<strong>at</strong>ioner før d<strong>en</strong> bliver <strong>til</strong> <strong>en</strong>fuldmod<strong>en</strong> kræft<strong>celle</strong>.De otte barrierer:Det er ikke alle m<strong>en</strong>nesker, der får kræft, og nogle m<strong>en</strong>nesker er mere uds<strong>at</strong>te <strong>en</strong>d andre. Man kanselv øge risiko<strong>en</strong> for <strong>at</strong> få kræft ved eksempelvis <strong>at</strong> solbade, spise usundt (fedme) og ryge. Samtidigkan man være g<strong>en</strong>etisk disponeret for <strong>at</strong> udvikle visse kræfttyper.12
Hvis <strong>en</strong> mut<strong>at</strong>ion rammer et repar<strong>at</strong>ionsg<strong>en</strong>, ødelægger det cell<strong>en</strong>s evne <strong>til</strong> <strong>at</strong> reparere DNA-skad<strong>en</strong>.Dette kan få f<strong>at</strong>ale følger, og vi har nu <strong>en</strong> spir<strong>en</strong>de kræft<strong>celle</strong> (1. mut<strong>at</strong>ion).Dette betyder dog ikke, <strong>at</strong> cell<strong>en</strong>s andre evner er ændrede. Cell<strong>en</strong> kan stadig <strong>dele</strong> <strong>sig</strong>, begå selvmordmm.M<strong>en</strong> hvis <strong>en</strong> ny mut<strong>at</strong>ion rammer et proto-onkog<strong>en</strong> (kræftg<strong>en</strong>) bliver cell<strong>en</strong> i stand <strong>til</strong> <strong>at</strong> danne siteget vækst<strong>sig</strong>nal. På d<strong>en</strong> måde er cell<strong>en</strong> delvist i stand <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> ukontrolleret. (2. mut<strong>at</strong>ion)Før cell<strong>en</strong> får evn<strong>en</strong> <strong>til</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> helt ukontrolleret skal der ske <strong>en</strong>dnu <strong>en</strong> mut<strong>at</strong>ion. D<strong>en</strong>ne skalramme tumorsuppressor-g<strong>en</strong>et, da vækst<strong>sig</strong>nalet ellers vil blive bremset af særlige proteiner(tumorsuppressorer) (3. mut<strong>at</strong>ion)For <strong>at</strong> undgå <strong>at</strong> cell<strong>en</strong> begår selvmord (apoptose) skal <strong>en</strong> ny mut<strong>at</strong>ion ramme overlevelses- ellerdøds-g<strong>en</strong>et. Dette g<strong>en</strong> forsager <strong>normal</strong>t, <strong>at</strong> cell<strong>en</strong> opf<strong>at</strong>ter mut<strong>at</strong>ionerne som skader og får derforcell<strong>en</strong> <strong>til</strong> <strong>at</strong> begå selvmord. (4. mut<strong>at</strong>ion)Når d<strong>en</strong>ne barriere er brudt er det nu muligt for cell<strong>en</strong> <strong>at</strong> <strong>dele</strong> <strong>sig</strong> uhæmmet og overleve.M<strong>en</strong> de spir<strong>en</strong>de kræft<strong>celle</strong>r kan stadig ikke ”snyde” immunforsvaret. Det er ikke kun overlevelsesellerdøds-g<strong>en</strong>et, der opf<strong>at</strong>ter d<strong>en</strong> muterede <strong>celle</strong> som et <strong>fr</strong>emmedlegeme og derved noget farligt.Immunforsvaret vil også prøve <strong>at</strong> dræbe cell<strong>en</strong>.D<strong>en</strong> spir<strong>en</strong>de kræft<strong>celle</strong> bliver opdaget af immunforsvarets T-<strong>celle</strong>r. Hvis der i d<strong>en</strong> spir<strong>en</strong>dekræft<strong>celle</strong> opstår <strong>en</strong> mut<strong>at</strong>ion, der gør <strong>at</strong> d<strong>en</strong> kan gemme <strong>sig</strong> for T-<strong>celle</strong>rne, er d<strong>en</strong> spir<strong>en</strong>dekræft<strong>celle</strong> blevet resist<strong>en</strong>t overfor immunforsvaret. (5. mut<strong>at</strong>ion)For <strong>at</strong> kræftcell<strong>en</strong> kan optage næring, skal d<strong>en</strong> dog kunne sørge for, <strong>at</strong> der bliver dannet blo<strong>dk</strong>ar, desåkaldte angiog<strong>en</strong>eser, ellers vil d<strong>en</strong> dø af mangel på næringsstoffer, da disse bliver ført rundt medblodet. (6. mut<strong>at</strong>ion)Hvis kræftcell<strong>en</strong>s vækst ikke skal begrænses, skal <strong>en</strong> mut<strong>at</strong>ion opstå i telomerase-g<strong>en</strong>et. En sådanmut<strong>at</strong>ion vil medføre, <strong>at</strong> cell<strong>en</strong> ikke slider på kromosomernes <strong>en</strong>der (telomere).Normalt vil <strong>celle</strong>delingerne slide på telomererne, hvilket i d<strong>en</strong> sidste <strong>en</strong>de medfører, <strong>at</strong> <strong>celle</strong>rne dør.(7. mut<strong>at</strong>ion)En kræft<strong>celle</strong> er nu dannet, m<strong>en</strong> befinder <strong>sig</strong> stadig i d<strong>en</strong> primære svulst. Dette vil <strong>sig</strong>e, <strong>at</strong> d<strong>en</strong> ikkekan brede <strong>sig</strong> <strong>til</strong> andre <strong>dele</strong> af kropp<strong>en</strong>. Dette bliver først muligt, når kræftcell<strong>en</strong> har g<strong>en</strong>nemgåetflere mut<strong>at</strong>ioner. Med disse kan kræftcell<strong>en</strong> nu sprede <strong>sig</strong> <strong>til</strong> andre <strong>dele</strong> af kropp<strong>en</strong> og blive det, vik<strong>en</strong>der som d<strong>en</strong> eg<strong>en</strong>tlige kræftform. (8. mut<strong>at</strong>ion).13
Behandling af kræft, <strong>en</strong> del af de otte barriererNutid<strong>en</strong>s behandlingsmetoder er bygget på d<strong>at</strong>id<strong>en</strong>s vid<strong>en</strong>, m<strong>en</strong> da der ind<strong>en</strong> for de s<strong>en</strong>este år, ersket så meget ind<strong>en</strong> for kræftforskning<strong>en</strong>, kan disse virker gammeldags og ikke helt så effektive,som de kunne være. Dette bud på nutid<strong>en</strong>s behandlingsmetoder, er umiddelbart rigtig nok, m<strong>en</strong>desværre afspejler det ikke helt virkelighed<strong>en</strong>. Vi <strong>sig</strong>er desværre, da det ellers ville virke muligt <strong>at</strong>finde <strong>en</strong> ny metode <strong>at</strong> behandle kræft på, som ville kunne klare det hele ud<strong>en</strong> bivirkninger. Ivirkelighed<strong>en</strong> hænger det dog sådan samm<strong>en</strong>, <strong>at</strong> <strong>en</strong> ny behandlingsmetode mod kræft, højstsandsynligvis, vil komme <strong>til</strong> <strong>at</strong> indgå i behandling<strong>en</strong>, som et supplem<strong>en</strong>t <strong>til</strong> d<strong>en</strong> traditionellebehandling.Som beskrevet tidligere, skal d<strong>en</strong> spir<strong>en</strong>de kræft<strong>celle</strong> g<strong>en</strong>nemgå otte mut<strong>at</strong>ioner, før d<strong>en</strong> bliver <strong>til</strong><strong>en</strong> fuldmod<strong>en</strong> kræft<strong>celle</strong>. Dette er bare <strong>en</strong> del af, hvad d<strong>en</strong> nyere forskning har vist os, og det erderfor åb<strong>en</strong>lyst <strong>at</strong> lede efter <strong>en</strong> metode <strong>at</strong> bekæmpe kræft<strong>en</strong> på, netop her. Man må formode <strong>at</strong> det ermuligt <strong>at</strong> finde et våb<strong>en</strong> mod kræft, hvis man kan finde <strong>en</strong> måde <strong>at</strong> ophæve bare et af debarriererbrud, som det er lykkedes kræftcell<strong>en</strong> <strong>at</strong> bryde. Det vil <strong>sig</strong>e, <strong>at</strong> det er vigtigt <strong>at</strong> læggekræfterne ind<strong>en</strong> for kræftforskning<strong>en</strong> sættes ind netop her.En person der har gjort dette er Jesper Nylandsted Lars<strong>en</strong>. Han har b<strong>en</strong>yttet <strong>en</strong> teknik manallerede k<strong>en</strong>dte, <strong>til</strong> <strong>at</strong> bryde <strong>en</strong> af de barrierer kræftcell<strong>en</strong> allerede har brudt, med det result<strong>at</strong> <strong>at</strong>kræftcell<strong>en</strong> dør. Ved hjælp af antis<strong>en</strong>se-hæmning, metode <strong>til</strong> forhindring af dannels<strong>en</strong> af specifikkeproteiner i <strong>celle</strong>r, er det lykkedes ham <strong>at</strong> hæmme dannels<strong>en</strong> af Hsp70-proteinet, og dermed har handræbt kræft<strong>celle</strong>r, der eg<strong>en</strong>tlig havde passeret det såkaldte ”point of no return”.På d<strong>en</strong> praktiske side, er det lykkedes Jesper <strong>at</strong> inføre et stykke <strong>fr</strong>emmed DNA-sekv<strong>en</strong>s ikræft<strong>celle</strong>rne, ved hjælp af <strong>en</strong> almindelig forkølelsesvirus. Dette stykke DNA-stykke, er de<strong>sig</strong>net,så det koder for et stykke RNA, som kan sætte <strong>sig</strong> fast på d<strong>en</strong> mRNA-sekv<strong>en</strong>s, som koder forHsp70-proteinet. Hvis det lykkedes for RNA-sekv<strong>en</strong>s<strong>en</strong>, <strong>at</strong> sætte <strong>sig</strong> på mRNA’et, ved hjælp afbeseparringsregl<strong>en</strong>, vil det ikke længere være muligt for ribosomerne, <strong>at</strong> transl<strong>at</strong>ere mRNA’et <strong>til</strong> detprotein, det eg<strong>en</strong>tlig koder for, hvilket i dette <strong>til</strong>fælde er Hsp70-proteinet. Result<strong>at</strong>et af dette rel<strong>at</strong>ivtsimple indgreb, er på det nærmeste mere lov<strong>en</strong>de <strong>en</strong>d forv<strong>en</strong>tningerne, da kræft<strong>celle</strong>rne decideretdør af behandling<strong>en</strong>, og ikke bare er mere modtagelig over for allerede eksister<strong>en</strong>debehandlingsmetoder, eksempelvis kemoterapi.D<strong>en</strong>ne behandlingsmetodes pot<strong>en</strong>tiale, er allerede nu meget stort, m<strong>en</strong> som med de fleste andr<strong>en</strong>ye behandlingsmetoder, må vi regne med <strong>at</strong> de skal bruges som et led i, eller et supplem<strong>en</strong>t <strong>til</strong>allerede eksister<strong>en</strong>de behandlingsformer, eller evt. i kombin<strong>at</strong>ion med andre nye, da metod<strong>en</strong>allerede ved forsøg med mus, har vist <strong>at</strong> det ikke er muligt <strong>at</strong> fjerne kræftsvulsterne helt, m<strong>en</strong> kunformindske dem betydeligt.14
Jespers forslag <strong>til</strong> <strong>en</strong> mulig behandlingsmetode, er dog kun <strong>en</strong> ud af mange, og det i <strong>sig</strong> selv, ervældig lov<strong>en</strong>de for forskning<strong>en</strong> g<strong>en</strong>erelt, da man før har set, <strong>at</strong> det er muligt <strong>at</strong> få stor succes ve<strong>dk</strong>ombin<strong>at</strong>ion af flere forskellige behandlingsmetoder, dette er f.eks. set ved behandling<strong>en</strong> afHIV/AIDS. Jespers behandling, som er de<strong>sig</strong>net <strong>til</strong> <strong>at</strong> ”angribe” de proteiner, som forhindrer cell<strong>en</strong> i<strong>at</strong> begå selvmord, selv efter <strong>at</strong> cell<strong>en</strong> ikke burde have nog<strong>en</strong> mulighed for, <strong>at</strong> overleve, er i <strong>sig</strong> selvet g<strong>en</strong>nembrud. M<strong>en</strong> da d<strong>en</strong> ikke i <strong>sig</strong> selv kan klare <strong>at</strong> slå kræft<strong>en</strong> helt ud, må det tænkes <strong>at</strong> væremuligt <strong>at</strong> kombinere d<strong>en</strong>ne behandling, som eg<strong>en</strong>tlig går på d<strong>en</strong> fjerde barriere, må kunnekombineres med behandlinger udviklet ud <strong>fr</strong>a d<strong>en</strong> nye vid<strong>en</strong> om de otte barriere, så de i fællesskabkan bekæmpe kræft<strong>en</strong>. Med det m<strong>en</strong>es, <strong>at</strong> det burde være muligt <strong>at</strong> bekæmper kræft<strong>en</strong> med ancocktail af behandlinger, da de så vil kunne støtte hinand<strong>en</strong>, og hver især dræbe de kræft<strong>celle</strong>r, deandre kompon<strong>en</strong>ter i cocktail<strong>en</strong> ikke kan få ram på, med det result<strong>at</strong>, <strong>at</strong> samtlige kræft<strong>celle</strong>r rammesaf <strong>en</strong> af typerne, og dermed dør.Kirurgi og kemoterapiHvis kræft<strong>celle</strong>r er nået så langt, så de har brudt de 8 barrierer, vil det betyde <strong>at</strong> sygdomm<strong>en</strong> ikkekan stoppes på n<strong>at</strong>urligt plan. Her kan man så bruge d<strong>en</strong> vigtigste behandlingsmetode kirurgi, hviskræftsvulst<strong>en</strong> er velafgrænset. Det er d<strong>en</strong> behandling som kurerer flest kræftp<strong>at</strong>i<strong>en</strong>ter. For <strong>at</strong> væresikker på <strong>at</strong> man også har fjernet alle kræft<strong>celle</strong>r i det omkringligg<strong>en</strong>de væv eller andre steder ikropp<strong>en</strong>, følger man i nogle <strong>til</strong>fælde op med kemoterapi eller strålebehandling.Kirurgi<strong>en</strong> kan dog ikke altid b<strong>en</strong>yttes, hvis svulst<strong>en</strong> sidder et sted, hvor det ikke er muligt <strong>at</strong>operere, som f.eks. hjern<strong>en</strong>, eller hvis d<strong>en</strong> sidder i et organ man ikke kan undvære for <strong>at</strong> overleve.En kræftform, som testikelkræft, er der hvor næst<strong>en</strong> alle bliver kureret. Grund<strong>en</strong> er, <strong>at</strong> man ”bare”kan fjerne d<strong>en</strong> testikel, hvor kræftsvulst<strong>en</strong> er opstået. Hvis det skulle ske <strong>at</strong> d<strong>en</strong> havde spredt <strong>sig</strong> <strong>til</strong>f.eks. lungerne, b<strong>en</strong>ytter man <strong>en</strong> type kemoterapi, som specifikt går ind og angriber d<strong>en</strong> kræftform.På nuvær<strong>en</strong>de tidspunkt har man dog ikke <strong>en</strong> kemoterapi, der virker lige så specifikt på andrekræftformer, <strong>en</strong>d det er <strong>til</strong>fældet med testikelkræft. M<strong>en</strong> der sker <strong>fr</strong>emskridt hele tid<strong>en</strong>.For 20 år sid<strong>en</strong> gav man f.eks. p<strong>at</strong>i<strong>en</strong>ter med brystkræft <strong>en</strong> kemoterapi, der resulterede i noglevoldsomme bivirkninger. I dag har man meget mere avancerede mediciner, der virker meremålrettet på sygdomm<strong>en</strong>. Det helbreder dog ikke alle.15
Helbredelse i Fremtid<strong>en</strong>, Angiog<strong>en</strong>ese.Det, der gør kræft <strong>til</strong> <strong>en</strong> af de farligste sygdomme, vi har i dag, er <strong>at</strong> det <strong>en</strong>dnu ikke er muligt <strong>at</strong>stoppe kræft<strong>celle</strong>rne i <strong>at</strong> sprede <strong>sig</strong> <strong>til</strong> andre <strong>dele</strong> af kropp<strong>en</strong>. Hvis det var muligt, <strong>at</strong> standsekræftcell<strong>en</strong> i <strong>at</strong> blive aggressiv, ville kræft i <strong>sig</strong> selv ikke være farligt, hvis det opdages i tide.Man har fundet ud af, <strong>at</strong> <strong>en</strong> af de mut<strong>at</strong>ioner, der finder sted i kræftsvulst<strong>en</strong>, giver kræftsvulst<strong>en</strong>evn<strong>en</strong> <strong>til</strong> <strong>at</strong> kontrollere blo<strong>dk</strong>ardannels<strong>en</strong> (angiog<strong>en</strong>ese)Når d<strong>en</strong>ne mut<strong>at</strong>ion finder sted, bliver det livsfarligt for p<strong>at</strong>i<strong>en</strong>t<strong>en</strong>, da kræftsvulst<strong>en</strong> nu har fået<strong>til</strong>ført blod og derved har fået næring <strong>til</strong> <strong>at</strong> vokse aggressivt og sprede <strong>sig</strong> ud i kropp<strong>en</strong>.Forskere har fundet ud af, <strong>at</strong> der er forskellige stoffer i kropp<strong>en</strong>, der kan <strong>fr</strong>emme eller hæmmedannels<strong>en</strong> af blo<strong>dk</strong>ar. (20 stoffer der <strong>fr</strong>emmer, og mere <strong>en</strong>d 30 stoffer, der hæmmer)Forskerne arbejder på, <strong>at</strong> kunne angribe de kemiske <strong>sig</strong>nalstoffer (med et af de hæmm<strong>en</strong>de stoffer.Det vides <strong>en</strong>dnu ikke, hvordan de forskellige stoffer præcist virker, og derfor ved forskerne hellerikke, hvilket af stofferne, der vil være det helt optimale <strong>til</strong> dette lægemiddel), der gør, <strong>at</strong> kræftcell<strong>en</strong>er i stand <strong>til</strong> <strong>at</strong> skabe nye blodforsyninger.Hvis blodforsyning<strong>en</strong> afskæres, kan kræftsvulst<strong>en</strong> hverk<strong>en</strong> vokse eller sprede <strong>sig</strong>.Hvis dette kan virke i praksis, er det også <strong>en</strong> plusside, <strong>at</strong> de kemiske <strong>sig</strong>nalstoffer kun kommer <strong>fr</strong>akræftsvulst<strong>en</strong>, og metod<strong>en</strong> vil derfor ikke påvirke de raske <strong>celle</strong>r.Kræftsvulst<strong>en</strong> er indrettet på <strong>en</strong> måde, så d<strong>en</strong> har forskellige back up systemer.Det vil <strong>sig</strong>e, <strong>at</strong> svulst<strong>en</strong> ikke kun har én blo<strong>dk</strong>ar<strong>fr</strong>emmer. Det er derfor nødv<strong>en</strong>digt, <strong>at</strong> medicin<strong>en</strong>bliver <strong>en</strong> slags cocktail af forskellige blodhæmmere. (Det vil også betyde <strong>at</strong> det ikke vil være præcisd<strong>en</strong> samme medicin, der kan bruges på alle p<strong>at</strong>i<strong>en</strong>ter. Dette er med <strong>til</strong> <strong>at</strong> vanskeliggøre process<strong>en</strong> i<strong>at</strong> finde <strong>en</strong> kur.)Det vil heller ikke være alle m<strong>en</strong>nesker, der kan tage imod d<strong>en</strong>ne medicin. Hvis p<strong>at</strong>i<strong>en</strong>t<strong>en</strong> fx harproblemer med hjertet, vil nogle af de raske <strong>celle</strong>r, som kræftsvulst<strong>en</strong> også gør, s<strong>en</strong>de <strong>sig</strong>nalstofferud i kropp<strong>en</strong>, der <strong>fr</strong>emmer blo<strong>dk</strong>ardannels<strong>en</strong>. Disse vil også blive ramt af medicin<strong>en</strong>, og risiko<strong>en</strong> forhjerte<strong>til</strong>fælde vil stige.På de 6500 m<strong>en</strong>nesker, der prøve-testede medicin<strong>en</strong> kunne man se gode result<strong>at</strong>er, der viste <strong>en</strong>forbedring. En and<strong>en</strong> positiv ting, der overraskede forskerne var <strong>at</strong> blo<strong>dk</strong>arhæmmere forbedrervirkning<strong>en</strong> af behandlingsmetoder som kemoterapi og stråleterapi. Eftersom de lægemidler, deranv<strong>en</strong>des <strong>til</strong> kemoterapi, skal passere blodbanerne for <strong>at</strong> komme ind i kræftsvulst<strong>en</strong> og16
stråleterapi<strong>en</strong> afhænger af iltindholdet i svulst<strong>en</strong>, kan dette virke mods<strong>at</strong> af, hvad man forv<strong>en</strong>tede,og forskerne er <strong>en</strong>dnu ikke klar over hvorfor det forholder <strong>sig</strong> sådan.M<strong>en</strong> <strong>en</strong> ting er sikkert. Der vil forts<strong>at</strong> blive forsket i dette, og dette kunne blive <strong>en</strong> måde <strong>at</strong> helbredekræft på i <strong>fr</strong>emtid<strong>en</strong>.(kilde illustreret vid<strong>en</strong>skab nr. 9, 2003)Ny Vid<strong>en</strong>HERCEPTIN:Al d<strong>en</strong> nye vid<strong>en</strong> omkring kræft, har allerede fået nogle forskere tættere på nogle små g<strong>en</strong>nembrudind<strong>en</strong>for kræftbehandling. De har nemlig udviklet <strong>en</strong> ny medicin, der mere fokuserer påkræft<strong>celle</strong>rnes processer <strong>en</strong>d de <strong>normal</strong>e <strong>celle</strong>r. De nye præpar<strong>at</strong>er giver et fingerpeg om, hvorudvikling<strong>en</strong> af ny medicin er på vej h<strong>en</strong>. Der er f.eks. de to præpar<strong>at</strong>er Herceptin og Gleevec.Herceptin er et antistof, der er rettet mod EGF-receptor<strong>en</strong>. Forskere har nemlig fundet ud af, <strong>at</strong>nogle brystkræft<strong>celle</strong>r er afhængige af EGF for <strong>at</strong> kunne <strong>dele</strong> <strong>sig</strong>. EGF virker ved <strong>at</strong> d<strong>en</strong> binder <strong>sig</strong><strong>til</strong> EGF-receptor<strong>en</strong> på brystkræft<strong>celle</strong>rnes overflade, og på d<strong>en</strong> måde danner <strong>en</strong> deling i <strong>celle</strong>rne.Med d<strong>en</strong> vid<strong>en</strong> har forskerne så udviklet dette antistof, Herceptin, der går ind og binder <strong>sig</strong> <strong>til</strong> EGFreceptor<strong>en</strong>,og sørger for på d<strong>en</strong> måde, <strong>at</strong> EGF ikke kan binde <strong>sig</strong> <strong>til</strong> EGF-receptor<strong>en</strong>. Med detresult<strong>at</strong>, <strong>at</strong> kræft<strong>celle</strong>rne ikke <strong>dele</strong>r <strong>sig</strong>.Det er dog ikke alle brystkræft-p<strong>at</strong>i<strong>en</strong>ter der vil have gavn af d<strong>en</strong>ne behandling. Det kræver nemlig<strong>at</strong> der produceres meget EGF-receptor i brystkræft<strong>celle</strong>rne, og <strong>at</strong> d<strong>en</strong> er afhængig af EGF. Derfortestes d<strong>en</strong> <strong>en</strong>kelte kræftp<strong>at</strong>i<strong>en</strong>ts kræft<strong>celle</strong>r for, hvor meget EGF-receptor de har, før <strong>en</strong> evt.behandling.GLEEVEC:Det andet stof mod kræft, Gleevec, rammer også et vækst<strong>sig</strong>nal. Forskere har fundet ud af, <strong>at</strong> <strong>en</strong>bestemt form for leukæmi, CML (kronisk myeloid leukæmi), altid spiller ind ved <strong>en</strong> særlig ændringaf kromosomerne (én helt bestemt translok<strong>at</strong>ion). Translok<strong>at</strong>ion<strong>en</strong> gør, <strong>at</strong> <strong>en</strong> vækstreceptor, c-kit,konstant er aktiv. Forskerne har herefter, ud <strong>fr</strong>a d<strong>en</strong> vid<strong>en</strong>, fundet <strong>en</strong> hæmmer, Gleevec, som kanblokere d<strong>en</strong> aktive c-kit. Og det virker. CML-p<strong>at</strong>i<strong>en</strong>et har derfor fået <strong>en</strong> ekstra chance.17
Desværre diagnosticeres de fleste p<strong>at</strong>i<strong>en</strong>ter ikke i tide, så nogle få kræft<strong>celle</strong>r har udviklet <strong>sig</strong> videreog slås ikke ihjel af Gleevec. Derfor kureres de fleste p<strong>at</strong>i<strong>en</strong>ter ikke.Bivirkninger ved stofferne:Begge stoffer har bivirkninger, m<strong>en</strong> som er meget mindre <strong>en</strong>d de bivirkninger der forekommer vedd<strong>en</strong> traditionelle kemoterapi. Bivirkninger ved de to stoffer skyldes bl.a., <strong>at</strong> de ikke er 100%specifikke. Herceptin er også i stand <strong>til</strong> <strong>at</strong> binde <strong>sig</strong> <strong>til</strong> andre <strong>celle</strong>r <strong>en</strong>d lige dem i brysterne.Gleevec hæmmer også andre receptorer som minder om c-kit.Sidste bemærkning...Kræft<strong>en</strong>s mysterier er <strong>en</strong>dnu ikke løst, m<strong>en</strong> vi er nået et stort skridt nærmere. På baggrund af d<strong>en</strong>nyeste kræftforskning er det nu muligt for forskerne, <strong>at</strong> forstå <strong>til</strong> <strong>en</strong> hvis grad hvad det eg<strong>en</strong>tlig erder sker, når et m<strong>en</strong>neske udvikler kræft. Det næste skridt for forskerne er <strong>at</strong> kunne bruge d<strong>en</strong>nevid<strong>en</strong> i behandling<strong>en</strong>. For i <strong>fr</strong>emtid<strong>en</strong> <strong>at</strong> kunne komme kræft<strong>en</strong> <strong>til</strong> livs ud<strong>en</strong> de store g<strong>en</strong>er som <strong>en</strong>behandling i dag kræver og med større overlevelses muligheder.Underskrift: Asbjørn Dorte Maria RieWejdlling Claus<strong>en</strong> Schrøder Koldorf18
Litter<strong>at</strong>urlisteBøger:Titel Forf<strong>at</strong>ter Forlag ISBNBog<strong>en</strong> om kræft 1 Lasse Foghsgaard Erhvervsskolernes Forlag 2001 87-7881-274-7D<strong>en</strong> Store DanskeDanmarks N<strong>at</strong>ionalleksikon A/S87-7789-045-0Enzyklæpædi bind 111998M<strong>en</strong>neskets fysiologi Eigel Haug G E C gad 87-12-02229-2Tidsskrift:illustreret vid<strong>en</strong>skab nr. 9, 2003Hjemmesider:www.liv.<strong>dk</strong>1”Bog<strong>en</strong> om Kræft” er brugt som grundbog, og alle konkrete oplysninger er h<strong>en</strong>tet <strong>fr</strong>a d<strong>en</strong>, med undtagelse af artikl<strong>en</strong><strong>fr</strong>a Illustreret vid<strong>en</strong>skab. Vi har dog lavet research på nettet og i artikler <strong>fr</strong>a KVL's bio-info.19