Varmepumpen â et eksempel pÃ¥ brug af termodynamikkens ... - LMFK
Varmepumpen â et eksempel pÃ¥ brug af termodynamikkens ... - LMFK
Varmepumpen â et eksempel pÃ¥ brug af termodynamikkens ... - LMFK
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Varmepumpen</strong><br />
– <strong>et</strong> <strong>eksempel</strong> på <strong>brug</strong> <strong>af</strong> <strong>termodynamikkens</strong> 1. og 2. hovedsætning<br />
Ole Witt–Hansen, Køge Gymnasium<br />
I juni var jeg censor på <strong>et</strong> A–niveau hold i fysik. En <strong>af</strong> øvelser,<br />
som jeg blev præsenter<strong>et</strong> for, var varmepumpen. Lidt<br />
overraskende for mig, id<strong>et</strong> termodynamikken jo ikke er ganske<br />
ukomplicer<strong>et</strong>, og fordi fascinationen <strong>af</strong> varmepumper til<br />
jordvarme toppede i kølvand<strong>et</strong> på halvfjerdsernes oliekriser.<br />
Forsøg<strong>et</strong> med varmepumpen krævede nu heller ikke and<strong>et</strong> end<br />
1. hovedsætning, id<strong>et</strong> den varme Q 2<br />
, som tilføres den ene beholder,<br />
er lig med den varme Q 1<br />
, som hentes fra den anden beholder,<br />
plus d<strong>et</strong> arbejde A, som varmepumpen udfører.<br />
Q 2<br />
= A + Q 1<br />
Effektivit<strong>et</strong>en beregnes som<br />
η = Q 2<br />
/A<br />
Effektivit<strong>et</strong>en er teor<strong>et</strong>isk klart altid større end 1. Formål<strong>et</strong><br />
med forsøg<strong>et</strong> var at bestemme effektivit<strong>et</strong>en ud fra temperaturkurverne,<br />
id<strong>et</strong> varmemængderne jo kan beregnes ud fra kalorim<strong>et</strong>erligningerne.<br />
Q 1<br />
= –m 1·c·ΔT 1<br />
og Q 2<br />
= m 2·c·ΔT 2<br />
Temperaturerne i de to beholdere blev dataopsaml<strong>et</strong> og ført<br />
ind i en computer, hvor de to kurver blev tegn<strong>et</strong>. Desværre<br />
sk<strong>et</strong>e der <strong>et</strong> eller and<strong>et</strong>, så alle data blev mist<strong>et</strong> på <strong>et</strong> sent tidspunkt<br />
<strong>af</strong> forsøg<strong>et</strong>.<br />
De temperaturkurver, som jeg nåede at se, så ud til at være lineære,<br />
men fysiklæreren fastslog, at d<strong>et</strong> var de ikke. Jeg længtes<br />
nu efter en teor<strong>et</strong>isk begrundelse for de to temperaturkurver.<br />
Da jeg tænkte over d<strong>et</strong> senere, var d<strong>et</strong> klart, at en teor<strong>et</strong>isk<br />
udledning kun er mulig ved en differentiel anvendelse <strong>af</strong><br />
2. hovedsætning, og så har vi jo passer<strong>et</strong> gymnasieniveau<strong>et</strong><br />
med flere længder. På denne måde er d<strong>et</strong> ellers meg<strong>et</strong> simpelt:<br />
1. hovedsætning: dQ 2<br />
= dA + dQ 1<br />
Vi kan uden egentlig indskrænkning antage at m 1<br />
= m 2<br />
= m,<br />
og ved at forkorte med c·m, får man ligningen:<br />
dQ1<br />
dQ2<br />
+ = 0<br />
T1<br />
T2<br />
dT1<br />
dT2<br />
⇔ + = 0 ⇔ lnT1 + ln T2 = k1 ⇔ T1·<br />
T2<br />
= k<br />
T T<br />
1<br />
2<br />
Vi finder d<strong>et</strong> simple resultat, som konsekvens <strong>af</strong> entropibevarelse,<br />
at T 1<br />
og T 2<br />
er omvendt proportionale. For at anvende<br />
d<strong>et</strong>te i 1. hovedsætning, bliver vi nødt til at have en sammenhæng<br />
mellem dT 1<br />
og dT 2<br />
.<br />
Ud fra ligningen T 1·T 2<br />
= k følger imidlertid<br />
T<br />
1<br />
k<br />
k<br />
= ⇒ dT1<br />
= −<br />
T<br />
T<br />
2<br />
og tilsvarende<br />
dT<br />
2 2<br />
2<br />
k<br />
k<br />
T2<br />
= ⇒ dT2<br />
= −<br />
T<br />
T<br />
dT 2 1<br />
1<br />
1<br />
Indsættes d<strong>et</strong> ene (eller d<strong>et</strong> and<strong>et</strong>) udtryk i 1. hovedsætning,<br />
dQ 2<br />
= dA + dQ 1<br />
, og dA = Pdt, hvor P er den tilførte effekt, fås:<br />
cm·dT 2<br />
= Pdt – cm·dT 1<br />
(minus fordi dT 1<br />
er negativ) – og man finder, at<br />
cm ⋅ dT cm k<br />
T dT Pdt k P<br />
2 − = ⇒ − dT<br />
T<br />
= cm dt<br />
2 2<br />
( 1 )<br />
2 2<br />
Og tilsvarende<br />
2<br />
cm ⋅ dT cm k<br />
T dT Pdt k P<br />
1 − = − ⇒ − dT<br />
T<br />
= cm dt<br />
2 1<br />
( 1 )<br />
2 1<br />
1<br />
Tilsyneladende er der fuldstændig symm<strong>et</strong>ri mellem de to ligninger,<br />
men k = T 1<br />
T 2<br />
= T 02<br />
, hvor T 0<br />
er den fælles begyndelsestemperatur.<br />
Hvis T 2<br />
forøges blot en lille smule, vil T 1<br />
formindskes<br />
tilsvarende, så T 2<br />
2<br />
> k, mens T 1<br />
2<br />
< k i ligningerne ovenfor.<br />
2<br />
1<br />
Matematik<br />
Fysik<br />
2. hovedsætning: dS = dS 1<br />
+ dS 2<br />
hvor S er entropien og dS<br />
1<br />
dQ1<br />
dQ2<br />
= og dS2<br />
= .<br />
T<br />
T<br />
Hvis processen er reversibel – og d<strong>et</strong> bliver vi nødt til at antage,<br />
hvis vi vil udlede nog<strong>et</strong> som helst – vil der gælde:<br />
dS = 0 Û dS 1<br />
+ dS 2<br />
= 0 Û dQ T<br />
1<br />
1<br />
1<br />
2<br />
dQ2<br />
+ = 0<br />
T<br />
hvor man kan indsættes udtrykkene ovenfor, som på differentiel<br />
form bliver: dQ 1<br />
= –m 1·c·ΔT 1<br />
og dQ 2<br />
= m 2·c·ΔT 2<br />
.<br />
2<br />
De to faktorer i parenteserne vil derfor få forskelligt fortegn<br />
så T 1<br />
vil <strong>af</strong>tage mens T 2<br />
vil vokse.<br />
Id<strong>et</strong> T 10<br />
og T 20<br />
b<strong>et</strong>egner de to begyndelsestemperaturer, lader<br />
ligningerne sig nemt integrere til at give:<br />
T<br />
k k P<br />
− T + − =<br />
T T cm t<br />
k k P<br />
og T1 − T10<br />
+ − =<br />
T T cm t<br />
2 20<br />
2 20<br />
1 10<br />
Ganger man den første ligning igennem med T 2<br />
T 20<br />
fremkommer<br />
en 2.gradsligning, som efter reduktion bliver:<br />
26 <strong>LMFK</strong>-blad<strong>et</strong> 6/2011
2 k<br />
T T<br />
T k P<br />
2 − ( 20 + +<br />
cm t ) T 2 + k = 0 ⇔<br />
20<br />
2<br />
T − qT + k = 0<br />
2<br />
2<br />
k<br />
q T<br />
T k P<br />
hvor = ( 20 + + t)<br />
cm<br />
20<br />
samt en helt tilsvarende ligning for T 1<br />
. Selv om løsningen er<br />
helt lig<strong>et</strong>il, er den ikke særlig anvendelig. D<strong>et</strong> bedste er faktisk,<br />
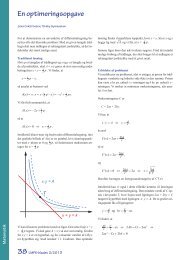
at løse differentialligningerne numerisk. D<strong>et</strong>te er vist på<br />
den første figur nedenfor.<br />
For begge beholdere med 2 liter vand og fælles begyndelsestemperatur<br />
på 20 °C bliver kurverne som vist nederst.<br />
Temperaturen i den ene beholder falder imidlertid hurtigt til<br />
under frysepunkt<strong>et</strong>, så kurverne er ikke realistiske. For at få<br />
en mere realistisk beskrivelse, må vi antage, at d<strong>et</strong> ene reservoir<br />
er meg<strong>et</strong> større end d<strong>et</strong> and<strong>et</strong>. Principielt er d<strong>et</strong> d<strong>et</strong> samme<br />
som før, men opstillingen <strong>af</strong> differentialligningerne kræver<br />
lidt mere arbejde.<br />
cm 1·dT 1<br />
+ cm 2·dT 2<br />
= Pdt =><br />
cm ⋅dT −cm<br />
1 1 2<br />
⎛ k ⎞<br />
⎝⎜<br />
T1<br />
⎠⎟<br />
bT k b 1<br />
T T dT P<br />
( 1− ( ) ) 1 =<br />
cm dt<br />
1<br />
1<br />
1<br />
1<br />
b<br />
1<br />
dT = Pdt ⇒<br />
1<br />
1<br />
I d<strong>et</strong>te tilfælde er en eventuel analytisk løsning ikke særlig meningsfuld,<br />
så vi nøjes med en numerisk løsning. Sætter vi fx<br />
β = 0,1 (m 1<br />
= 10·m 2<br />
), så fremkommer følgende kurver, hvor tiden<br />
er <strong>af</strong>sat ud ad 1.aksen og Kelvin–temperaturen ad 2. aksen.<br />
Kurverne er i overensstemmelse med de kurver, jeg nåede at<br />
se på computergr<strong>af</strong>erne fra forsøg<strong>et</strong>.<br />
dQ<br />
T<br />
1<br />
1<br />
dQ2<br />
+ = 0 , dQ<br />
T<br />
1<br />
= cm 1·dT 1<br />
og dQ 2<br />
= cm 2·dT 2<br />
=><br />
2<br />
m1dT1<br />
m2dT2<br />
+ = 0<br />
T1<br />
T2<br />
b<br />
m<br />
som fører til<br />
2<br />
T1T<br />
2 = k, hvor b = . D<strong>et</strong>te fører så til<br />
ligningerne:<br />
m1<br />
T<br />
1<br />
k<br />
k<br />
= ⇒ dT1<br />
= − dT<br />
1 2<br />
T<br />
b b<br />
+ b<br />
T<br />
og<br />
2<br />
2<br />
T<br />
b<br />
2<br />
k<br />
b−1<br />
k<br />
= ⇒ bT2<br />
dT2<br />
= −<br />
T<br />
T<br />
1<br />
dT<br />
2 1<br />
1<br />
, dvs.<br />
dT<br />
⇒<br />
2<br />
k<br />
T T dT k<br />
= −<br />
T T T T dT<br />
1 2 1 = −<br />
b−<br />
b −1<br />
b<br />
b( )<br />
2<br />
1<br />
kT2<br />
kT dT k(<br />
kT1<br />
)<br />
= − 1 = −<br />
b<br />
bkT<br />
2<br />
1<br />
1<br />
−1<br />
b<br />
1<br />
1<br />
−1<br />
b<br />
( kT )<br />
k<br />
= − dT1<br />
= −<br />
bT1<br />
bT<br />
dT<br />
⎛ k ⎞<br />
⎝<br />
⎜T1<br />
⎠⎟<br />
= −<br />
bT<br />
1<br />
b<br />
1<br />
dT<br />
1<br />
1<br />
1<br />
b<br />
2 1 2<br />
dT<br />
1<br />
dT<br />
1 1 1<br />
+<br />
b<br />
1<br />
1<br />
1<br />
D<strong>et</strong>te indsættes i 2. hovedsætning som tidligere:<br />
cm 2·dT 2<br />
+ cm 1·dT 1<br />
= Pdt =><br />
Matematik<br />
Fysik<br />
bk<br />
cm2 ⋅dT2 − cm1<br />
dT Pdt<br />
1 2 = ⇒<br />
b+<br />
T<br />
k<br />
P<br />
( 1− ) bdT<br />
T<br />
cm dt<br />
1 2 =<br />
b+<br />
2<br />
2<br />
1<br />
28 <strong>LMFK</strong>-blad<strong>et</strong> 6/2011