You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Alle veje fører til dødsproteaserne<br />
Mitokondrierne har længe været kendt som cellens energifabrikker,<br />
fordi de sørger for dannelsen af det energirige molekyle,<br />
ATP (adenin-tri-fosfat). Men den seneste tids forskning<br />
har også vist, at næsten uanset hvilket dødssignal en celle<br />
modtager, åbner mitokondrierne porer i deres membraner<br />
og afgiver et særligt protein, nemlig cytokrom c. Cytokrom c<br />
aktiverer så en særlig gruppe af proteiner.<br />
Disse proteiner består af såkaldte proteaser, som bærer et særligt<br />
navn, nemlig caspaser. Proteaser er særlige enzymer, som i<br />
aktiv form er i stand til at spalte de proteiner, de kan genkende.<br />
Caspaserne bliver også kaldt dødsproteaserne, for når de<br />
har udført deres opgave, er cellen så godt som død. Caspaserne<br />
kunne billedligt talt være en stor samling af skarpe<br />
knive, som i den normale celle ligger i skeder, så de ikke gør<br />
nogen skade. Når caspaserne bliver aktive (lige meget hvilken<br />
dødsknap, der er blevet trykket på), fjernes skederne, og<br />
de skarpe knivblade vil kløve (spalte) andre proteiner, som i<br />
sidste ende vil gøre det af med cellen. Proteiner, der bliver<br />
spaltet under selvmordet, bliver også kaldt dødssubstrater,<br />
fordi deres spaltning er et sikkert tegn på, at cellen vil dø.<br />
Caspaser er proteaser.<br />
Proteaser er enzymer.<br />
Enzymer er proteiner.<br />
Men ikke alle proteiner er enzymer, etc. ...<br />
Dødssubstraterne – ofrene for de skarpe knive<br />
På nuværende tidspunkt har man opdaget over 100 dødssubstrater.<br />
Mange af dødssubstraterne er strukturelle proteiner, som<br />
sørger for, at cellen kan have den rumlige form, den nu har.<br />
Cellens strukturelle proteiner kaldes samlet for cellens cytoskelet.<br />
Hvis man for eksempel forestiller sig en celle som et<br />
iglotelt, er det de strukturelle proteiner – cytoskelettet – teltstængerne,<br />
som sørger for, at teltet er rummeligt. Mange af<br />
de strukturelle proteiner bliver kløvet af de aktive caspaser,<br />
og det får cellen til at falde sammen. Præcis som det ville<br />
ske, hvis vi skar igloens teltstænger over.<br />
CAD uden ICAD klipper DNA’et i små stykker<br />
Resten af dødssubstraterne er enten enzymer eller hæmmere<br />
af enzymer. Enzymerne kan enten blive aktive eller miste<br />
deres funktion, når de spaltes af dødsproteaser. Spaltede<br />
hæmmere har kun en skæbne. Det gør dem ude af stand til at<br />
hæmme deres enzym. ICAD (fra engelsk: Inhibitor of caspaseactivated<br />
DNase) er et godt eksempel på det sidste.<br />
ICAD binder sig til CAD (fra engelsk: caspase-activated<br />
DNase). Det gør CAD ude af stand til at udføre sin funktion,<br />
som er at klippe cellens DNA i små stykker. Men når caspaserne<br />
bliver aktive efter et dødssignal, sørger de for at spalte<br />
ICAD i to dele, så den ikke længere kan binde sig til CAD.<br />
På den måde mister CAD sin hæmmer og bevæger sig her-<br />
58 Bogen om kræft<br />
efter ind i cellekernen, hvor den går i gang med at klippe<br />
DNA’et i stykker. Så er selvmordet uigenkaldeligt. Cellen dør.<br />
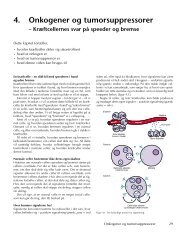
Cytoskelet<br />
Dødssubstrater Enzym<br />
Enzymhæmmere<br />
Selvmordet og Storebælt<br />
De fleste dødssignaler påvirker altså hurtigt cellens mitokondrier<br />
til at afgive cytokrom c. Cytokrom c aktiverer cellens caspaser,<br />
som spalter dødssubstraterne, og det ender med cellens<br />
undergang. Man kan sammenligne dødsignalernes vej<br />
gennem cellen med en tur over Storebælt. Bilerne (de forskellige<br />
dødssignaler) kører ad forskellige veje (signalveje) for<br />
at nå til broen (deres fælles mål). Ved broen får de en billet<br />
(cytokrom c) fra kassen (mitokondrien), som så giver bilerne<br />
adgang til at køre ad den samme motorvej, hvor dødsproteaserne<br />
og dødssubstraterne i skøn forening får cellen til at dø.<br />
Overlevelsesproteiner – bomme på vejen<br />
Indtil nu har vi fokuseret på de proteiner, som modtager<br />
dødssignalet og sender det videre. Det er et forenklet billede,<br />
fordi der også findes proteiner, som prøver at bremse dødssignalet.<br />
Disse proteiner kaldes overlevelsesproteiner. Med<br />
Storebæltsbilledet i frisk erindring er overlevelsesproteinerne<br />
bomme på vejen, som holder bilerne (dødssignalerne) tilbage.<br />
Bcl-2 hæmmer cytokrom c’s frigivelse<br />
I en normal celle er overlevelsesproteinet Bcl-2 bundet til<br />
mitokondriens ydre membran. Her sørger Bcl-2-proteinet<br />
for, at cytokrom c ikke bliver frigivet fra mitokondrien. Det<br />
vil sige, mens dødssignaler får cytokrom c til at forlade mitokondrien,<br />
gør Bcl-2 det modsatte. Man kan sige, at overlevelsesproteinet<br />
Bcl-2 og dødssignalerne modarbejder hinanden,<br />
og kampen drejer sig om cytokrom c. Skal cytokrom c<br />
blive i mitokondrien og cellen overleve, eller skal cytokrom<br />
c frigives og cellen dø?<br />
Hvem vinder?<br />
I en normal celle, som ikke har modtaget et dødssignal, vinder<br />
Bcl-2. Bcl-2-proteinet kan uden modstand holde cytokrom<br />
c tilbage i mitokondrien (figur 6.6). Hvis cellen modtager<br />
et dødssignal, som er vedholdende (det vil sige, at dødssignalet<br />
ikke lige pludselig forsvinder, for eksempel ved at en<br />
dræbercelle forlader den skadede celle, før dødssignalet for<br />
alvor er sat i gang), vil dødssignalet med tiden overvinde<br />
Bcl-2-proteinets modstand. Derfor vil cytokrom c til sidst forlade<br />
mitokondrien, og cellen dør.<br />
Balance mellem liv og død<br />
Kampen mellem dødssignalerne og Bcl-2 fortæller også,<br />
hvorfor overlevelsesproteiner er vigtige. Overlevelsesproteinerne<br />
medvirker til at regulere cellers selvmord nøje, så cel-