You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
4. Udvikling af kræft<br />
– otte barrierer cellerne skal over<br />
Dette kapitel fortæller<br />
· hvordan en normal celle bliver til en kræftcelle<br />
· hvorfor kræft sjældent opstår<br />
· hvordan denne nye viden om kræft kan bruges i behandlingen<br />
For at kræft kan opstå må der ske en række fejl i cellerne.<br />
Det kan f.eks. være, at cellerne deler sig ubegrænset, eller at<br />
cellerne ikke dør, når de skal. Der skal mange ændringer til,<br />
og de normale celler gør, hvad de kan for at forhindre udvikling<br />
af kræft. Hver enkelt forhindring er en barriere mod kræft.<br />
Kræft er en genetisk sygdom<br />
De ændringer, cellerne skal gennemgå for at blive kræftceller,<br />
begynder alle med ændringer (mutationer) i vores arve-<br />
materiale (DNA). Der skal ske en lang række mutationer i<br />
cellerne, for at de overvinder den normale celles barrierer<br />
mod kræft. Mutationerne kan ske ved påvirkninger fra omgivelserne<br />
i form af fysiske eller kemiske påvirkninger, de kan<br />
ske spontant eller være arvet.<br />
Mutationerne i DNA'et kan bestå af en fejl i en enkelt<br />
base eller skyldes mangel på større stykker DNA.<br />
Der opstår løbende fejl i vores DNA. I de fleste tilfælde vil<br />
cellerne rette disse fejl ved hjælp af særlige reparationsen-<br />
Figur 4.1. Otte barrierer. En normal celle skal ikke bare bryde én barriere for at blive til en fuldmoden kræftcelle. Den skal bryde mange barrierer, og det er med stor<br />
risiko for at dø undervejs. Det er her afbildet som en trappe, hvor hvert trin repræsenterer en barriere, som skal brydes, for at en normal celle kan blive til en fuldmoden<br />
kræftcelle. Den normale celle, eller den spirende kræftcelle, har ikke nogen ånd eller vilje, så at bryde en barriere er ikke noget, den selv finder på. Det er mutationer,<br />
som rammer så uheldigt, at de giver cellen evnen til at bryde endnu en barriere. Hvis cellen ikke får en mutation, vil kræftudviklingen gå i stå: Enten holder de<br />
spirende kræftceller op med at dele sig, eller også dør de. Det eneste, som kan sætte kræftudviklingen i gang igen, er en mutation i en af de spirende kræftceller, som<br />
får cellen til at overleve og evnen til at dele sig hæmningsløst. En ny barriere er brudt, og celledelingen vil fortsætte, indtil cellerne møder en ny barriere, hvor kræftudviklingen<br />
kan sluttes brat. Eller også lykkes det en enkelt spirende kræftcelle med en ny mutation at bryde den næste barriere osv. At bestige trappen vil altså ikke<br />
bare kræve én mutation, men mange mutationer. Hvis den spirende kræftcelle bryder den sidste barriere – bestiger det sidste trin på kræfttrappen – vil cellen ikke<br />
møde flere naturlige barrierer. For at komme af med de fuldmodne kræftceller skal de bekæmpes kunstigt, og det vil sige med behandling. Rækkefølgen af trinene er<br />
angivet, som den for én type kræft kunne se ud. Ved andre kræftsygdomme kunne rækkefølgen være en anden. Desuden findes der påvirkninger (f.eks. virusinfektioner),<br />
som med ét skridt stiger op ad flere trin. Trappen skal altså ikke tages alt for bogstaveligt, men skal ses som et eksempel på en normal celles vej til at blive til kræft.<br />
Udvikling af kræft<br />
19
zymer. Hvis det ikke er muligt, vil cellen gøre det af med sig<br />
selv – begå selvmord. På denne måde sørger cellerne for, at<br />
beskadiget DNA ikke bliver givet videre til nye celler.<br />
Hvis skaden ikke bliver rettet, vil den blive nedarvet til de<br />
efterfølgende generationer af celler, der nu har fået en mutation.<br />
En sådan mutation vil som regel ikke være skadelig. En<br />
stor del af vores DNA's 3 milliarder baser bruges nemlig slet<br />
ikke, og mutationer her vil ikke gøre nogen skade. Og selvom<br />
mutationen er placeret inde i et gen, er det heller ikke<br />
sikkert, at det fører til kræft. Det er en række ganske særlige<br />
gener, der skal mutere, før den normale celle bliver til en<br />
kræftcelle. Forskerne er ved at danne sig et overblik over, hvilke<br />
mutationer der øger risikoen for kræft. De inddeler mutationerne<br />
i kategorier, der alle i en normal celle hindrer kræft<br />
i at udvikle sig. Hver af disse kategorier udgør en barriere<br />
mod kræft.<br />
For at cellerne skal blive til kræftceller, må følgende barrierer<br />
overskrides:<br />
· Skader på DNA bliver ikke rettet pga. mutationer i cellens<br />
reparationssystemer. Hvis DNA-skader ikke rettes, opstår<br />
der hurtigere flere mutationer, der risikerer at ramme<br />
andre af cellens funktioner, som f.eks. cellens evne til at<br />
kontrollere sin deling.<br />
· Normale cellers mulighed for at dele sig er under skarp<br />
kontrol. Kræftceller deler sig derimod ukontrolleret. Dette<br />
foregår p.g.a. konstant aktive vækstsignaler.<br />
· Signaler, der normalt bremser ukontrollerede celledelinger,<br />
sættes ud af funktion.<br />
· Cellens naturlige evne til at begå selvmord svigter.<br />
· Normale celler bliver gamle, når de har delt sig et vist<br />
antal gange. Kromosomernes ender bliver korte, og normale<br />
celler vil herefter ikke dele sig mere. Kræftcellerne<br />
kan dele sig ubegrænset gennem aktivering af telomerase.<br />
· Kræftceller skal undgå immunsystemets evne til at genkende<br />
og dræbe muterede celler.<br />
· Kræftcellerne skal have masser af næring via blodet. Kræftceller<br />
kan danne nye blodårer via angiogenese.<br />
· Kræftcellerne kan løsrive sig fra deres udgangspunkt og<br />
vandre ind i det omgivende væv eller flytte sig til andre<br />
steder i kroppen (metastasere).<br />
20 Kort om kræft<br />
4.1. Cellerne mister evnen til at reparere deres DNA<br />
DNA'et i vores celler er ikke uforanderligt. F.eks. vil hudcellerne<br />
hos en soldyrker skulle reparere adskillige DNA-skader<br />
som følge af solens UV-stråler. Hvis disse skader ikke repareres<br />
inden næste celledeling, vil skaden blive givet videre<br />
til cellens efterkommere. Skaderne vil blive kopieret, når cellens<br />
DNA kopieres af DNA-polymeraserne. Hermed er der<br />
opstået en mutation, der vil blive givet videre til alle de efterfølgende<br />
celler.<br />
Figur. 4.2. Hvis vores DNA rammes af en skade, kan skaden f.eks. afsløre<br />
sig ved, at DNA-strengen "knækker". Det vil påkalde sig reparationssystemets<br />
opmærksomhed og udløse en kaskade af reaktioner. 1) Det første trin<br />
er fejlfinding. Komplekset, der har lokaliseret en skade på DNA'et, kalder<br />
på andre proteiner, der 2) fjerner det muterede DNA, 3) syntetiserer nyt fejlfrit<br />
DNA og 4) klistrer strengene sammen.<br />
Umiddelbart skulle man tro, at en celle ikke ville lade sig<br />
mærke med at have fået en enkelt mutation, f.eks. en enkelt<br />
mistet base ud af de tre milliarder basepar, som DNA'et består<br />
af. Sådan er det også i langt de fleste tilfælde. Men mutationen<br />
kan være så uheldig, at den har ramt ét af de 30.000 -<br />
40.000 gener, som er spredt ud over cellens DNA. Specielt<br />
hvis skaden har ramt det kodende område af genet, så genet<br />
danner et ændret protein og ikke producerer et normalt og<br />
velfungerende protein. På den måde kan cellen enten miste<br />
en egenskab (proteinet har mistet sin funktion) eller tilegne<br />
sig en anden (proteinet kan f.eks. være konstant aktivt).<br />
Skaderne på DNA kan også være mere fatale, så et eller<br />
flere gener helt forsvinder, og dermed mangler cellen de proteiner,<br />
som evt. har en væsentlig rolle i cellens styring. Eller<br />
skaderne kan være så store, at dele af et kromosom flyttes over<br />
på et andet kromosom (translokation), eller at dele af DNA'et<br />
kopieres flere gange. Det kan medføre, at et gen eller flere<br />
pludseligt bliver overrepræsenteret i den nye celle.<br />
Mutationer opstår som sagt ikke kun, når cellen udsættes<br />
for ydre påvirkninger. De kan også opstå spontant. Det kan<br />
for eksempel ske ved, at der indsniger sig fejl under kopie-
ingen af cellens mange baser (før en forestående celledeling).<br />
I langt de fleste tilfælde vil fejlen blive rettet, men en<br />
gang imellem går det galt. Man siger, at mutationsraten er<br />
1 x 10 -6 . Det vil sige, at en kopieringsfejl får lov til at bestå i<br />
én celle ud af en million celler, der deler sig. Den hyppigste<br />
form for mutation er en såkaldt punktmutation, hvor en nukleinsyre<br />
udskiftes med en anden.<br />
Mutationstyper<br />
Punktmutationer (genmutationer)<br />
· Der udskiftes et eller flere nukleotid-par i genet<br />
· Der indsættes et nyt nukleotid-par i genet<br />
· Der bortfalder et nukleotid-par<br />
Kromosommutationer<br />
· Deletion – et stykke af kromosomet går tabt<br />
· Translokation – et stykke af et kromosom sættes over<br />
på et andet kromosom<br />
· Inversion – et stykke af kromosomet vendes om<br />
Antalsmutationer<br />
· Ændringer i antallet af kromosomer<br />
Det er kun særlige gener, som vi med en samlet betegnelse<br />
kalder kræftgener, der pga. mutationer medvirker til udviklingen<br />
af kræft. Kræftgenerne udgør kun en lille del af det<br />
samlede antal gener. Dvs. at det kun er få – formentlig kun<br />
nogle få hundrede – af cellens 30.000 - 40.000 gener, der<br />
med en mutation kan medvirke til, at en normal celle udvikler<br />
sig til en kræftcelle.<br />
Hvis en celle er så uheldig, at den får en mutation i et<br />
kræftgen, betyder det ikke, at den ene mutation med det<br />
samme kan gøre en normal celle til en kræftcelle. Der skal<br />
flere mutationer i flere kræftgener til, for at det kan ske. Én<br />
mutation i en normal celle er nemlig ikke nok til at føre en<br />
normal celle over alle de barrierer, som en normal celle skal<br />
igennem for at blive til en fuldmoden kræftcelle. Men nogle<br />
mennesker har arvet en fejl i cellerne, som gør dem mere<br />
følsomme over for mutationer. De har arvet en fejl i gener,<br />
der koder for proteiner, som er involveret i reparation af vores<br />
DNA.<br />
Det er ikke nyt, at nogle mennesker er mere disponeret for<br />
at udvikle kræft end andre. De første studier af arv og kræft<br />
blev foretaget for mere end hundrede år siden, men indtil<br />
midten af 1980'erne blev emnet i vide kredse ikke undersøgt<br />
nøjere. Efterhånden som et stigende antal rapporter om familier<br />
med kræft blev offentliggjort, fik forskerne dog i højere<br />
grad øjnene op for sammenhængen mellem arv og kræft.<br />
Man har fundet familier, der var hårdt ramt af brystkræft i<br />
en tidlig alder. Denne arvelige kræftrisiko kan føre til brystkræft<br />
hos mænd, men det sker sjældent. Andre familier har<br />
mange tilfælde af tyktarmskræft, som bryder ud i en tidlig<br />
alder. Forskerne har fundet en række gener, der er defekte i<br />
de ramte familier. De defekte gener kan føre til, at de mekanismer,<br />
der reparerer DNA’et, ikke længere fungerer. Derfor<br />
er der øget risiko for, at den defekte celle muterer yderligere,<br />
og på et tidspunkt kan en sådan celle udvikle sig til en<br />
kræftcelle.<br />
En af de tidligste teorier for sammenhængen mellem arv<br />
og kræft går ud på, at begge alleler (to tilsvarende gener – ét<br />
på hver sit kromosom) skal være defekte, for at fejlen kommer<br />
til udtryk. Det betyder, at der skal to mutationer i en normal<br />
celle til, før defekten mærkes – f.eks. skal begge kopier<br />
af et reparationsenzym være ude af funktion, før en given<br />
DNA-skade ikke bliver repareret. Mens en person i en belastet<br />
familie allerede har nedarvet en fejl i den ene allel,<br />
skal der kun én mutation til i den anden, for at fejlen kommer<br />
til udtryk.<br />
Figur 4.3. I en normal celle er én ændring i det ene gen ikke nok, for at det<br />
pågældende genprodukt ikke længere fungerer. I en normal celle vil den<br />
ikke-muterede allel overtage det muterede proteins funktion. Begge alleler<br />
af genet må sættes ud af spillet, for cellen mangler den funktion, genproduktet<br />
skulle udføre. Hvis et defekt gen er arvet, er én mutation i den funktionsdygtige<br />
allel nok.<br />
Selvom der er mange i ens egen familie, som har fået kræft,<br />
er det ikke nødvendigvis ensbetydende med, at man selv har<br />
forøget risiko. For det første skal det bekræftes, om kræfttilfældene<br />
rent faktisk skyldes en nedarvet form for kræft.<br />
Kræft er så almindelig en sygdom, at man ikke behøver at<br />
være specielt udsat, fordi flere i ens nærmeste familie rammes<br />
af kræft. (Hver tredje rammes af kræft, og det anslås, at<br />
mindre end 5 pct. af alle kræfttilfælde er arveligt betinget).<br />
For det andet: Selvom én af ens forældre viser sig at være<br />
bærer af en gendefekt, der disponerer for kræft, er det ikke<br />
Udvikling af kræft<br />
21
sikkert, man selv arver fejlen. Det sker i halvdelen af tilfældene.<br />
Sidst skal det lige nævnes, at en nedarvet disponering<br />
for kræft ikke nødvendigvis kommer til udtryk – dvs. det er<br />
ikke sikkert, at en bærer af et defekt gen rent faktisk udvikler<br />
kræft i løbet af livet. Det afhænger af, hvilket gen der er defekt,<br />
og også hvilken defekt i genet der er tale om.<br />
De kliniske genetikere, som vejleder familier om en eventuel<br />
forøget risiko for kræft i familien, angiver tre faktorer,<br />
der tyder på en arvelig disposition for kræft i familien:<br />
· Adskillige personer i den nære familie med samme slags<br />
kræft<br />
· Kræft, der rammer i en tidlig alder<br />
· Den samme person rammes af flere tilfælde af kræft<br />
Selvom der er flere kræfttilfælde i en familie, er det ikke sikkert,<br />
at det skyldes en arvelig disposition. Og selvom der er<br />
en gendefekt i familien, er det ikke sikkert, at den enkelte<br />
arver fejlen. Og selvom man er bærer af genfejlen, er det<br />
ikke sikkert, man udvikler kræft.<br />
Der blev for alvor sat fokus på de arvelige former for kræft,<br />
da det viste sig, at flere former for tyktarmskræft skyldtes arvede<br />
dispositioner. Siden har også nogle få procent af alle<br />
brystkræfttilfælde vist sig at være nedarvet. Den udløsende<br />
biologiske mekanisme viser sig at være forårsaget af mutationer<br />
i reparationsenzymer. Hvis mutationer fjerner cellens<br />
mulighed for at reparere sit DNA, vil antallet af fejl i cellen<br />
stige, og risikoen for, at de nye mutationer rammer andre<br />
kræftgener, og cellen og dens efterkommere udvikler sig til<br />
kræft, er stærkt forøget. F.eks. er der en risiko for, at cellens<br />
deling kommer ud af kontrol.<br />
22 Kort om kræft<br />
4.2. Cellerne deler sig uhæmmet<br />
Ét af kendetegnene for kræft er kræftcellernes evne til at dele<br />
sig uhæmmet. Når cellerne deler sig uhæmmet, skal de bl.a.<br />
sætte sig ud over de signaler, der fortæller, at de er uønskede,<br />
og at der ikke er plads. De skal gå uden om de bremser,<br />
der er i cellens cyklus.<br />
Lige meget hvilken kræftform man kigger på, så har kroppen<br />
mistet kontrollen over cellens cyklus, og udfaldet er altid<br />
det samme: Kræftcellerne deler sig ukontrolleret. Ordet cyklus<br />
stammer fra græsk og betyder ring. Man bruger ordet til<br />
at beskrive ting, som gentager sig igen og igen og foregår på<br />
præcis den samme måde.<br />
Den normale celle er ikke i delingsfasen hele tiden, men<br />
udfører i det, man kalder hvilefasen (G 0 – G står for gap) de<br />
funktioner, den er bestemt til. Når cellen går fra denne hvilefase<br />
over i de forberedende øvelser før celledeling (G 1 ),<br />
begynder cellen af vokse. Det er også i denne første fase af<br />
cellecyklusen, at cellen endeligt beslutter, om den skal dele<br />
sig eller lade være. Sent i G 1 -fasen er der nemlig et punkt,<br />
som man kalder restriktionspunktet, og som populært kaldes<br />
"point of no return". Når cellen er forbi dette punkt, vil den<br />
gennemføre celledelingen og dermed bevæge sig gennem<br />
de sidste tre faser af cellecyklus. Først i S-fasen, hvor DNA<br />
bliver duplikeret, dannes der præcise kopier af kromosomerne,<br />
således at der bliver 23 par kromosomer. Efter syntesen<br />
af DNA går cellen over i fase G 2 , hvor cellen forbereder<br />
sig til den endelige celledeling, mitosen. I M-fasen (M står<br />
for mitose), deler cellen sig i to celler med lige mange kromosomer.<br />
De to nye celler er født ind i G 1 -fasen. Her vil tilstedeværelsen<br />
af vækstfaktorer og antivækstfaktorer bestemme,<br />
Figur 4.4. Cellens cyklus består af fem faser (G 0, G 1, S, G 2 og M) og et restriktionspunkt. Den fysiske deling af cellen foregår i M-fasen (mitose). Resten af<br />
cellecyklus bruges til forberedelse af mitosen. Billedet forestiller en lungecelle fra en salamander (60 gange forstørret), som befinder sig i M-fasen og derfor<br />
er meget tæt på at dele sig. Mitosen (M) er også opdelt i forskellige faser, og helt præcist befinder lungecellen sig i metafasen (den eneste fase, hvor kromosomerne<br />
er synlige i cellen). Kromosomerne (blå), som blev kopieret i S-fasen, ligger på en linie midt i cellens "ækvator" (cellekernen er forsvundet på<br />
dette tidspunkt) og venter på, at hvert søsterkromatid (det duplikerede kromosom består af to søsterkromatider) bliver trukket fra hinanden af cellens mikrotubuli<br />
(grøn). Kromosomer og mikrotubuli er omgivet af et "bur" af keratin (rød). Keratin er en del af cellens skelet.
om cellen skal tage rundt med cyklusen og dermed dele sig<br />
endnu en gang eller bevæge sig fra G 1 og ind i G 0 midlertidigt<br />
eller permanent.<br />
Kontrollen over cellens deling er gået tabt i kræftceller.<br />
Det kan f.eks. skyldes, at en mutation i en særlig slags kræftgener,<br />
de såkaldte proto-onkogener, har aktiveret det dertil<br />
hørende protein, så det konstant sender signal til cellekernen<br />
om, at cellen skal dele sig. Det muterede proto-onkogen er<br />
i så tilfælde blevet omdannet til et onkogen (se afsnit 4.3 om<br />
proto-onkogener og onkogener).<br />
Ud over restriktionspunktet, som bestemmer, om cellen<br />
skal gå i gang med en deling, når der er mange vækstfaktorer<br />
til stede, så er der andre punkter i cyklusen, hvor delingen<br />
kan blive stoppet i normale celler. I G 1 - og G 2 -fasen er der<br />
checkpoints, hvor delingen kan stoppes, hvis der er sket en<br />
skade på DNA'et. Herved undgås det, at skaderne bliver ført<br />
videre til de to nye celler. Hvis DNA'et ikke bliver repareret<br />
ved disse checkpoints, vil cellen begå selvmord, således at<br />
den skadede celle forsvinder.<br />
Figur 4.5. Cellens cyklus er udstyret med checkpoints, hvor cellen kan stoppe<br />
og reparere eventuelle DNA-skader. Hvis DNA-skaden er uoprettelig,<br />
begår cellen selvmord. Bemærk restriktionspunktet, som ligger lige efter et<br />
checkpoint.<br />
Kræftceller har ofte mistet deres checkpoints. Det vil sige, at<br />
de ikke kan stoppe op og gøre DNA-skader gode igen. De<br />
kan heller ikke få cellen til at begå selvmord, hvis DNA-skaden<br />
er særlig slem. Cellen med det skadede DNA får altså<br />
lov til at fortsætte gennem cellecyklus. De to celler, som er<br />
det endelige produkt af cyklus, vil begge indeholde skadet<br />
DNA. Hvis DNA-skaden har ramt et særligt gen (et protoonkogen<br />
eller et tumorsuppressorgen, se afsnit 4.3), kan det<br />
være kimen til, at cellen udvikler sig til en kræftcelle.<br />
4.3. Cellernes signaler virker ikke<br />
I en kræftcelle er der problemer med signalerne. Der kan<br />
mangle signaler, som normalt styrer cellen. Der kan være<br />
kommet nye signaler, eller signalernes karakter kan være<br />
ændret. Alle disse ændringer skyldes mutationerne i kræftcellens<br />
specielle kræftgener, der kaldes proto-onkogener.<br />
Proto-onkogener adskiller sig ikke fra de andre gener, der er<br />
involveret i celledeling, og er derfor en nødvendig og natur-<br />
lig del af cellens liv. Men hvis der opstår en fejl – en mutation<br />
– i et proto-onkogen, kan det føre til, at cellen deler sig<br />
ukontrolleret. Når et proto-onkogen får en mutation, som<br />
gør det kræftfremkaldende, kalder man det muterede gen for<br />
et onkogen. Et proto-onkogen svarer altså til et onkogen på<br />
nær en mutation. Et kræftgen er et hvilket som helst gen, der<br />
er involveret i kræft. Et onkogen er et kræftgen, der pga. en<br />
mutation konstant producerer et aktivt protein.<br />
En tilfældig mutation i et proto-onkogen er ikke nok til at<br />
skabe en kræftcelle. Der skal flere mutationer til af flere forskellige<br />
proto-onkogener, da der er flere signaler, der styrer<br />
cellens deling og dermed muligheden for at dele sig uhæmmet.<br />
Kræftcellen skal altså have flere mutationer, som har<br />
ændret de relevante proto-onkogener til onkogener. Og det<br />
skal være ganske særlige mutationer, der aktiverer det tilhørende<br />
protein, og ikke mutationer, der hindrer proteinets<br />
funktion.<br />
Det er ikke cellen, der selv styrer udviklingen mod en kræftcelle,<br />
men tilfældige og uheldige mutationer. Antallet af mutationer<br />
afhænger af påvirkninger udefra, f.eks. i form af kræftfremkaldende<br />
kemikalier eller stråling.<br />
Figur 4.6. Normale celler deler sig kun, når de får besked på det fra andre<br />
celler. Nogle kræftceller kan både producere og modtage egne vækstfaktorer.<br />
Kræftcellen kan give sig selv besked på, at den skal dele sig.<br />
Onkogener sørger ofte for, at kræftcellerne konstant får signal<br />
om at dele sig. Disse signaler til cellen kan komme fra<br />
naboceller i det væv, hvor cellen befinder sig (parakrin signalering)<br />
eller også fra blodbanen, hvor signalerne kan være<br />
produceret et helt andet sted i kroppen (endokrin signalering).<br />
På den måde indgår cellerne i et tæt samarbejde med<br />
resten af kroppen, som sørger for, at hvert væv opretholder<br />
sin rette størrelse og en struktur, som er forenelig med kroppens<br />
behov.<br />
Nogle få celler, og især kræftceller, kan både producere og<br />
modtage deres egne signaler (autokrin signalering). Ved selv<br />
at lave og modtage signaler via autokrin signalering får kræftcellerne<br />
hele tiden signaler om at dele sig.<br />
Udvikling af kræft<br />
23
Figur 4.7. Tre former for hormonsignalering: Endokrin (græsk: endon = indvendig),<br />
parakrin (græsk: para = ved siden af) og autokrin (græsk: autos =<br />
selv) signalering. Mange kræftceller opnår evnen til at stimulere deres egen<br />
vækst ved hjælp af autokrin stimulering.<br />
Mens cellen er under konstant pres for at undergå celledelinger<br />
pga. af aktive signalproteiner, prøver andre proteiner, de<br />
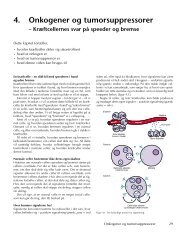
såkaldte tumorsuppressorer, at stoppe celledelingen. Onkogenerne<br />
er altså celledelingens speedere, der presser på, for at<br />
cellen skal dele sig. Tumorsuppressorerne er cellens bremser,<br />
der slår hælene i og forsøger at stoppe cellens deling. Desværre<br />
er tumorsuppressorerne også defekte i kræftcellerne, f.eks.<br />
restriktionspunktet i alle kræftceller. Ved restriktionspunktet<br />
burde den uautoriserede celledeling kunne stoppes, men defekter<br />
i tumorsuppressorerne, der styrer dette punkt, forhindrer<br />
kontrol med celledelingen.<br />
4.4. Cellerne begår ikke selvmord – apoptose<br />
Mens du læser dette, begår flere millioner celler selvmord i<br />
din krop. Cellernes selvmord er en naturlig del af kroppens<br />
balance og bliver kaldt apoptose. Apoptose stammer fra græsk<br />
og betyder at "falde af", som træernes blade gør det om efteråret.<br />
Når en celle er overflødig eller skadet, "falder den af"<br />
24 Kort om kræft<br />
ved at blive mindre for derefter at blive spist af en nabocelle<br />
eller en makrofag (en speciel type celle, der bl.a. spiser andre<br />
celler).<br />
Cellernes selvmord er en af organismens metoder til at beskytte<br />
sig mod skader i cellerne. Celler, der udvikler sig til<br />
kræft, må overskride denne barriere for at overleve de mange<br />
mutationer. De mutationer, der gør det muligt for de spirende<br />
kræftceller at dele sig uhæmmet, vil opfattes som skader, og<br />
cellerne vil derfor forsøge at begå selvmord. Hvis det lykkes,<br />
vil de skadede celler udrydde sig selv og kroppen være i<br />
balance. Men hvis en af de skadede celler mister evnen til at<br />
begå selvmord (ved en mutation i et af de gener, som styrer<br />
selvmordsprocessen), bliver den til en spirende kræftcelle.<br />
Den overlever med skader og vil dele sig uhæmmet og muligvis<br />
danne en kræftsvulst. På den måde kan en mistet evne<br />
til selvmord være kimen til kræft.<br />
Figur 4.8. Normalt væv: Hver gang en celle deler sig og bliver til to, skulle<br />
vævet blive en celle større ( ). Men en celledeling følges op af en<br />
anden celle, som begår selvmord ( ), og så er den rigtige størrelse<br />
af vævet genoprettet. Der er balance mellem celledeling og selvmord.<br />
En mutation: Den giver en ellers normal celle evnen til at dele sig ukontrolleret<br />
( ), men fører ikke til en kræftsvulst. Mutationen i cellen opfattes<br />
nemlig som en skade, og cellen vil øjeblikkeligt svare igen ved at begå<br />
selvmord ( ).Den skadede celle forsvinder, og balancen i vævet vil<br />
være genoprettet.<br />
To mutationer: Men mister cellen, med en ny mutation, evnen til at begå<br />
selvmord ( ), vil den skadede celle få lov til at overleve og dele sig<br />
ukontrollabelt. Det vil føre til dannelse af en kræftsvulst. Der er ubalance.<br />
Det var længe et overset fænomen, at en celle er i stand til<br />
at begå selvmord. Og da opdagelsen endelig blev gjort af et<br />
skotsk forskerhold i 1972, blev den stort set ignoreret. Det<br />
var først mere end 10 år senere, forskerverdenen fik øjnene<br />
op for denne mekanisme.<br />
Man kan undre sig over, at normale cellers selvmord ikke<br />
blev opdaget før. For hver gang en celle bliver til to, skal der<br />
forsvinde en i den anden ende. Hvis det ikke var tilfældet,
ville fuldt voksne mennesker blive ved med at vokse, og<br />
kæmperne fra eventyrerne ville genopstå. Balancen i vores<br />
organer og væv ville forstyrres, og vores krop ville gå i stykker.<br />
En af grundene til, at opdagelsen kom så sent, var, at cellens<br />
selvmordsproces foregår meget hurtigt. Der er tale om<br />
minutter. Og umiddelbart efter selvmordet bliver den døde<br />
celle spist af nabocellen og forsvinder. Det, som alligevel<br />
nåede at springe forskere i øjnene, var den særlige måde,<br />
cellen tog sig ud på under selvmordet.<br />
Figur 4.9. Nummer to celle fra venstre begår selvmord. Det starter med, at<br />
DNA'et fortættes og bliver synligt (A). Cellen skiller sig fra naboceller, og<br />
cellen falder sammen (B). Cellen splittes i små dele (C) og fagocyteres til<br />
sidst af naboceller eller makrofager (D).<br />
Cellerne er indbyrdes afhængige af hinanden og lytter til hinanden.<br />
Cellen får hele tiden at vide fra de andre celler, at der<br />
er brug for den. I cellerne findes der et dødsprogram, som<br />
kan tændes, hvis cellerne får at vide, at der ikke er brug for<br />
dem mere. Hvis cellerne er skadede eller overflødige, fordi<br />
der er celler nok i forvejen, vil de ikke modtage et signal,<br />
som fortæller, at der er brug for dem.<br />
Kræftceller har gjort sig uafhængige af andre celler ved at<br />
producere egne vækstsignaler. Derfor "tror" kræftcellerne, at<br />
der hele tiden er brug for dem, selvom de ikke modtager<br />
vækstfaktorer fra de normale naboceller. Det vil sige, at kræftcellerne<br />
ikke begår selvmord, selvom de er overflødige.<br />
En anden måde for kræftcellerne at beskytte sig mod selvmord<br />
er at inaktivere de mekanismer, der skal føre selvmordet<br />
ud i livet. Forskere har bl.a. fundet frem til to forskellige<br />
proteiner, der stopper selvmordsprogrammet i kræftcellen,<br />
selvom omgivelserne gør alt, hvad de kan for at aktivere programmet.<br />
Ved laboratorieforsøg, hvor man har fjernet et af de to<br />
proteiner, henholdsvis kaldet survivin og Hsp-70, fra kræftcellerne,<br />
døde de spontant. Hvis disse resultater kan overføres<br />
til kræftpatienter, vil forskerne være tæt på en behandling.<br />
Men der er langt fra forsøg i petriskåle og til at få metoderne<br />
til at virke på patientens kræftceller.<br />
Forsøgene med Hsp-70 og survivin er stadig i en meget tidlig<br />
fase. Forskningen i cellers selvmord har åbnet forskernes<br />
øjne for en helt anden side af kræftcellernes liv og død. Og<br />
selvom kuren mod kræft ikke er lige rundt om hjørnet, knytter<br />
den nye viden alligevel håb til, at man bedre kan målrettet<br />
behandlingen.<br />
4.5. Kræftcellerne bliver ikke gamle – telomerase<br />
Selvom den spirende kræftcelle nu kan dele sig ukontrolleret<br />
og stadig undgå at begå selvmord, betyder det ikke, at<br />
den kan dele sig uendeligt. Endnu en barriere skal brydes,<br />
før kræftcellen har opnået det uendelige liv. Normalt kan<br />
celler nemlig kun dele sig et begrænset antal gange. Efter<br />
mange celledelinger, hvor cellen er blevet til to celler, bliver<br />
cellen gammel. Cellerne går på pension og beslutter, at de<br />
ikke vil dele sig mere. Beslutningen om at stoppe er uigenkaldelig.<br />
Ved forsøg med bindevævsceller fra en nyfødt baby så<br />
man, at cellerne gennemløb mitosen 80 til 90 gange, hvorefter<br />
de døde. Ved samme forsøg med bindevævsceller fra<br />
en 70-årig mand kan cellerne kun gennemløbe mitosen 20<br />
til 30 gange (se figur 4.11).<br />
Forklaringen på, at cellerne "ældes" og har sværere ved at<br />
opretholde livsprocesserne, findes i opbygningen af kromosomerne,<br />
og hvad der sker under duplikeringen.<br />
I enden af hver DNA-streng og dermed i hver kromatid i<br />
kromosomerne sidder der lange rækker af ens koder med<br />
samme sekvens TTAGGG. Denne sekvens gentages et par<br />
tusinde gange, og sammen med proteiner, som klæber sig til<br />
nukleotiderne, udgør de telomererne.<br />
Udvikling af kræft<br />
25
Telomererne danner en slags prop i begge ender af kromosomet<br />
og sørger for, at kromosomenderne er stabile og ikke<br />
bliver nedbrudt. Men telomererne sørger også for, at de<br />
ellers klistrede kromosomender (uden telomerer) ikke klæber<br />
sig sammen ende mod ende. På den måde sørger telomererne<br />
for, at kromosomerne forbliver selvstændige og ikke<br />
blander sig med hinanden, så der opstår genetisk kaos.<br />
Hver gang cellen deler sig, mistes et stykke af telomererne,<br />
og efter tilstrækkeligt mange delinger siger den normale<br />
celle stop og tillader ikke flere celledelinger. Man kan sammenligne<br />
telomererne med et gammeldags klippekort til<br />
bussen, hvor klippene til sidst slipper op, og hvis man siden<br />
skal med bussen igen, må man snyde. Og det er lige, hvad<br />
kræftcellerne gør.<br />
Figur 4.11. Telomerlængden bestemmer, hvor mange gange en celle kan<br />
dele sig. Sammenligner man telomerlængden i en baby med en 70-årigs, vil<br />
babyens telomere være meget længere, og det vil sige, at babyen har mange<br />
flere celledelinger "tilovers" end den 70-årige.<br />
De spirende kræftceller gennemgår mange delinger, inden<br />
de har dannet en kræftsvulst. Derfor må disse celler kunne<br />
sætte sig ud over "aldringsprocessen", hvor telomererenderne<br />
bliver opbrugt. Men hvordan gør de det?<br />
26 Kort om kræft<br />
Figur 4.10. Telomerer, kromosomernes endestykker,<br />
sørger for, at kromosomet ikke bliver<br />
nedbrudt, og at kromosomernes ellers<br />
klistrede ender ikke klæber sig sammen.<br />
Billedet forestiller kromosomer i metafase<br />
(den eneste fase, hvor kromosomerne er<br />
synlige), hvor hvert kromosom er blevet<br />
kopieret (består således af to søsterkromatider).<br />
I den efterfølgende fase rives de to<br />
søsterkromatider fra hinanden og ender i<br />
hver deres nye celle. Telomererne er farvet,<br />
så de fremstår rødlige, og resten af kromosomet<br />
er farvet blåt.<br />
Svaret kan findes ved at studere kønscellerne (æg og sædceller).<br />
Kønscellernes telomerer må jo ikke være korte. Det<br />
ville betyde, at barnets celler alt for hurtigt ville blive gamle<br />
og stoppe deres celledelinger. Det viser sig, at længden af<br />
telomerene i kønscellerne ikke afhænger af bærerens alder.<br />
Et enzym i kønscellerne sørger hele tiden for at erstatte tabte<br />
telomerer. Opbygning af telomererenderne sker ved hjælp af<br />
enzymet telomerase. Telomerase bliver altså ikke dannet i de<br />
fleste normale kropsceller, men i kønscellerne. Derved kan<br />
de normale cellers deling kontrolleres, uden at det går ud<br />
over vores efterkommere.<br />
De spirende kræftceller, som deler sig hele tiden, kan i<br />
begyndelsen ikke stoppe den stadige "klipning" af telomererenderne.<br />
De vil derfor på et tidspunkt løbe ind i en krise,<br />
som vil gøre det af med dem.<br />
Men de spirende kræftceller viser sig at overleve ved<br />
hjælp af endnu en mutation. En mutation, som ophæver undertrykkelsen<br />
af genet, der styrer dannelsen af telomerase.<br />
Dannelsen af telomerase gør, at den spirende kræftcelle<br />
kan stabilisere længden på de korte telomerer og undgå en<br />
krise. Fra nu af er nedbrydningen af telomererenderne ikke<br />
et problem.<br />
Hvis man kan hæmme/ophæve telomerasens aktivitet i<br />
alle de spirende kræftceller, vil det danne basis for en ny behandlingsform.<br />
4.6. Immunsystemet bekæmper kræften<br />
I de foregående afsnit har vi hørt om, hvordan kræftcellerne<br />
ændrer sig, og hvordan de opnår evnen til at dele sig konstant<br />
– ukontrolleret og uendeligt. Men uden for kræftcellerne<br />
er der også en verden, hvor andre celler påvirker den<br />
voksende svulst i et langt mere kompliceret samspil cellerne<br />
imellem. Nogle af de omgivende celler – især medlemmer af<br />
immunsystemet – prøver at bekæmpe svulsten.<br />
Når kræftcellerne udvikles fra normalceller til kræftceller,<br />
sker det ved mutationer i generne. Det medfører, at sammensætningen<br />
af proteiner i cellen ændrer sig. Dels medfører<br />
mutationerne i generne, at der dannes muterede proteiner,<br />
dels producerer cellen alt for meget af nogle andre proteiner,<br />
og dels dannes der proteiner, som cellen ikke tidligere<br />
har produceret. På ydersiden af kræftcellerne vil der være<br />
fragmenter af disse muterede, overudtrykte eller nye protein-
er. Immunsystemet vil derfor kunne genkende kræftcellerne<br />
som celler, der er fremmede for organismen, og vil forsøge<br />
at bekæmpe dem.<br />
Immunsystemet består af en palet af forskellige typer celler.<br />
En særlig type af disse celler er de såkaldte T-celler (de hedder<br />
T-celler, fordi de modnes i det organ i kroppen, der hedder<br />
thymus = brislen). De opsporer andre celler, der er fremmede<br />
for krop-pen. De genkender disse fremmede celler via<br />
stykker af protein, som findes på overfladen af kræftcellerne.<br />
Proteinstyk-kerne sidder på alle vore cellers overflade og er<br />
cellernes (og også kræftcellernes) ansigt udadtil – et ansigt,<br />
der afspejler cellens indre. Immunsystemet ignorerer proteinstykker,<br />
som det ved hører til i kroppen, men vil reagere<br />
mod celler med fremmede eller ændrede proteinstykker på<br />
overfladen. Kræftcellen bliver genkendt af T-cellerne som<br />
"noget fremmed", hvorefter T-cellerne udrydder kræftcellen<br />
selv eller tilkalder andre af immunsystemets celledræbende<br />
celler.<br />
Det kunne umiddelbart lyde, som om kroppens immunsystem<br />
sagtens kan klare at bekæmpe kræft, men situationen<br />
er mange gange en anden. Kræftceller deler sig og ændrer<br />
sig hele tiden, og derfor vil der i en kræftknude altid være<br />
genetisk forskellige kræftceller. En del af kræftcellerne kan<br />
fjernes af immunsystemet, men de opståede mutationer kan<br />
også føre til, at kræftcellerne får evnen til at gemme sig for<br />
eller bliver modstandsdygtige over for de angribende T-celler.<br />
Kræftceller kan blive resistente over for immunsystemet,<br />
ligesom bakterier kan blive resistente over for en bestemt<br />
type antibiotika. De modstandsdygtige kræftceller kan deref-<br />
Figur 4.12. Med genopstandelsen<br />
af telomerasen overlever en<br />
spirende kræftcelle krisen og<br />
kan herfra dele sig i en uendelighed.<br />
ter gro uhindret og danne en ny svulst, som immunsystemet<br />
ikke kan bekæmpe. Mange mener, at hovedårsagen til, at<br />
kræftceller overhovedet får lov til at vokse i vores krop, skyldes<br />
cellernes evne til at undvige immunsystemet.<br />
Forskerne forsøger at stimulere immunforsvaret ved at<br />
tage særlige celler ud af kroppen og påvirke dem i reagensglas,<br />
inden de bliver ført tilbage i kræftpatienten. Det sker<br />
f.eks. i forsøg med immunterapi, hvor T-celler stimuleres til<br />
at bekæmpe kræften. Ved at påvirke T-cellerne mod et protein<br />
eller måske bare et stykke af et protein, som kræftcellerne<br />
producerer, kan man aktivere T-celler mod dette protein<br />
og altså celler, som producerer dette protein.<br />
I stedet for at arbejde med T-celler i reagensglas og påvirke<br />
dem der er en anden form for immunterapi ved at blive<br />
udviklet. Her tager man ikke T-celler, men immunforsvarets<br />
advarselsceller – de såkaldt dendritiske celler – ud af kroppen.<br />
I reagensglas stimuleres disse dendritiske celler med<br />
proteiner, der især udtrykkes af kræftceller. De dendritiske<br />
celler vil nu, når de bliver ført tilbage i patienten, fortælle<br />
immunsystemet, hvilke proteiner det skal genkende. Derved<br />
vil der blive aktiveret mange slags T-celler i patientens krop,<br />
og der vil være større chancer for, at alle typer af kræftceller<br />
i en svulst vil blive bekæmpet.<br />
Immunterapi kan foretages på to forskellige metoder: den<br />
passive og den aktive. Ved passiv immunterapi tilfører man<br />
patienten en del af immunsystemets celler. Det kan for eksempel<br />
være T-celler, der er blevet stimuleret med kræftspecifikke<br />
proteiner i laboratoriet. I sådanne tilfælde isolerer man<br />
typisk T-celler fra patientens blod, opformerer dem, stimule-<br />
Udvikling af kræft<br />
27
Figur 4.13. Passiv og aktiv immunterapi.<br />
1. Passiv immunterapi.<br />
A. T-celler tages fra patientens blod. B. T-celler opdyrkes i laboratoriet og stimuleres<br />
med kræft-specifikke antigener. C. De stimulerede T-celler sprøjtes ind i<br />
patienten, hvorefter de aktiverede T-celler kan slå patientens kræftceller ihjel.<br />
rer dem med kræftproteiner eller kræftceller<br />
og sprøjter dem ind i patienten<br />
igen. Samtidig kan man sprøjte forskellige<br />
vækstfaktorer ind, der stimulerer Tcellerne<br />
yderligere. I kroppen finder Tcellerne<br />
frem til de kræftceller eller proteiner, de er blevet<br />
stimuleret med, hvorefter kræften kan bekæmpes.<br />
Aktiv immunterapi svarer til vaccination. Ved en vaccination<br />
stimulerer man immunsystemets celler med kræftspecifikke<br />
proteiner, der sprøjtes ind. Næste gang T-cellerne støder<br />
på det samme protein, er de forberedt og klar til angreb.<br />
Immunterapi af kræftpatienter har indtil videre kun vist sig<br />
som en begrænset succes. Den klassiske metode, hvor man<br />
forsøger at udnytte T-cellernes evne til at slå fremmede celler<br />
ihjel, har vist sig kun at have en lille effekt. Da den<br />
nuværende tilgang samtidig er besværlig, skal denne teknik<br />
udvikles yderligere for at blive til fremtidens behandling.<br />
Vaccineforsøgene med dendritiske celler tegner mere<br />
lovende. Adskillige forsøg på verdensplan er i gang, og selvom<br />
det stadig er undtagelsen, at patienter bliver helbredt på<br />
denne måde, ser immunologerne lyst på mulighederne for,<br />
at immunterapi kan blive et reelt tilbud til fremtidens kræftpatienter<br />
eventuelt i kombination med kemoterapi.<br />
28 Kort om kræft<br />
2. Aktiv immunterapi.<br />
Kræftspecifikke proteiner (eller dendritiske celler<br />
med fragmenter af kræftspecifikke proteiner)<br />
sprøjtes ind i patienten. Herefter vil kroppens Tceller<br />
blive aktiveret og gå til angreb på patientens<br />
kræftceller. Denne form for immunterapi<br />
kaldes også for vaccine.<br />
4.7. Cellerne får næring til fortsat vækst –<br />
angiogenese<br />
For at væv og celler kan eksistere, skal der<br />
tilføres næring og ilt (O 2 ). Det gælder især for<br />
kræftceller, som pga. de konstante celledelinger<br />
har større behov for mere næring end de fleste<br />
andre celler. Ilt kan trænge igennem cellelagene<br />
i vævet, men efter ca. 10 cellelag, svarende<br />
til ca. 100 µm, vil iltkoncentrationen i vævet<br />
blive så lille, at cellerne lider af iltmangel.<br />
Figur 4.14. Diffusion af ilt i væv. Iltkoncentrationen i vævet falder, jo længere<br />
der er til nærmeste blodåre. 100-200 µm inde i vævet er iltkoncentrationen<br />
så lille, at cellerne lider af iltmangel.<br />
Cellerne er afhængige af en konstant forsyning af næring fra<br />
blodstrømmen. Når væv skal repareres, vil evnen til at danne<br />
nye blo<strong>dk</strong>ar blive vakt til live igen for at gendanne det<br />
ødelagte – det samme sker, hvis vi får kræft. Denne dannelse<br />
af nye blo<strong>dk</strong>ar kaldes for angiogenese (angio = kar, genese =<br />
dannelse).<br />
Alle kræftsvulster har behov for ekstra blod. Celledeling<br />
er en særdeles energikrævende proces (f.eks. skal 3 milliarder<br />
par nukleotider kopieres før hver celles deling), og det<br />
eksisterende net af blo<strong>dk</strong>ar kan slet ikke understøtte den<br />
kraftige vækst, kræftcellerne ønsker. Man regner med, at en<br />
svulst, der er større end 2 mm i diameter (det svarer til ca.<br />
50.000 celler), kræver angiogenese. Det voksende kræftvæv<br />
har altså behov for nye blo<strong>dk</strong>ar.<br />
I væv, hvor der allerede er et modent og udvokset system<br />
af blo<strong>dk</strong>ar, sker en anderledes proces ved dannelse af blo<strong>dk</strong>ar,<br />
end når blodsystemet opbygges i fostertilstanden. Pro-
cessen kaldes angiogenetisk spiring, idet det allerede etablerede<br />
netværk af blodårer kan danne sideskud på blo<strong>dk</strong>arret.<br />
Det er en vigtig proces, når kroppen skal vedligeholdes,<br />
f.eks. når der dannes sår og blodpropper.<br />
Blo<strong>dk</strong>arrene er opbygget af en række celler og proteiner,<br />
hvor de vigtigste celler er endotelcellerne. Det er endotelceller,<br />
som forer karret, som blodet føres frem i. Den angiogenetiske<br />
spiring kan deles op i tre delprocesser – først en<br />
løsning af endotelcellerne i området (hvor det nye blo<strong>dk</strong>ar<br />
skal dannes), dernæst dannelsen af det nye blo<strong>dk</strong>ar (hvor<br />
nye endotelceller danner nye blo<strong>dk</strong>ar ind i svulsten) og sidst<br />
modning af de nye blo<strong>dk</strong>ar (hvor de løsnede celler fastgøres<br />
til hinanden og det omgivende væv).<br />
Kræftceller forsøger at kontrollere nærmiljøet, herunder<br />
også dannelsen af nye blo<strong>dk</strong>ar. Populært kan man sige, at når<br />
cellerne i en svulst får iltmangel, udsender de signalstoffer,<br />
der starter spiringen af nye blo<strong>dk</strong>ar.<br />
Hvis man kunne styre kræftsvulsternes dannelse af blo<strong>dk</strong>ar,<br />
ville man kunne hæmme svulstens udvikling og i kombination<br />
med anden behandling fjerne kræften. Det viser sig,<br />
at kræftsvulsternes blo<strong>dk</strong>ar er anderledes end normale blo<strong>dk</strong>ar.<br />
De modner ikke ordentligt. Hvis man kan udnytte denne<br />
forskel mellem normale og syge blo<strong>dk</strong>ar, kan man behandle<br />
kræft mere effektivt end i dag.<br />
Dannelsen af nye blo<strong>dk</strong>ar er så kompliceret en proces, at<br />
forskerne kun vanskeligt kan undersøge angiogenesen i reagensglas.<br />
Derfor må forskerne bruge dyreforsøg – typisk<br />
mus. Når man undersøger kræftcellers opførsel i mus (kaldet<br />
in vivo), opdyrkes cellerne først i reagensglas (kaldet in vitro).<br />
Derefter sprøjtes mellem 100.000 og 5 mio. kræftceller<br />
ind i musen – oftest lige under huden. Alt afhængig af kræftcellerne<br />
vil der nu i løbet af 14-60 dage dannes en svulst,<br />
som kan undersøges. Ofte vil kræftceller, der er aggressive,<br />
kunne danne kolonier af kræftceller andre steder i kroppen.<br />
Man siger, at de kan danne metastaser.<br />
Et unikt forsøg fandt sted i 1994 med nogle specielle<br />
kræftceller. De specielle kræftceller, vi taler om her, danner<br />
primærsvulster som andre kræftceller, men tilsyneladende<br />
ikke metastaser. Indtil forskerne prøvede at kurere musen<br />
ved at fjerne den først dannede svulst, der sad under huden<br />
(primærsvulsten). Så voksede der metastaser frem i lungerne.<br />
Forskernes konklusion på forsøget var, at de specielle kræftceller<br />
i primærsvulsten var i stand til at påvirke og altså undertrykke<br />
væksten af deres egne celler rundt om i kroppen.<br />
Figur 4.16. Metastaseringen påvirkes af primærsvulsten. To mus har begge<br />
fået sprøjtet kræftceller ind under huden. Efter 14 dage fjernes den dannede<br />
svulst i den ene mus. Mens musen med den bevarede svulst ikke får<br />
metastaser, vil den opererede mus udvikle metastaser i lungerne.<br />
Alt dette var et mysterium, indtil amerikanske forskere viste,<br />
at denne undertrykkelse af metastaseringen skyldtes et nedbrydningsprodukt<br />
fra primærsvulsten, angiostatin. De viste,<br />
at angiostatin hæmmede angiogenesen, dannelsen af nye<br />
blodårer – og at stoffet blev dannet af kræftcellerne selv. Evnen<br />
til at danne nye blodårer er meget vigtig for kræftcellerne,<br />
og processen kan altså styres. Det lykkedes at oprense<br />
angiostatin, som, når det blev sprøjtet ind i kræftsyge mus,<br />
fik blodårerne omkring kræftsvulsten til at kollapse. Det<br />
medførte, at kræftcellerne blev kvalt, og at musen fik det<br />
bedre. Det var ikke selve kræftcellerne, der blev ramt af stoffet,<br />
men udelukkende de omgivende endotelceller.<br />
Denne forskning har medført en jagt på andre stoffer, der<br />
kan kvæle kræften. Hvis det lykkes at finde et effektivt stof,<br />
der ikke hæmmer andre processer i kroppen, vil blodtilførslen<br />
kunne stoppes uden større bivirkninger. Desuden vil<br />
kræftsvulsten ikke udvikle resistens, da det ikke er kræftcellerne,<br />
der rammes af behandlingen. Og sidst, men ikke<br />
mindst vil en sådan behandling formentlig kunne gives mod<br />
mange forskellige former for kræft, da alle kræft-svulster har<br />
brug for ilt og næring. Der er håb for enden af blodbanen.<br />
Figur 4.15. Tre trin i dannelse af nyt netværk af<br />
blo<strong>dk</strong>ar omkring en svulst. En voksende svulst<br />
bestående af røde celler ses i hver af de tre<br />
figurer. Små svulster danner deres egne blo<strong>dk</strong>ar<br />
ved at frigive vækstfaktorer, der fremmer<br />
angiogenetisk spiring. I A mangler den tidlige<br />
svulst endnu ikke ilt. I B er iltmanglen blevet<br />
så stor, at den kalder på blodforsyning via<br />
vækstfaktorer. I C er de nye blodårer dannet.<br />
Udvikling af kræft<br />
29
4.8. Cellerne kan sprede sig – metastasering<br />
Hvis kræftcellerne bare blev på deres oprindelige plads og<br />
udviklede sig til en afgrænset svulst, ville kræft være et meget<br />
mindre problem. Den ville være meget lettere at kurere<br />
ved et kirurgisk indgreb.<br />
Men kræftcellerne får desværre ofte evnen til at arbejde<br />
sig ind i det omkringliggende væv samt løsrive sig og grundlægge<br />
søsterkolonier, metastaser, forskellige steder i kroppen.<br />
Det er denne spredning, metastaseringen, der især gør kræft<br />
til en dødelig sygdom.<br />
Hvis man kendte tilstrækkeligt til processerne i metastaseringen<br />
og havde metoder til at hindre dem, ville der være<br />
større muligheder for at helbrede flere kræftpatienter.<br />
Her følger et forenklet overblik over processerne i metastaseringen.<br />
Der er syv trin, som cellen skal igennem.<br />
1. trin: Løsrivelsen – trangen til at komme væk<br />
Langt de fleste kræfttilfælde, omkring 90 pct., opstår i epitelceller.<br />
Disse celler ligger som en hinde uden om vore organer,<br />
både udvendigt og indvendigt. Epitelcellerne bindes<br />
sammen på velcro/lynlåsfacon i cellesamlinger, der bl.a.<br />
består af proteiner, som binder sig til hinanden.<br />
En metastaserende kræftcelle skal frigøre sig fra nabocellerne.<br />
Det kræver en inaktivering af cellesamlingerne.<br />
2. trin: Mobilitet – evnen til at flytte sig<br />
Det er ikke tilstrækkeligt for en kræftcelle at rive sig løs fra<br />
primærsvulsten for at kolonisere et fremmed væv. Den må<br />
også kunne flytte sig. Det lyder måske som en detalje, men<br />
forestil dig en fodbold, der kan flytte sig af sig selv. Ikke helt<br />
så enkelt, men vigtigt for det videre forløb.<br />
Det er stadig en gåde, hvordan denne evne læres eller opstår.<br />
Tilsyneladende ændrer cellen sig. Cellen får et andet udseende<br />
og mulighed for at flytte sig nogenlunde som en larve,<br />
der griber med forenden, slipper med bagenden og hiver<br />
bagenden frem.<br />
30 Kort om kræft<br />
Figur 4.18. Velcrolukning af epitelceller. Protein fra to celler (E-cadherin)<br />
bindes til hinanden og danner en celle-celle-samling, hvor cellerne "lynes "<br />
sammen.<br />
Figur 4.19. På billedet ses en række epitelceller nydeligt på rad og række,<br />
hvor en enkelt celle afviger. Den har mistet sine bindinger til nabocellerne<br />
og har ændret udseende og er blevet mere mobil (bemærk udviklingen af<br />
"fødder", de aflange strukturer i bunden af figuren). Cellen har ændret sig,<br />
så den i højere grad er kommet til at ligne en anden, mere mobil celle.<br />
Figur 4.17. Metastaseringens syv trin, hvor en kræftcelle forlader den primære kræftsvulst og via blodbanen føres med blodstrømmen rundt i kroppen.<br />
Kræftcellen vil senere forlade blodbanen og danne en datterkoloni, en metastase, et andet sted i kroppen. Numrene illustrerer trinene beskrevet i teksten.
Nu kan cellen flytte sig, men hvor skal den hen? Mange<br />
kræftceller spreder sig først til det omkringliggende væv. Der<br />
kan kræftcellerne så forme en metastase. Når kræftcellerne<br />
har denne evne, er der også risiko for, at de har spredt sig<br />
videre og dannet fjernmetastaser i andre organer.<br />
Nogle kræftformer har celler, der meget hurtigt vil metastasere.<br />
Men det er ikke alle kræftsvulster, der danner metastaser.<br />
For eksempel spreder modermærkekræft sig meget<br />
hurtigt, mens den hyppigste hu<strong>dk</strong>ræft nærmest aldrig metastaserer.<br />
For at danne fjernmetastaser i andre organer skal<br />
kræftcellerne ud i blod- eller lymfebanen.<br />
3. trin: Fra væv til blod- eller lymfebanen<br />
Det er ikke ligetil for den mobile kræftcelle at trænge ud i<br />
blodbanen. Rundt om kræftcellerne opstår der tit en indhegning<br />
– en in<strong>dk</strong>apsling. Også blo<strong>dk</strong>arrene er omgivet af et tyndt<br />
in<strong>dk</strong>apslende lag. De eneste celler, der rutinemæssigt passerer<br />
disse in<strong>dk</strong>apslinger, er celler fra immunsystemet (typisk makrofager<br />
og lymfocytter). Den løsrevne kræftcelle skal altså nu<br />
ligne en lymfocyt og snige sig igennem in<strong>dk</strong>apslingen.<br />
Kræftcellen laver huller i hegnet med en molekylærbiologisk<br />
boltsaks, så kræftcellen kan komme enten ud af in<strong>dk</strong>apslingen<br />
omkring svulsten eller ind i blod- eller lymfebanen.<br />
Bolt-saksen er proteaser – altså proteiner, der nedbryder andre<br />
proteiner.<br />
4. trin: Overlevelse i blodbanen<br />
Ude i blodbanen er omgivelserne barske for kræftcellerne.<br />
Immunsystemet vil opfatte dem som fremmede elementer,<br />
og de trygge stimulerende rammer fra det omgivende væv er<br />
væk. En normal epitelcelle, der forvilder sig væk fra sine<br />
faste rammer, vil begå selvmord kort tid efter løsrivelsen.<br />
Derfor må kræftcellen opnå evnen at overleve i blodbanen<br />
uden at begå selvmord og samtidig være i stand til at undgå<br />
angreb fra immunsystemet.<br />
5. trin: Homing<br />
På vej rundt i blodbanen skal cellen finde et nyt sted af være.<br />
Man siger, at cellen finder hjem – eller på engelsk – at den<br />
"homer" til et bestemt organ. Dette kan f.eks. ske ved, at cellen<br />
ender i de tynde blo<strong>dk</strong>ar, kapillærerne, i leveren eller<br />
lungerne. Homing'en kan også ske mere målrettet ved, at<br />
der på bestemte steder af indersiden af blo<strong>dk</strong>arret findes<br />
nogle proteiner (receptorer), som den løsrevne celle i blodbanen<br />
kan genkende og dermed binder sig til.<br />
6. trin: Fra cirkulationen til det nye organ<br />
Den invaderende celle skal nu gennem samme prøvelser,<br />
som da den skulle trænge ind i blodbanen. Dvs. den skal<br />
gennembryde in<strong>dk</strong>apslingen af organet, og vævet skal invaderes<br />
for at grundlægge den nye koloni af kræftceller.<br />
Ud over at gennembryde in<strong>dk</strong>apslingen af organet vil proteaserne<br />
også nedbryde dele af organet. Nedbrydningen vil<br />
frigøre vækstfaktorer oplagret i vævet, som kan stimulere<br />
kræftcellens vækst.<br />
7. trin: Seed and soil<br />
For mere end 100 år siden udviklede man en teori om, hvordan<br />
en kræftcelle kunne kolonisere et organ. Det var den<br />
såkaldte seed and soil-teori. Man undrede sig over, at spredningen<br />
ikke var tilfældig, og troede derfor, at kræftcellen var<br />
tilpasset det organ, den koloniserede. F.eks. vil brystkræft<br />
ofte sprede sig til knogler (når brystkræft metastaserer, vil<br />
metastaserne i 30 pct. af tilfældene findes i knoglerne), ligesom<br />
prostatakræft i overvejende grad spreder sig til knogler<br />
(80 pct.). Mere og mere tyder på, at kræftcellerne i knoglerne<br />
er veltilpassede, og det skyldes evnen til at udnytte vækstfaktorer<br />
til deres egen vækst.<br />
Hvis man i laboratoriet dyrker kræftceller fra prostata i<br />
vækstsubstrat, der har været brugt til at dyrke knogleceller i,<br />
trives kræftcellerne. Gør man det omvendte – altså dyrker<br />
knogleceller i vækstsubstrat, der har været brugt til at vokse<br />
prostata-kræftceller i – sker det samme. Knoglecellernes vækst<br />
stimuleres. Kræftcellerne har dannet vækstfaktorer i substratet,<br />
som knoglecellerne har kunnet bruge – og vice versa.<br />
Det er cocktailen af de forskellige vækstfaktorer, der er med<br />
til at bestemme kræftcellernes evne til at metastasere til det<br />
enkelte organ.<br />
Der er altså flere faktorer, der skal passe sammen, for at<br />
en kræftcelle kan metastasere og skabe en ny koloni. Der er<br />
mange steder i forløbet, kræftcellen vil kunne dø, og derfor<br />
er det kun et mindre antal af de kræftceller, der løsriver sig,<br />
som også bliver til nye kræftsvulster. Men kræftcellerne vil<br />
hele tiden mutere, og der kan udvikles mutanter, der bliver<br />
mere og mere uafhængige af andre signaler fra kroppen.<br />
Derfor er det vigtigt at blive behandlet tidligt – og allerhelst<br />
før cellerne metastaserer.<br />
Udvikling af kræft<br />
31